基于实际问题解决的实验方案设计的教学实践
卞海燕
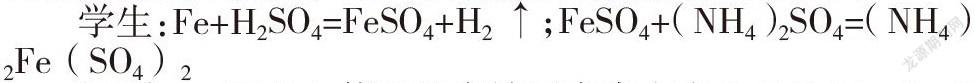

普通高中化学课程标准(2017年版2020年修订)指出要充分认识化学实验的独特价值,引导学生综合运用所学的化学知识和技能,进行实验设计和实验操作,分析和解决与化学有关的实际问题。
1教学主题内容与学情分析
高三化学复习实验方案设计部分,化学知识上涉及物质的转化、反应条件的控制、反应物的加料顺序、物质的分离提纯、离子检验等等内容,包括很多化学反应、实验设计以及实验操作。考察方式往往是真实情境下的不同复杂和陌生程度的问题解决,学生需要先从物质转化的角度总体上设计路线,再灵活选用合适具体的实验操作用文字输出。
学生在复习过程中主要存在的问题有:(1)对知识的理解不到位,如对于结晶的认识停留在氯化钠是蒸发结晶,氯化钾是降温结晶,没有提升到对结晶的本质理解层面。(2)缺乏分析解决问题的一般思路,在实验设计中不能准确的给出合理的实验路线。(3)传统的教学过程,学生在学习过程中往往被动,参与性不强。
基于以上问题,通过课堂教学如何调动学生课堂的积极主动性,提升学生对相关知识的理解,使实验设计中琐碎知识结构化,同时形成物质制备的一般思维模型,是亟待解决的问题。
2知识的教学价值
废铁制品是学生生活中非常熟悉的物品,有资料显示我们国家钢铁制品报废和浪费每年4亿吨左右,而硫酸亚铁铵用途非常广泛。如何以废铁屑制备硫酸亚铁铵,这是一个真实而富有意义的问题,引导学生讨论以废铁屑制备硫酸亚铁铵的具体实验设计为例,可以解决相关知识的碎片化问题,促使学生的知识功能化、思维路径化,感受真实而又有用的化学。
3 教学目标
进一步认识、巩固过滤、结晶、洗涤等基本实验操作和规范。
通过具体综合性问题的分析,认识物质制备的基本流程并学习构建基本的思维模型。
通过废铁屑的再利用以及定量测定产品的纯度等活动,发展科学态度和社会责任。
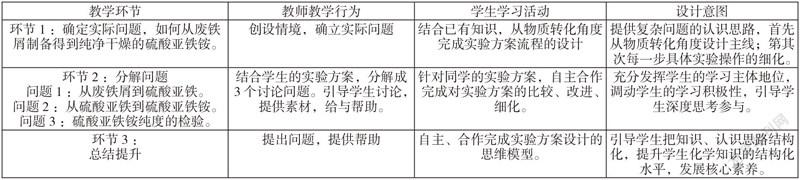
4教学流程
5教学过程
5.1实际问题的确立——如何从废铁屑制备得到纯净干燥的硫酸亚铁铵
引入真实情境:机械厂在加工机械时会产生大量铁屑,这些废料大多数厂家都把它们当做废品处理掉。硫酸亚铁铵用途十分广泛,可用做净化剂、媒染剂,医药中用于治疗缺铁性贫血,更是制备其他铁化合物的原料。如何用这些废铁屑或者其他废弃的铁制品生产化工原料或化学试剂,真正做到变废为宝,提高资源的利用率,是我们化学人需要研究的问题。
问题1:结合已有物质转化的相关知识,思考如何从铁转化为硫酸亚铁铵,写出相关物质转化流程或方程式?
学生:Fe+H2SO4=FeSO4+H2↑;FeSO4+(NH4)2SO4=(NH4)2Fe(SO4)2
问题2:工业上使用的废铁屑中常含有少量油污、S、P等其他不溶性杂质。若以此制备纯净干燥的硫酸亚铁铵,请设计合理的生产方案并简要画出实验流程图。(试剂自选)
信息1:S、P在与稀硫酸反应时会生成有毒气体H2S、PH3等
信息2:硫酸亚铁铵是浅蓝色晶体,100~110℃分解,溶于水不溶于乙醇,常温下稳定。
活动1:学生独立完成实验流程图。
信息3:
学生独立完成生产方案,画出流程图。
学生小组讨论,完善方案。
展示学生典型方案,教师把每个步骤标上序号①②③④:
废铁屑→铁屑→硫酸亚铁→硫酸亚铁铵
5.2分解問题1——从废铁屑到硫酸亚铁
教师问:请大家从原料、操作两个角度在这基础上提出你的改进意见,并说出依据,先看第①②个环节。
学生1:废铁屑需要用碳酸钠洗去表面的油污,碳酸钠水解呈碱性。
学生2:用热的饱和碳酸钠溶液,加热条件下促进碳酸钠的水解,提高去油污的速率。
学生3:硫酸是不是需要确定浓度?浓度太大铁会钝化,浓度太低,反应速率太低。
学生4:可以适当加热,也能提高废铁屑的溶解速率。
教师提供资料卡:硫酸的浓度约为3.3mol/L,一般温度控制在80℃进行。
学生5:搅拌可以增大铁屑和稀硫酸的接触面积,提高铁屑的溶解速率。
学生6:硫酸应该加过量。
学生7:硫酸分批加到没有气泡为止。
教师小结:废铁屑要用热的碳酸钠溶液浸泡除去表面的油污,倾倒掉浸泡液。再分批加入3.3mol/L的硫酸溶液,小心加热到80℃,不断搅拌至没有气泡产生,停止加硫酸。
第③个环节,我们先请同学说出你的想法,为什么通入NaOH溶液中,然后其他同学说说你的想法,同时说出你的依据。
学生8:把产生的H2S、PH3气体通入NaOH溶液,是利用了非金属气态氢化物可以和碱反应生成盐。
学生9:我觉得也把溶解过程中产生的H2S、PH3气体通入高锰酸钾里,利用气体的还原性,可以用高锰酸钾氧化,这样生成硫、磷的盐
教师小结:两种方法都可以,一个是利用的非金属气态氢化物的同性,一个是利用了-2价硫、-3价磷的还原性。
教师提供资料卡2:为防止环境污染,将酸溶生成的气体用CuSO4溶液吸收,其中PH3被CuSO4氧化为H3PO4,同时又紫色固体生成。H2S和CuSO4生成硫酸以及CuS沉淀。
5.3分解问题2——从硫酸亚铁到纯净干燥的硫酸亚铁铵
教师:第④步有没有需要改进的?
学生10:加多少硫酸铵呢?
学生11:适量
学生12:怎么判断适量呢?
学生13:不知道
教师提供资料卡:在500ml烧杯中加入26.4g硫酸铵和240ml水,搅拌下溶解后加入硫酸亚铁55.6克。
教师:加入计算量的硫酸铵固体。这样得到的产品有没有满足题设的要求?
学生14:这样得到的只是硫酸亚铁铵的溶液,要得到纯净干燥的硫酸亚铁铵,还需要蒸发浓缩,降温结晶,过滤、洗涤、干燥?
学生15:要用蒸发结晶,不能用降温结晶。因为硫酸亚铁铵的溶解度和另外两个物质相比较小,且变化不大。
学生16:根据硫酸亚铁铵的信息,硫酸亚铁铵是浅蓝色晶体,100~110℃分解,溶于水不溶于乙醇,应该用乙醇洗涤,100℃以下干燥。
5.4分解问题3——硫酸亚铁铵纯度的检验
教师提供资料卡3:将硫酸亚铁铵溶液小心缓慢加热煮沸,溶液逐渐经黄褐色转变淡蓝色,继续蒸发溶液,当烧杯壁上有晶体析出时停止加热,室温过夜滤出晶体,滤液再浓缩、结晶,合并两次过滤的晶体,在空气中干燥,得到淡蓝绿色晶体。
教师:这样制备得到的硫酸亚铁铵的纯度有没有达到要求,我们可以利用比色管(一种通过目测溶液颜色深浅测量溶液浓度的仪器)。已知纯度为Ⅲ级硫酸亚铁铵晶体的标准是:每1.0g硫酸亚铁铵晶体配制成25mL溶液后,Fe3+含量不超过0.2mg。
请写出判断制得的硫酸亚铁铵晶体样品是否达到Ⅲ级标准的实验方案?[实验中须使用的试剂有:Fe3+浓度0.2mg·(25mL)-1的溶液、1mol·L-1H2SO4溶液、1mol·L-1KSCN溶液、蒸馏水] 。
学生觉得有困难,讨论后回答.。
学生17:取1.0g硫酸亚铁铵晶体中加入几滴1mol·L-1H2SO4溶液,加入蒸馏水配成25ml的溶液,装入比色管中,再滴入几滴1mol·L-1KSCN溶液,盖上盖子。再将Fe3+浓度0.2mg·(25mL)-1的溶液装入比色管中,滴入等量1mol·L-1KSCN溶液,盖上盖子。将两只比色管对比颜色。
5.5构建无机物制备的思维模型
教师:从废铁屑到产品硫酸亚铁铵,经历几个环节?
学生18:原料到产品,需要经历预处理,除杂,制备,分离提纯,检验几个关键步骤。
教师:构建从原料到产品的思维模型,结合你已有知识,注明每一步步骤中有哪些处理方式?
学生小組讨论后汇报。
学生19:投影
(1)实验方案设计基本流程:原料→核心反应→产品→检验
(2)核心反应中包括:反应条件的控制、反应物的加料顺序、试剂的选择、尾气的处理
(3)产品的分离提纯中包括:过滤、洗涤、干燥
(4)产品的检验中包括:离子检验、浓度测定、纯度分析
6 结语
在高三化学复习过程中,选择合适的问题情境,引导学生在沉浸在实际问题的解决中,促进了学生学习方式的转变,使知识和认识思路结构化,有利于提升学生的化学学科能力。
溧阳市光华高级中学 213300

