甜瓜幼苗下胚轴长度多世代联合遗传分析
李琼 梁晓雪 李文龙 侯娟 胡建斌 黄松


摘 要:為了探明甜瓜幼苗下胚轴长度的遗传规律,以下胚轴长度差异明显的2个自交系329-1(P1)和Afgsnake(P2)为亲本构建1个F2和2个BC1群体(B1和B2分别为F1与P1和P2的BC1),通过多世代联合分析法研究幼苗下胚轴长度的遗传方式。结果表明,甜瓜幼苗下胚轴长度表现出明显的数量性状特征,其最佳遗传模型为E-0,即2对加性-显性-上位性主基因+加性-显性-上位性多基因模型。2个主基因的加性效应较弱,其显性效应和互作效应较强,且易受环境因素的影响。春季B1:2、B2:2和F2:3世代主基因遗传率分别为30.56%、67.56%和85.93%,秋季其主基因遗传率分别为77.01%、78.35%和83.95%,多基因遗传率(43.93%)主要存在春季B1:2世代。研究结果明确了甜瓜幼苗下胚轴长度遗传方式,可为幼苗株型遗传改良提供理论依据。
关键词:甜瓜;下胚轴长度;主基因+多基因;遗传分析
中图分类号:S652 文献标志码:A 文章编号:1673-2871(2021)08-026-06
Joint genetic analysis of hypocotyl length of melon seedlings using multiple generations
LI Qiong1, LIANG Xiaoxue1, LI Wenlong1, HOU Juan1, HU Jianbin1, HUANG Song2
(1. Henan Key Laboratory of Fruit and Cucurbit Biology(Zhengzhou)/College of Horticulture, Henan Agricultural University, Zhengzhou 450002, Henan, China; 2. Xinyang Agriculture and Forestry University, Xinyang 464001, Henan, China)
Abstract: Melon seedling raising under high-temperature seasons easily causes rapid hypocotyl prolongation leading to seedling overgrowth, which further affects quality of the seedlings. In order to clarify the genetic low of hypocotyl length of melon seedlings, two melon inbred lines 329-1 (P1) and Afgsnake (P2), which showed contrasting hypocotyl lengths at seeding stage, were used to develop one F2 and two BC1 populations (B1 and B2 act as the BC1 populations with F1×P1 and F1×P2, respectively). A method involving joint genetic analysis with multiple generations was used to pinpoint out the genetic model controlling hypocotyl length of melon seedlings. The results showed that hypocotyl length of melon seedlings revealed the typical characters of quantitative traits but deviated from the normal distribution. Long hypocotyl trait tended to conduct in recessive inheritance. The optimal genetic pattern for this trait was E-0 model, i.e., two pairs of additive-dominance-epitasis major genes + additive-dominant-epistasis polygenes. In this model, additive effects of the two major genes was comparatively small but the dominant effects played a main role; interactive effects were observed among these genes. These genetic effects were also most sensitive to environment. Three generations (B1:2, B2:2and F2:3) had major-gene heritabilities of 30.56%, 67.56% and 85.93% in spring and 77.01%, 78.35%and 83.95% in autumn, respectively. The heritability of polygene (43.93%) was only detected in B1:2 generation in spring. Selection efficiency of the major genes was much high in the early period of the generations (F2 and B2) and their self-bred progenies. B1 could be more suitable for selection for polygenes in special season. This study revealed the genetic pattern of hypocotyl length of melon seeding, offering a theoretical basis for genetic improvement of plant architecture for melon seedlings.
Key words: Melon; Hypocotyl length; Major-gene plus polygene; Genetic analysis
甜瓜(Cucumis melo L.)是一年生蔓生植物,为葫芦科遗传多样性最为丰富的种之一。据联合国粮食及农业组织(FAO)数据统计,2018年世界甜瓜栽培面积为104.7万 hm?,总产量达273.5万t,其生产规模居世界十大果品之列[1]。作为一种世界性园艺作物,甜瓜的起源中心在非洲撒哈拉沙漠[2],而驯化区域则十分广泛,包括整个亚洲(尤其是南亚和东亚)及地中海沿岸的北非和南欧等地[3],其驯化区域大多属于热带和亚热带气候区,光热资源十分丰富。
作为典型的喜温植物,甜瓜生长期间对温度的要求较高,其生长适温为28~32 ℃,而幼苗对温度的要求更为严格,在10 ℃以下24 h内就出现冷害。因此,在甜瓜育苗过程中需保持一定的环境温度,以确保幼苗正常生长[4]。然而,在以塑料大棚和日光温室为主要设施的条件下,甜瓜育苗环境的温度难以精确控制(特别是夏季),设施内的高温容易导致下胚轴快速伸长和幼苗徒长,影响秧苗质量。尽管可采用覆盖遮阳网、增设水帘等方式降温,但无疑增加了劳动投入,提高了生产成本。培育和推广短下胚轴的甜瓜品种,可从根本上控制幼苗下胚轴的快速生长,解决甜瓜育苗过程中秧苗徒长的问题。
目前,关于甜瓜幼苗下胚轴性状遗传研究还未见报道,但在甜瓜的同属植物黄瓜中有几例报道。早期研究发现,黄瓜幼苗下胚轴长度受加性-显性-上位性多基因控制,受环境影响很大[5]。Bo等[6]发现,控制西双版纳黄瓜短下胚轴基因为单隐性基因sh1,并将其定位在第3染色体的63 kb区段内。张子默等[7]近期发现,黄瓜幼苗下胚轴长度的遗传方式受温度影响较大,在高温(43 ℃)下符合2对加性-显性-上位性主基因+加性-显性多基因遗传模型,而常温(25 ℃)下则符合1对加性-显性主基因+加性-显性-上位性多基因遗传模型。此结果说明,黄瓜幼苗下胚轴长度的遗传受温度、光照等环境因素影响,其遗传机制较为复杂。栽培甜瓜与黄瓜的起源和驯化存在很大差异,其幼苗下胚轴的生长可能具有不同的遗传调控机制。前期,河南农业大学西甜瓜课题组构建了一个甜瓜核心种质[8],从中发现了幼苗下胚轴长度差异明显的2份材料,并以此构建了F2、BC1等分离群体。笔者采用主基因+多基因混合遗传模型[9],对多个世代群体甜瓜幼苗下胚轴长度进行遗传分析,旨在明确甜瓜幼苗下胚轴长度的遗传规律,为下胚轴长度的遗传改良提供理论依据,进而为夏季育苗中的秧苗徒长问题提供解决方案。
1 材料與方法
1.1 材料
分别以下胚轴长度差异明显的高代自交系329-1为母本(P1)、Afgsnake(P2)为父本(图1),2017年田间杂交获得F1,2018年通过自交、回交分别获得F2、B1(F1×P1)和B2(F1×P2)群体。为了准确统计分离群体单株的表型,将B1、B2和F2群体的单株分别自交构建其家系群体(B1:2、B2:2和F2:3)。亲本材料329-1和Afgsnake均由河南农业大学西甜瓜课题组提供。
1.2 方法
试验分别于2019年春、秋两季在河南农业大学科教园区试验基地进行。将各群体的甜瓜种子进行常规浸种、催芽,播种于50孔穴盘中(V草炭∶V蛭石∶V珍珠岩= 1∶1∶1),春季(2月25日)于日光温室中育苗,秋季(7月5日)于塑料大棚中遮阳育苗。非分离群体P1、P2和F1分别种植30~50株,分离群体B1:2、B2:2和F2:3分别种植122个、116个和140个家系,每个家系种植7~10个单株。待各群体幼苗长至2叶1心时(春季苗龄约30 d,秋季苗龄约 18 d),采用游标卡尺(PD-151)测量各群体不同单株幼苗的下胚轴长度。
1.3 数据分析
非分离群体P1、P2和F1各单株下胚轴长度的实测值为其表型值;而对于分离群体(B1:2、B2:2和F2:3),各单株表型值以其对应的家系单株下胚轴长度实测值的平均值代替。
利用SPSS 12.0统计各群体幼苗下胚轴长度的基本统计量,即极值、均值、变异系数(CV)、偏度和峰度,明确下胚轴长度的变异特点。采用盖钧镒[9]提出的主基因+多基因混合模型和章元明等[10]提出的多世代联合分析法,对6个世代(P1、P2、F1、B1、B2和F2)的下胚轴表型数据进行联合遗传分析。具体分析方法包括:1)候选模型选择。采用模型中的IECM算法计算24个模型[包含1对主基因(A)、2对主基因(B)、无主基因(C)、1对主基因+多基因(D)、2对主基因+多基因(E)等设定基因效应]的极大似然值(max-likelihood-values,MLV)和赤池信息量(Akaikes information criterion,AIC),采用最小AIC值判别准则筛选候选模型。2)均匀性检验。对各种候选模型分别进行适合性检验,包括均匀性检验、Smirnov检验和Kolmogorov检验,通过比较5个检验指标(U12、U22、U32、nW 2和Dn)来确定最适模型。3)遗传参数估算。依据最小二乘法计算最适模型的各成分分布参数,并估计模型中主基因和多基因的效应值、方差及相关遗传参数,计算遗传率。上述分析采用曹锡文等[11]研制的Windows软件包SEA。
2 结果与分析
2.1 各世代表型数据分析
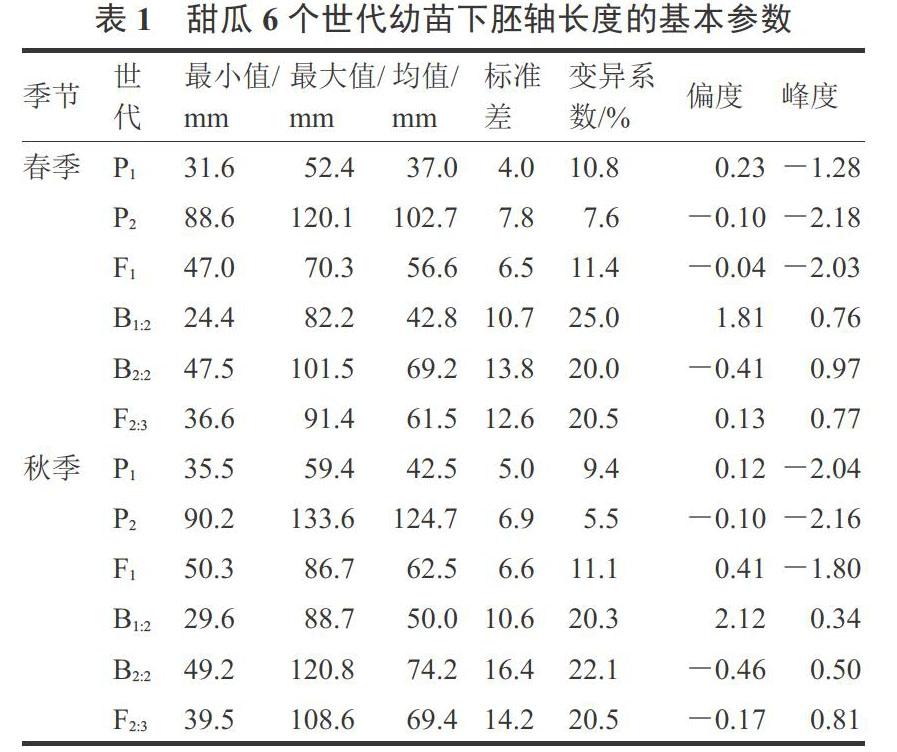
对春、秋两季6个世代群体下胚轴表型数据进行统计,结果见表1。春季3个非分离群体(P1、P2和F1)下胚轴长度均值分别为37.0、102.7和56.6 mm,秋季其均值分别42.5、124.7和62.5 mm,群体内变异较小(CV<12%),秋季平均值普遍高于春季,可能是秋季育苗期间高温所致。F1的均值处于P1和P2之间,但明显偏向低值亲本P1。
3个分离群体(F2:3,B1:2和B2:2)的下胚轴长度变异较大,其CV均超过20%,表现为连续变异。无论是春季还是秋季,F2:3的均值均介于B1:2和B2:2之间,B1:2和F2:3均偏向低值亲本P1,而B2:2偏向性不明显,说明甜瓜幼苗长下胚轴具有隐性遗传的倾向。从群体单株的频率分布来看,3个分离群体表型值均偏离了正态分布,B1:2为正偏分布(偏度>0),B2:2趋向负偏分布(偏度<0),F2:3则趋中分布(偏度接近于0),且各分离群体的峰度均高于正态分布值(峰度>0),说明存在主效基因的影响(图2)。上述结果表明,在329-1 × Afgsnake遗传背景下,幼苗下胚轴长度呈现出主基因+多基因的遗传特征。
2.2 最适遗传模型的选择和检测
基于以上6个世代群体的下胚轴表型值,计算24种模型的MLV和AIC值,结果见表2。根据AIC值最小值判别规则,春季D-0、E-0和E-1模型的AIC值最低,而秋季具有最低AIC值的模型为C-0、E-0和E-1。结合2个季节的分析结果,表明E-0和E-1模型为春秋两季所共有。这两种模型所对应的遗传方式分别为2对主基因(加性-显性-上位性)+多基因(加性-显性-上位性)、2对主基因(加性-显性-上位性)+多基因(加性-显性)。因此,无论春季还是秋季,甜瓜幼苗下胚轴长度均受主基因和多基因调控,且具有多种遗传效应。
采用U12、U22、U32、nW2、Dn等5个检验指标对候选模型(E-0和E-1)进行适合性检验,结果见表3。春秋两季E-0模型均未出现显著性的统计量,而E-1模型在春季和秋季分别出现2个和1个显著性统计量。由于E-0模型在不同环境下未出现显著性统计量,且其AIC值较E-1小,根据检验参数的显著性统计量最少原则,选择E-0为最适遗传模型。此结果说明,甜瓜幼苗下胚轴长度受主基因和多基因联合调控,其遗传效应包括加性、显性和上位性,遗传方式较为复杂。
2.3 最适模型遗传参数的估测
对最适模型E-0的一阶参数和二阶参数分别进行估算,结果见表4。对于性状遗传改良,主基因的作用方式和效应十分关键。在春秋两季试验中,控制甜瓜幼苗下胚轴长度的2个主基因(a、b)的加性效应相等,分别为0.73(春季)和7.96(秋季),能够增加下胚轴长度,容易导致幼苗徒长,其中秋季的遗传效应最为明显;春季2对主基因的显性效应分别为-15.52和-13.19,秋季分别为-5.09和-0.15,均能抑制幼苗下胚轴伸长,有利于防治幼苗徒长,其中春季遗传效应更明显。春季主基因的显性效应较大,且为负向作用,而秋季主基因加性效应较大,为正向作用。因此,主基因的加性和显性效应在不同季节的作用方式差异较大。
此外,2对主基因还存在多种互作效应,其中春季加性×加性互作效应(i)为-11.13,而秋季i为11.06,效应较大但方向相反,说明i容易受到季节影响;春秋两季显性×显性互作效应(l)较大,效应值分别为31.71和11.02,且方向相同,说明其在不同季节表现较稳定,明显地促进下胚轴伸长,致使幼苗生长难以控制。加性和显性之间的互作效应jab和jba在春秋两季均为负值,可防止幼苗徒长,但效应值较低(<10),且在不同季节间差异较大。因此,对于互作效应,无论基因之间还是季节之间,其效应值或方向存在较大的差异,也反映了甜瓜下胚轴长度遗传基础的复杂性。
通过估算最适模型E-0的二阶参数,发现春季B1:2、B2:2和F2:3群体的主基因的遗传率(hmg2)分别为30.56%、67.56%和85.93%,秋季其hmg2分别为77.01%、78.35%和83.95%,特别是在B2:2和F2:3中遗传率较高。春季B1:2的多基因遗传率(hpg2)最高(43.93%),而B2:2和F2:3的hpg2分别为12.52%和0;秋季B1:2和B2:2的hpg2均为0,F2:3的hpg2也仅为6.78%。由此可见,甜瓜幼苗下胚轴长度主要受主基因的控制,hmg2占有绝对主要比重,早期世代选择能够收到较好效果,但多基因在B1:2群体也具有一定的遗传率。因此,针对甜瓜幼苗下胚轴长度的遗传改良,在F2、B2及其自交后代中主基因具有较高的选择效率,B1及其自交后代可在春季用于多基因选择。
3 讨论与结论
下胚轴虽然是一种结构相对简单的株型器官,但其影响因素众多,除了受遗传因素调控外,还受光照、温度、植物激素、重力等因素影响[12]。在拟南芥等植物中,下胚轴生长主要依赖于细胞的纵向伸长[13-14],因此下胚轴也是研究细胞伸长的模式器官。在瓜类蔬菜中,下胚轴遗传调控研究报道相对较少,主要集中在黄瓜上且研究结果差异较大[5-7],说明下胚轴的遗传基础较为复杂。Bo等[6]从西双版纳野生黄瓜中克隆到一个受紫外光调控的短下胚轴基因sh1,发现该基因在黄瓜进化历史中经受了人工驯化选择,为黄瓜下胚轴遗传改良提供了依据。但在甜瓜中还未见相关报道。
笔者在本研究中采用下胚轴长短差异明显的两份甜瓜材料构建了6世代群体,对2个环境下下胚轴长度进行遗传特性分析。结果表明,下胚轴长度在非分离群体(P1、P2和F1)的变异较小(CV介于5%~12%之间),而在分离群体(B1:2、B2:2和F2:3)趋向正态分布且变幅较大(CV>20%),各种基本统计参数在春秋两季差异明显,说明甜瓜下胚轴长度是典型的数量性状,对环境敏感。为了进一步探讨其遗传规律和基因作用方式,笔者采用经典的数量性状遗传分析方法——主基因+多基因混合遺传分析法[9-10],对2个季节甜瓜下胚轴长度进行遗传分析,发现其符合2对加性-显性-上位性主基因+加性-显性-上位性多基因模型(E-0),说明甜瓜下胚轴长度既受主基因的控制也受多基因的修饰,主基因的效应包括加性、显性、上位性多种效应,其作用方式在不同季节间差异较大,进一步证实了甜瓜下胚轴遗传基础的复杂性。值得注意的是,2对主基因在春秋两季的加性效应均为正值但绝对值较小,说明通过加性效应(育种值)来改良甜瓜下胚轴长度的难度较大。虽然主基因的显性效应及其互作效应具有较大的绝对值,但其作用方向不同,且显性效应和互作效应均是非固定的遗传效应[15],遗传操控的难度很大,说明通过田间有性杂交途径来改良甜瓜下胚轴长度存在较大的不确定性。但由于2对主基因在特定的世代群体(B2:2和F2:3)中的遗传率较高(>60%),且多基因遗传率很低(<13%),因此,甜瓜下胚轴性状的遗传改良可考虑在F2、B2及其自交后代中开展,选择特定基因型的理想单株。在早期世代对主基因进行选择的同时,要特别注意摒弃显性互作效应(尤其是春季),选择适宜基因型后代以充分利用负向高值的加性效应和显性互作效应,从而选育出理想的短下胚轴的育种材料。同时,也要注意保持一定的群体规模,增加各种基因型出现的机会,以减少选择的不确定性。
本研究中甜瓜自交系329-1具有短下胚轴特征,但其主基因的遗传效应以显性效应和互作效应为主,因而仅仅通过传统的有性杂交来改良下胚轴长度不免存在费时、费力的问题。因此,在明确其遗传方式的基础上,充分利用现代生物学研究手段和方法,采用正向遗传学方法(如连锁作图)和现代高通量基因分型技术[16-17],发掘该材料中具有较强遗传效应的QTL,通过分子育种的途径可有针对性地实现甜瓜下胚轴性状的遗传改良。
参考文献
[1] FAOSTAT.http://faostat. Fao. org,2018.
[2] KERJE T,GRUM M.The origin of melon,Cucumis melo:a review of the literature[J].ISHS Acta Horticulturae,2000,510:37-44.
[3] 林德佩.中国栽培甜瓜植物的起源、分类及进化[J].中国瓜菜,2010,23(4):34-36.
[4] 许传强,齐红岩.甜瓜高产优质栽培[M].沈阳:辽宁科学技术出版社,2010.
[5] 李丹丹,司龙亭,罗晓梅,等.弱光胁迫下黄瓜苗期下胚轴性状的遗传分析[J].西北农林科技大学学报(自然科学版),2009,37(11):113-119.
[6] BO K L,WANG H,PAN Y P,et al.SHORT HYPOCOTYL 1 encodes a SMARCA3-like chromatin remodeling factor regulating elongation[J].Plant Physiology,2016,172(2):1273-1292.
[7] 张子默,卢俊成,齐晓花,等.高温下黄瓜幼苗下胚轴长度遗传效应的研究[J].分子植物育种,2019,17(4):1326-1332.
[8] 胡建斌,马双武,王吉明,等.基于表型性状的甜瓜核心种质构建[J].果树学报,2013,30(3):404-411.
[9] 盖钧镒.植物数量性状遗传体系的分离分析方法研究[J].遗传,2005,27(1):130-136.
[10] 章元明,盖钧镒,张孟臣.利用P1、P2、F1和F2或F2∶3世代联合的数量性状分离分析[J].西南农业大学学报,2000,22(1):6-9.
[11] 曹锡文,刘兵,章元明.植物数量性状分离分析Windows软件包SEA的研制[J].南京农业大学学报,2013,36(6):1-6.
[12] SCHERES B,WOLKENFELT H,WILLEMSEN V,et al.Embryonic origin of the Arabidopsis root and root meristem initials[J].Development,1994,120:2475-2487.
[13] GENDREAU E,TRAAS J,DESNOS T,et al.Cellular basis of hypocotyl growth in Arabidopsis thaliana[J].Plant Physiology,1997,114(1):295-305.
[14] BORON A K,VISSENBERG K.The Arabidopsis thaliana hypocotyl,a model to identify and study control mechanisms of cellular expansion[J].Plant Cell Reports,2014,33(5):697-706.
[15] 朱軍.遗传学[M].3版.北京:中国农业出版社,2006.
[16] 胡仲远,杨景华,张明方,等.基于重测序的超密遗传图谱揭示甜瓜蔓枯病抗性相关基因[J].中国瓜菜,2019,32(8):251-252.
[17] 郭晓雨,宋晓飞,李晓丽,等.黄瓜果瘤位置性状遗传与QTL分析[J].中国瓜菜,2020,33(9):12-17.

