高压下深海碳循环的过程及其对生命活动的影响
刘亮霆, 肖湘
(上海交通大学生命科学技术学院,上海 200240)
0 引言
目前,人类经济与人口已达到前所未有的规模,应用化石燃料推动工业化带来发展的同时也伴随着温室气体的排放。当今主要温室气体二氧化碳(CO2)和甲烷(CH4)在大气中的浓度相对于1750年分别增加了40%和150%,已达到过去80万a以来的最高值[1]。
人类活动每年会向大气释放约400亿t的CO2(以C元素计约为110亿t)[2],但陆地与海洋的碳汇作用会减缓大气CO2浓度的上升速度。化石燃料所生成的CO2中有25%被海洋吸收,是主要的碳汇。深海是海洋的主体,深度超过1 000 m深海占据全球海洋体积的75%。短期看来,深海的固碳作用难以进行人为调控,但是深海巨大的体量使人类必须了解其中的碳循环对全球CO2浓度的调节作用,并且在长时间尺度下估算人类活动对深海的影响。本文对高压下深海碳循环的过程以及对生命活动影响进行研究,评估了应用深海作为地球工程技术平台封存CO2的可能性。
1 研究背景
CO2是最重要的温室气体,其浓度已从1958年5月的316×10-6急剧升高到了2021年5月的419×10-6。虽然在地质历史时期出现过更高的CO2浓度,但目前CO2浓度上升速度是前所未有的(图1(a))。CH4是第二大温室气体,截至2021年2月,大气CH4浓度已达1 889×10-9,虽然在大气中的浓度远低于CO2,但其100 a范围内单位质量的升温潜势为CO2的28~34倍[3]。
大气中CH4浓度的上升在2000—2006年间曾出现过短暂的停滞(图1(b)),人们曾一度认为CH4已达中和,《巴黎协定》也没有包含CH4排放的目标。然而,目前大气CH4浓度的高速增长已经持续了10 a以上,如果未来几十年里保持该速度,CH4对气候变暖的影响可以大大抵消甚至逆转来自减少CO2排放的效果。此外,全球变暖可能促进海底甲烷水合物的分解,导致CH4释放到海洋中,其全球影响仍待进一步调查。
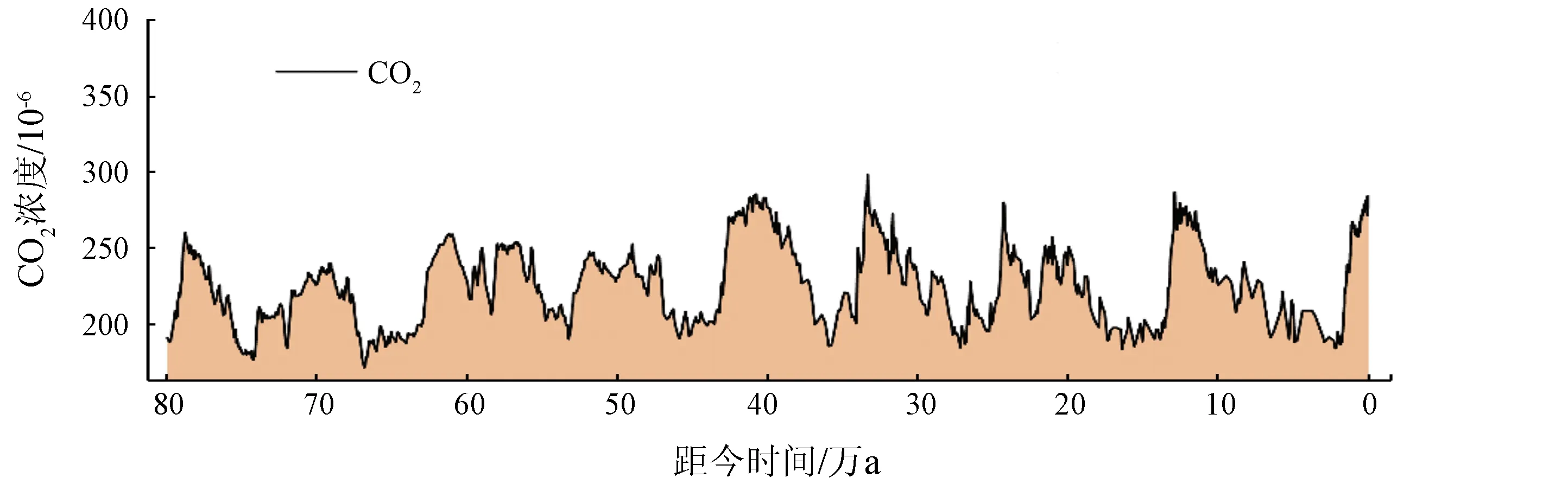
(a) 80万a尺度下大气中CO2浓度[4-6]
温室气体的排放增强了大气对地面长波辐射的吸收,进而导致了全球变暖等气候变化的产生。目前地球已变暖了约1 ℃,由此带来的极端天气与生态破坏,降低了地球的宜居性。因此196个缔约方在2015年通过了《巴黎协定》,旨在将全球升温控制在前工业化时期的2 ℃以内,并争取把温度升幅限定在1.5 ℃。为了实现这一温度目标,各国须尽快达到温室气体排放的峰值,以便在21世纪中期实现零排放。2020年9月,我国提出力争于2030年前碳排放达到峰值,努力争取2060年前实现碳中和的“双碳”目标。碳中和作为一个长期的气候目标,除了减少人为排放,我们还需要在生态建设与保护,碳捕集、利用与封存技术、调查分析各生态系统固碳潜力等方面做出努力。
2 深海碳库的机制与规模
C元素是生命的物质基础。然而,C并非地壳中最丰富的元素,地壳中碳的质量含量只有0.032%。地球中主要有以下几个碳库(表1)[8]: ①生物圈中的生物和死亡生物中的有机物; ②大气中的CO2; ③岩石圈中的沉积碳酸盐、干酪根和化石燃料; ④海洋中的可溶性无机碳、有机碳、沉积有机碳和甲烷水合物等。

表1 地球中的主要碳库[8-9]
工业革命以来,大气CO2浓度升高主要是人类将封存的化石燃料这一碳库引入碳循环造成的,而岩石圈中的其他碳库一般不参与碳循环。这些碳储库形成或消耗的反应时间尺度是千万年,甚至上亿年。海洋是地球上的第二大碳库,海水中所含的可溶性无机碳(Dissolved Inorganic Carbon, DIC)是大气CO2的50倍,主要储存在低温高压的深海(图2)。海水中的另一大碳源是可溶性有机碳(Dissolved Organic Carbon, DOC),其中大部分属于难降解有机碳(Refractory Dissolved Organic Carbon, RDOC),其储量以C元素质量计约为670×109t,相当于大气中CO2的总量。海洋沉积物同样也是巨大的碳库,在1 m的垂直深度内,全球海洋沉积物的有机碳储量达2 322×109t,几乎是陆地土壤的2倍[9]。虽然深海沉积物单位面积的碳储量较低,但由于其广泛的地理覆盖面积,深度大于1 000 m沉积物占海洋沉积物碳储量总量的比例高达84%[9-10]。如果不受到干扰,埋藏在深海沉积物中的有机碳周转时间可达百万年之久[11]。然而,人类对海洋的开发导致海洋沉积物重新悬浮,使其暴露在氧气中,一部分通过异养代谢使有机碳重新变成CO2[12],这些半永久性碳的再矿化过程可能加剧未来的气候变化。
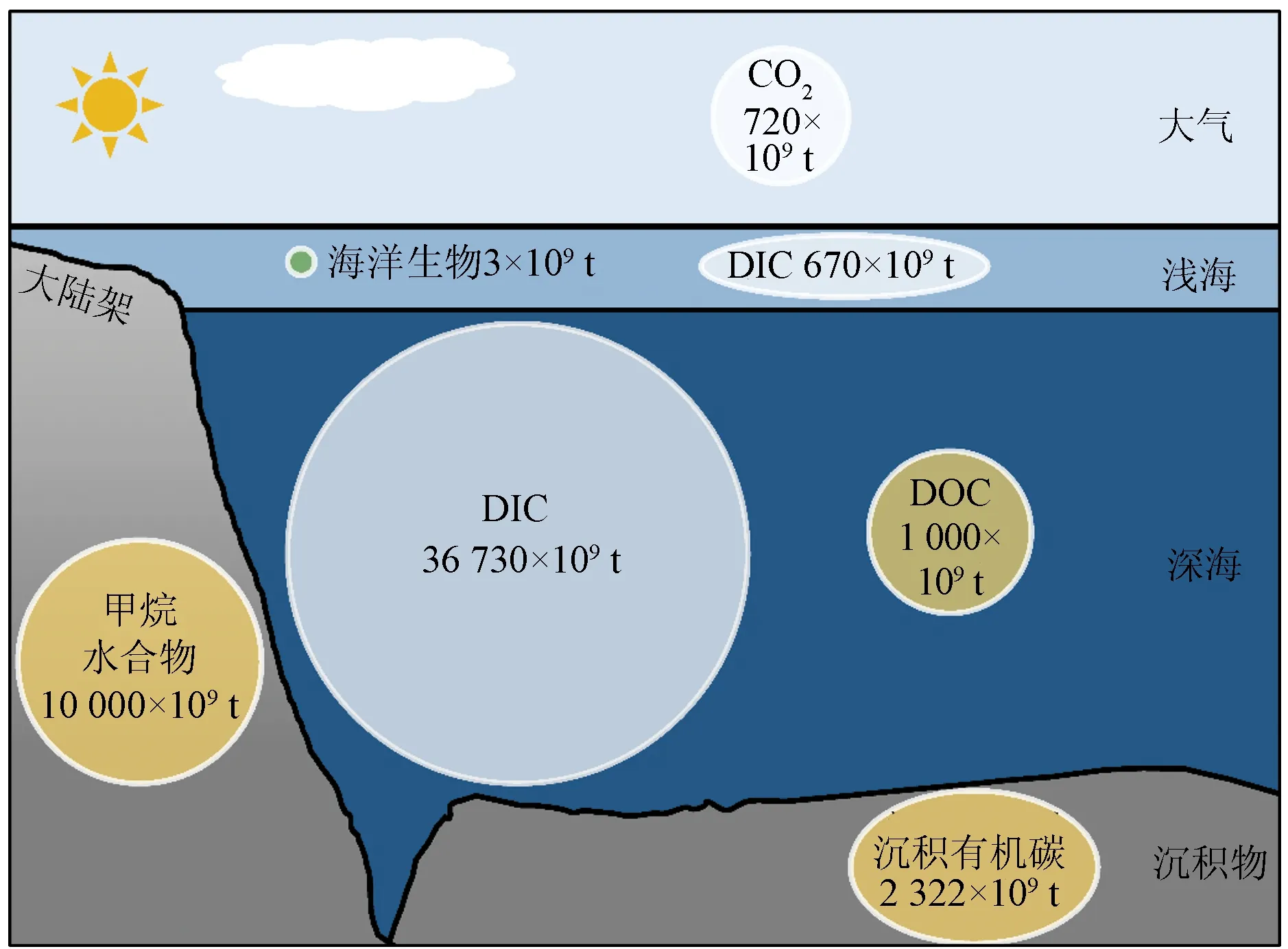
注: 图中含量均以C元素计。
CH4是一种还原形式的碳,在大气中的留存时间较短,90%的大气CH4会在10 a内被羟基自由基氧化去除[13],其在大气中的浓度需要通过持续的CH4释放来维持。大约99%的甲烷水合物形成于海洋沉积物中,在海底呈固态形式保存,由包裹着CH4分子的刚性水分子笼组成。甲烷水合物可以是生源性的(由微生物活动在沉积物深处形成),也可以是热源性的(非生物源的CH4从较深的沉积物中释放出来,由于压力-温度条件或某些盖层地质结构的特性而被捕获)[14]。甲烷水合物的存在取决于温度、压力、盐度、气体组成等因素[15],分布广泛,主要存在于大陆架斜坡沉积物、超过300 m深的海隆和沉积物以及大陆和大陆架的极地沉积物中[16]。海洋中埋藏着巨量的甲烷水合物,通常认为其储量约为10 000×109t,相当于全球化石燃料储量的2倍[17]。海洋中溶解的CH4浓度与溶解氧浓度呈负相关,在最小含氧带(Oxygen Minimum Zones, OMZ)浓度最高,可达20~100 nmol/L,在深海海水中的浓度较低[18]。
3 深海碳输送的过程
海洋覆盖了地球表面的71%,大气与海洋这2种地球物理流体之间存在巨大的CO2通量,以C元素质量计平均每年约90×109t[2]。在百万年的时间尺度上,海洋和大气之间的CO2净通量是由无机和生物过程变化驱动的。工业革命以来,存在着从大气到海洋的CO2净通量,目前每年约为2.5×109t[2]。
海洋的表层水被太阳加热,被风混合,平均温度约18 ℃,深度75~200 m,由密度跃层将表层水体与深海隔离开。深海平均温度为3 ℃,尽管生物体、有机物、溶质和气体能通过运动、沉降或扩散过程进入深海,但表层和深海之间的水体直接交换受到密度跃层的限制,主要通过多个概念上的碳泵进行碳输送。
3.1 无机碳输送

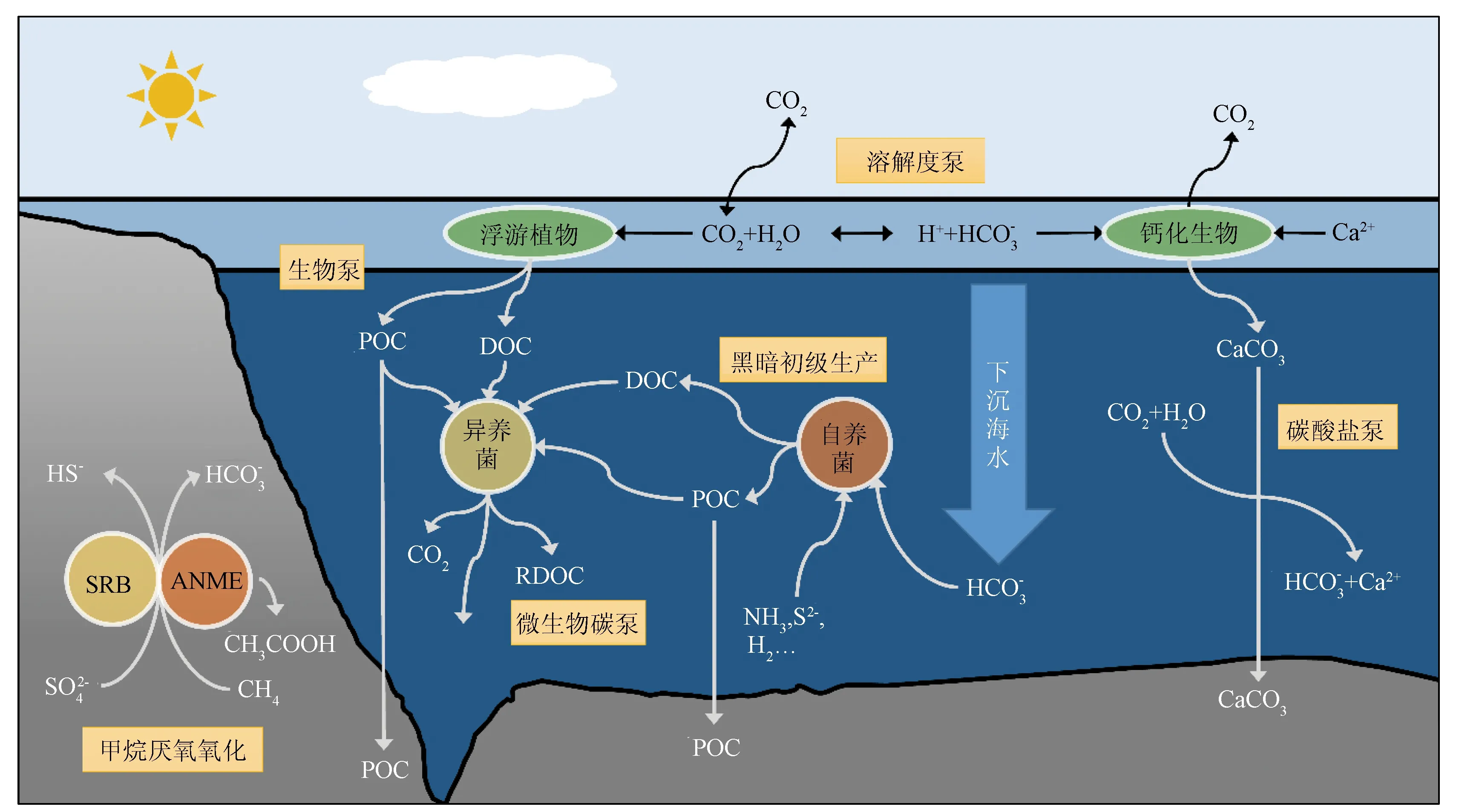
注: SRB.硫酸盐还原细菌; ANME.甲烷厌氧氧化古菌; POC.颗粒有机碳。
3.2 有机碳输送
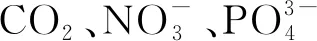
海洋表面的部分RDOC被紫外线破坏,但在黑暗深海中可封存4 000~6 000 a[32],超过热盐环流的时间尺度,在作为碳储库以及缓解气候变化方面可能具有重要潜力。微生物碳泵(Microbial Carbon Pump,MCP)被认为是海洋RDOC形成的机制,微生物利用生物泵产生的易降解有机碳(Labile Dissolved Organic Carbon, LDOC),并在该过程中产生RDOC[33-34]。RDOC主要有2类,一类是自身化学特性而导致的难以被降解的RDOCt,另一类是由于其浓度过低而难以被利用的RDOCc[35]。在北太平洋北部收集的表层和深海RDOC之间存在明显的成分差异: 表层RDOC差异较大,富含高度不饱和化合物和不饱和脂肪族化合物,这可能是浮游植物输入和光降解产物导致的; 深海中的RDOC已被微生物酶过程修饰,具有较高数量的等效双键和降解程度,氢/碳比值较低,不饱和度较高和分子内成环,其组成大致均匀,富含高度不饱和化合物,包括具有脂肪链以及氧化衍生的多环芳烃[36-37]。RDOC的产生不受物理过程(混合、下沉或温盐环流)的直接影响,而与深度有关,活跃在整个水体中[38]。非生物因素,如垂直混合和光降解也可能影响RDOC的组成及其时空分布,从而影响MCP的强度和效率[39]。每年通过MCP产生的RDOC为0.1×109~0.2×109t,相当于目前海洋每年CO2净吸收的4%~8%[38]。目前,我们对产生和利用RDOC的机制的定量认识仍处于初级阶段,还需进一步研究以量化MCP海洋碳储的能力,了解其对全球变化的响应以及作为碳捕集和封存基础的潜力。
3.3 CH4输送
甲烷水合物的储层并非静止的,而会在沉积作用、压力扰动以及温度变化的影响下发生解离。即使甲烷水合物在解离过程中释放出CH4,沉积物和海洋水域中的物理、化学和生物汇也会减少到达大气中的CH4数量,以至于现今地球上很少有地方的甲烷水合物解离会释放出大量的CH4进入大气[40]。沉积物中CH4的厌氧氧化(Anaerobic Oxidation of Methane, AOM)是很强的CH4生化汇,在微生物的驱动下,硫酸盐、硝酸盐、金属离子等作为电子受体,从沉积物向上迁移到达硫酸盐还原区(Sulfate Reduction Zone, SRZ)的过程中氧化了80%到90%的CH4[41]。AOM也与海底浅层的碳酸盐沉淀密切相关,因为AOM会产生碳酸氢盐,在流动的碳循环中去除活性碳[42]。
当CH4在海底释放进入海水,但由于海水中的CH4浓度很低,导致CH4在上升过程中迅速溶解扩散,气泡被氧气和氮气占据,使CH4溶解在较深的水体中[43]。即使溶解在海水中,好氧的微生物氧化是一个强大的CH4汇,可以限制溶解的CH4向大气的流通,当海水受到CH4浓度升高的扰动时,氧化率会增加[44]。但是大量CH4排放后的剧烈氧化作用可能导致水体缺氧,同时也会增加溶解的CO2,从而加剧海洋酸化。
海洋沉积物的物理特征也构成了一种CH4的汇。这些物理汇不会像AOM那样转化CH4,但它们可以防止CH4与海洋-大气系统发生相互作用。最重要的物理因素是那些阻碍CH4通过沉积段迁移的因素。物理汇的例子包括阻碍流动的低渗透性沉积物、结构性圈闭、水合物和/或气体饱和沉积物等[40]。
4 深海中的微生物
深海是有机物再矿化以及长期碳储存的关键场所,它包含了水生系统中最大的微生物库。在水深超过200 m的海域中的细菌和古菌占全球海水中原核生物量的75%,主导深海元素循环,控制营养物质的利用、初级生产以及海洋中温室气体的生产和消耗[45],在地球元素循环中发挥着关键的驱动作用。深海原核生物的胞外酶活性与表层水的微生物相当,甚至更高,可能表明其生命模式依赖于表面附着颗粒或胶体[46]。来自表层海洋的有机碳供应与深海微生物有机碳需求不匹配[47]。这部分缺口由深海中的化能自养微生物所填补,其利用化学能将DIC转化为新有机碳,约占海表浮游植物输入量的15%~53%[48]。
由于沉积POC输入量通常随深度的增加而迅速衰减,因此深海获得的POC的输入量很低,而由此产生的RDOC也难以被微生物利用,导致人们曾长期认为暗海中的微生物生长极为缓慢或处于休眠状态。然而有研究表明,深海中的微生物总体上新陈代谢是活跃的[49-50]。
基于16SrRNA基因序列可以很容易描述微生物群落的特征,一项基于16SrRNA基因序列的研究调查全球深海中浮游和颗粒附着的原核微生物多样性。在来源于太平洋、大西洋和印度洋的30个深海样品中,共检测到了3 695个分类单元(Ope-rational Taxonomic Units, OTUs)[51],而在全球表层海水中检测到了多达65 545个OTUs[52],这表明深海中的原核生物的多样性只占全球海洋中的少部分。另外,深海样品间的平均共享OTU比例高达42%,主要属于α-变形菌、γ-变形菌、δ-变形菌、放线菌和奇古菌[51],可认为深海原核生物群落由1组高度共享但比例不同的优势物种与1组低丰度但特异的稀有物种组成。
海底沉积物包括好氧和厌氧微生物生态系统,它们在地质历史时期依靠非常低的生物可用能量而长期存在。缺氧海底沉积物中的古菌群落的组成与氧化沉积物中的古菌群落明显不同,深古菌(Bathyarchaeota)、广古菌(Euryarchaeota)、阿斯加德古菌(Asgardarchaeota)等古菌在厌氧沉积物中含量很高,而好氧古菌群落则由奇古菌(Thaumarchaeota)主导[53]。与古菌群落相似,细菌群落在缺氧与氧化沉积物中同样差别很大。变形菌(Proteobacteria),包括α-变形菌、γ-变形菌,与厚壁菌(Firmicutes)的成员一起,在氧化底层沉积物中占优势; 与此相反,在缺氧沉积物中,暗黑菌(Atribacteria)、绿弯菌(Chloroflexi)和浮霉菌(Planctomycetes)的成员大量存在[53]。
5 深海中微生物驱动的碳循环过程
5.1 异养微生物矿化有机碳
细菌对有机物的利用极大地影响了有机碳从表面到海洋内部的垂直通量,从而影响了全球碳循环和气候,因此揭示有机物和微生物相互作用和调控的机制是更好地理解海洋生物地球化学循环的关键,虽然深海中的矿化速度大大低于表层水[54],但长期来看导致了深海中CO2的富集。
(1)POC。进入深海的有机碳根据能否被滤膜截留定义为POC(被0.7 μm滤膜截留)与可溶性有机碳(DOC,能通过0.7 μm滤膜)[55]。POC的下沉是生物泵的一个主要组成部分,微生物过程调节下沉的POC的化学和物理结构,影响碳输送的深度。POC富集会滋生密集的微生物群,细胞密度可高于周围环境水体3个数量级。聚集菌群的发展,往往与胞外的多聚物有关,可能会促进生物膜的形成,内部的菌群间呈现合作、互利共生、拮抗等关系[56-57]。附着细菌表现出一系列细胞外酶的高活性,主要负责水解POC[58],在该过程中释放相当于总降解量50%~98%的DOC,只有很小量被附着细菌吸收矿化[59],其他释放出来的DOC支持了深海中浮游的微生物的生长[55]。因此,虽然附着在POC上的微生物只占浮游环境中微生物总丰度的小部分,但POC是微生物活动的“热点”,浮游菌的生长在很大程度上依赖于向下输送的POC流。
(2)DOC。DOC是海洋中最主要的有机碳形式,DOC的成分非常复杂,由于降解难易程度差别很大,其周转时间短至数分钟,长至数千年。微生物只能通过跨膜运输DOC来获得营养,由于只有小分子底物可以运输过膜,高分子量的DOC是具有复杂结构的主要细胞成分,包括蛋白质、多糖和脂类,必须由胞外酶水解后才能被利用。蛋白质占浮游藻类生物质的大部分,因而各种蛋白质分解酶在海洋系统中非常丰富。海洋环境中的蛋白质常常被吸附于各种颗粒,使其不易被细菌降解,其中的机制可能是蛋白质构象变化以及物理遮挡导致蛋白酶难以接触酶切位点[60]。糖与蛋白质氨基的共价结合的糖基化反应也同样提高了蛋白质的降解难度。不同来源的菌群对被颗粒吸附或糖基化的蛋白质的降解能力各异,表层菌群倾向于利用游离的新鲜蛋白质,而深水菌群则更适合利用糖基化修饰过的蛋白质[61]。
海洋中的小分子易降解有机物(如游离氨基酸和中性糖,占总DOC的1%)通常只有很低的浓度,微生物需通过特定的转运蛋白消耗能量主动运输这些分子。由于主动运输效率很高,游离氨基酸和中性糖等分子的周转时间通常在数分钟至数小时范围内[55]。在海洋环境中,小分子易降解有机物在微生物生产中占的比例可达10%~100%[55],但深海微生物可能难以获得这类小分子有机物的供应[62]。
海洋中大部分DOC属于RDOC,细菌在海洋RDOC的形成中起重要作用。海洋DOC中存在D-氨基酸,这是细菌细胞壁中肽聚糖的一种成分,难以作为单一碳源或氮源被利用,表明细菌可以将易降解的游离糖和氨基酸转化为不易降解的细胞成分[63-64]。在海洋沉积物中发现的细菌有机物的残余量,远远超过了细菌生物量,这表明在水柱和沉积物中发生了来自细菌的有机物的选择性保存[65]。深海中最丰富的DOC(含量>50%)是微生物代谢来源的富含羧基的脂环族分子(Carboxyl-Rich Alicyclic Molecules, CRAM)[66-67],具有萜类化合物中的结构特征,含有丰富的羧基和脂环,作为膜成分或次生代谢物出现在各种微生物中[68]。虽然DOC代表了深海中的一个巨大的碳库,但由于难以被分解利用,该部分仅能满足异养微生物群落的碳需求的10%[69]。
附着在颗粒上生长的微生物被认为是典型的富营养菌,可以适应不同的底物浓度,在营养丰富的条件下快速生长,由于保持了更多样化的酶机制,因此附着生长的富营养菌拥有更大的基因组[70]。深海的原核生物的基因组通常比其浅海亲缘菌更大,它们可能以多样的、更倾向于附着颗粒的方式生存[71],这与深海有机碳以RDOC为主相吻合。
5.2 自养微生物初级生产作用
海洋中的大部分新陈代谢活动是由微生物介导的,特别是在海洋的内部。因此,微生物的碳需求,即异养微生物的生物量生产和呼吸作用的总和,应该与下沉颗粒的通量大致吻合。沉降的有机物并不足以满足黑暗海洋中微生物的能量需求,在大西洋和太平洋地区都有这种微生物有机碳供应和需求不匹配的报道[72],除了可能低估了沉降有机物的输入量之外,还有另外一种可能,即深海存在大量能自的养微生物,它们合成了大量有机碳[73]。大量证据表明,还原无机物,如氢气、硫化物、氨等,可以在含氧的深海中作为浮游微生物的能量来源[74-76],并且自养细菌和古菌在黑暗海洋中的初级生产与异养生物的生产在一个数量级水平[48]。
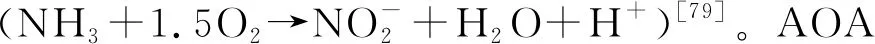
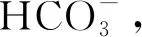
AOA利用氨氧化产生的能量固定海水中的无机碳,合成多糖、脂质、含氮有机物等代谢产物,这些初级代谢产物可作为深海生态系统的重要支撑供异养生物利用,其中难以降解的成分溶解于海水或沉降至海底,不再进入大气。AOA的膜脂是由核心膜脂和极性头基组成的甘油二烷基甘油四醚酯(Glycerol Dibiphytanyl Glycerol Tetraether lipids,GDGTs)。AOA都含有其特有的高丰度的crenarchaeol-GDGTs,GDGTs可以在沉积物中保存数百万年[92],可以成为RDOC池中脂类的重要组成部分,因而在深海中丰富的AOA可能回收细菌矿化有机物过程中产生的大量CO2,在海洋固碳与储碳过程中作为MCP的重要补充发挥关键作用。
5.3 微生物甲烷氧化
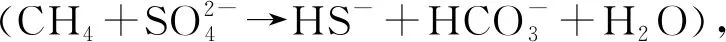
AOM过程除了与硫酸盐还原过程耦合,还可以与多种还原反应耦合,利用的电子受体主要分为硫酸盐、硝酸/亚硝酸盐和金属离子3类[93],体现了这种生化过程的多样性。ANME 与产甲烷古菌在系统发育上相近,根据16SrRNA和mcrA基因的进化和生理功能的差异,ANME主要分为3类: ANME-1、ANME-2和ANME-3[94], ANME-1和ANME-2分布范围较广,分布在海洋沉积物、冷泉、湖泊沉积物、土壤、油田沉积物等环境,而ANME-3主要分布在海底泥火山和冷泉环境中[95]。
ANME通过CH4生成的逆反应过程进行甲烷厌氧氧化,甲基辅酶 M 还原酶(Methyl-coenzyme M reductase, Mcr) 的同系物被认为是催化甲烷厌氧氧化的第一步反应[96],而其与SRB进行电子传递的机制仍有待进一步阐明,目前的假设包括氢作为电子传递体、硫作为电子传递体以及通过纳米导线的直接电子传递[97]。
6 高压对微生物生命活动及深海碳代谢的影响
静水压力是海洋的显著特征之一,每下降10 m,静水压力增加约1个大气压(约0.1 MPa),因而深海的静水压范围在10~110 MPa之间。压力会促使由液至固的相变并改变吉布斯自由能,有利于伴随体积减小的化学反应过程。参与蛋白质一级结构的大多数共价键都是压力至少在100~150 MPa下是稳定的[98],因而压力对蛋白质最大的影响在于影响分子间作用力,如稳定氢键、减小静电相互作用,破坏疏水相互作用等,从而影响蛋白质的水合、折叠、展开以及聚集,甚至导致其变性[99]。在高静水压(High Hydrostatic Pressure, HHP)之下,所有液体的体积都会减小,相对于水,碳氢化合物的体积变化要大得多,在HHP作用下磷脂双分子层被压缩并导致酰基链紧密堆积,甚至相变成胶状的液晶形式[100],流动性下降。
在大肠杆菌、酿酒酵母以及一些深海嗜压菌中进行的研究显示,HHP深远影响了细胞生理学和细胞学行为,包括转录、翻译、膜脂组成, 多亚基蛋白组合,蛋白质结构和细胞活性等[101]。根据在不同HHP下生长能力的不同,微生物可以分为压力敏感(在大气压和高压下具有相似的生长速率)、耐压(在高压中的增长和大气压中生长速率差不多)、嗜压(在高压中的增长比大气压中生长速率更快)和专性嗜压(仅在高压下生长)4种类型。微生物对HHP的适应机制是多样的,包括膜调节、转录调节和渗透产物的产生,就像细胞应对其他压力时的情况一样,如营养限制和极端pH/温度/盐度条件。
静水压会导致胞内活性氧簇(ROS)浓度升高从而威胁到微生物的生存[102]。微生物产生的ROS主要由细胞质膜上的呼吸链产生,一般占O2总消耗量的0.1%~0.2%[103],而高压破坏质膜和膜蛋白介导的电子传递链的动态平衡导致更严重的ROS压力[104]。抗氧化防御机制是细胞应对HHP的关键机制,这点在模式嗜压菌ShewanellapiezotoleransWP3上得到了证明[102]。地球上大量的生物与环境交换气体,许多核心代谢过程与气体有关,HHP使得液体能够溶解更高浓度的气体,因而对微生物驱动的地球化学循环有直接影响。例如,深海溶解的CH4有利于甲烷厌氧氧化的进行[105],高压下大量溶解的CO2也是化能自养微生物的无机碳来源,因而HHP与海洋的碳汇作用密切相关。
尽管我们对细胞适应HHP机制已经有了初步的认识,但关于它对细胞本身的地球化学功能、微生物生态学和进化的影响仍然知之甚少。许多关键的问题仍需我们进一步阐明,如高压引起的氧化应激对细胞的影响、微生物之间的相互作用是否可能提高对HHP的抗性以及是否存在未被发现的适应高压的机制等等。
高压能够增加CH4的溶解度,提高AOM的活性[106]。在深海中,ANME在氧化CH4的过程中能够产生乙酸,并作为碳源支持异养生物群落[105]。在深海CH4自然渗漏环境中,溶解的甲烷浓度远高于硫酸盐浓度,其中电子供体和受体一直是不平衡的。因此,从CH4中产生乙酸盐可能是一个普遍现象。而这部分来源于CH4的乙酸盐并没有列入之前计算的全球AOM通量范围[41],因而有必要重新评估海洋的CH4预算,这对预测全球气候变化具有重要意义。我们的研究还发现,高压下细胞倾向于利用硝酸盐还原为氨以获得能量(待发表),这些额外的氨可以作为氨氧化AOA固定CO2的潜在能量来源。由此可知,高压不仅深刻影响了深海CH4释放及其向CO2转化的效率,而且还影响了深海自养微生物碳固定的能力。
7 结论与展望
海洋在碳汇过程中吸收了大量人为来源的碳排放,在调节大气CO2浓度方面发挥了极其重要的作用。深海是海洋的主体,包含了远大于地球大气的巨大碳库,但我们仍然对其中包括碳循环在内的元素循环缺乏认识。作为固碳端,一方面我们需要加强对海洋的生态建设以及保护,研究现在以及未来的人类活动对深海碳循环过程的影响以及环境效应。另一方面,我们也应评估应用深海作为地球工程技术平台封存CO2的潜力。
(1)海洋通过溶解度泵和生物泵向深海输送碳元素,降低大气中CO2的分压。溶解度泵导致海洋酸化,而通过生物泵的作用只有极低比例的有机碳能够沉降并封存到海底沉积物中。
(2)微生物碳泵目前已被证明是海洋储碳的一个重要机制——微生物在矿化有机碳的过程中产生长周转时间的RDOC。RDOC的产生、碱度增强以及碳酸盐的沉淀,可以在缺氧的环境中实现微生物介导的海洋碳负排放[107]。
(3)另外,深海中的微生物初级生产作用与厌氧甲烷氧化过程也是海洋碳汇的重要组成部分,分别起到转化无机碳以及削减甲烷释放的作用,这部分的增汇效果有待进一步研究。理解高压下的深海碳循环过程是开发深海固碳潜力的基础,然而目前我们对深海碳循环的认识仍然相对不足,这要求我们在全球气候变化的背景下,继续努力揭示深海高压下的碳循环过程。

