术前NLR水平与原发性肝癌患者肝切除术后肝衰竭的相关性
朱翊 赵萍 李杰珍 冉博
中性粒细胞/淋巴细胞比值(neutrophil/lymphocyte ratio,NLR)主要受中性粒细胞(neutrophils,NE)、淋巴细胞(lymphocyte,LY)水平的影响,能够显著反映机体免疫功能[1]。研究表明,肿瘤组织可分泌白细胞介素-1及肿瘤坏死因子,致使体内NE过表达,而NE过表达又可改变肿瘤组织的生长环境,使环境更利于肿瘤生长[2]。且有诸多报道显示,LY可间接或直接杀死肿瘤,是维持机体免疫功能的重要因子之一,能够激活肿瘤免疫;同时,LY低表达可为肿瘤浸润提供[3-4]。研究指出,NE、LY的绝对值能够作为炎症反应的标志物进行研究,但NE、LY的绝对值具有不稳定性,故临床上多通过易检测、可重复且价格低廉的NLR作为炎症反应检测指标[5]。且有相关研究表明,术前NLR表达情况可能是子宫内膜癌患者术后发生病死的影响因素之一[6]。故推测术前NLR水平对原发性肝癌患者肝切除术后发生肝衰竭有影响,但相关研究较少。本研究主要观察原发性肝癌肝切除术后发生肝衰竭患者术前NLR表达情况,并分析NLR与原发性肝癌肝切除术后肝衰竭的关系。
资料与方法
一、一般资料
回顾性分析,收集2017年3月至2019年11月期间新疆医科大学第一附属医院完成肝切除术治疗与术后随访的274例原发性肝癌患者作为肝癌组,并收集同期医院完成治疗与随访并经组织病理证实为肝脏良性肿瘤的67例患者作为对照组。肝癌组中男性146例,女性128例;年龄48~69岁,平均年龄(59.24±3.74)岁;γ-谷氨酰转肽酶水平400~501 IU/L,平均γ-谷氨酰转肽酶水平(469.85±16.49)IU/L;碱性磷酸酶水平313~389 IU/L,平均碱性磷酸酶水平(367.13±9.52)IU/L;乳酸脱氢酶水平314~386 IU/L,平均乳酸脱氢酶水平(346.89±13.05)IU/L;α-L-岩藻糖甘酶水平65~90 IU/L,平均α-L-岩藻糖甘酶水平(71.35±5.12)IU/L;甲胎蛋白水平456~576 IU/L,平均甲胎蛋白水平(465.15±5.24)IU/L。对照组中男性39例,女性28例;年龄47~70岁,平均年龄(58.98±3.56)岁;γ-GT水平393~512 IU/L,平均γ-GT水平(468.97±16.52)IU/L;ALP水平312~388 IU/L,平均ALP水平(366.99±9.48)IU/L;LDH水平313~387 IU/L,平均LDH水平(345.96±13.24)U/L;AFU水平66~91 IU/L,平均AFU水平(72.03±5.06)IU/L;AFP水平454~575 IU/L,平均AFP水平(466.11±5.03)IU/L。统计学对比两组一般资料,差异无统计学意义(P>0.05),具有可对比性。
纳入标准:①原发性肝癌患者经组织病理确诊;②肝脏良性肿瘤经组织病理证实为良性;③预计生存时间>3个月;⑥临床资料保存完整。排除标准:①合并心功能、肾功能衰竭的患者;②合并其他恶性肿瘤的患者;③合并严重传染性疾病或感染性疾病的患者;④合并免疫系统性疾病的患者。
四、研究方法
(一)NE、LY及NLR水平检测 分别于患者入院第二天早晨,空腹抽取患者静脉血4 mL,使用南京贝登医疗股份有限公司提供的型号为BC-5000全自动血细胞分析仪检测患者的NE、LY水平,并计算NLR水平。
(二)肝衰竭发生情况 记录原发性肝癌患者肝切除术后肝衰竭发生情况,肝衰竭诊断标准参照《肝衰竭诊疗指南》[7]。
五、统计学分析

结 果
一、肝癌组与对照组术前NE、LY及NLR水平比较
肝癌组术前NE及NLR水平均高于对照组,LY水平低于地对照组,差异有统计学意义(P<0.05)。见表1。

表1 肝癌组与对照组术前NE、LY及NLR水平比较(,×109/L)
二、肝衰竭发生情况
274例原发性肝癌患者中,肝切除术后发生肝衰竭的患者有32例,占比为11.68%(32/274);未发生肝衰竭的患者有242例,占比为88.32%(242/274)。
三、发生肝衰竭组与未发生肝衰竭组术前NE、LY及NLR水平比较
发生肝衰竭组术前NE、NLR水平均高于未发生肝衰竭组,LY水平低于未发生肝衰竭组,差异有统计学意义(P<0.05)。见表2。
四、术前NLR水平对原发性肝癌患者肝切除术后发生肝衰竭的影响分析
将原发性肝癌患者术前NLR水平作为协变量,肝切除术后发生肝衰竭作为因变量(1=发生,0=未发生),经二元Logistic回归分析结果显示,术前NLR过表达是原发性肝癌患者肝切除术后发生肝衰竭的影响因素(OR>1,P<0.05)。见表3。
五、术前NLR水平预测原发性肝癌患者肝切除术后发生肝衰竭的价值分析
将原发性肝癌患者术前NLR水平作为检验变量,肝切除术后发生肝衰竭作为状态变量(1=发生,0=未发生),经ROC曲线分析结果显示,术前NLR水平预测原发性肝癌患者肝切除术后发生肝衰竭的AUC为0.812,>0.80,预测价值较理想。见图1。AUC的95%CI为0.703~0.921,标准误0.055,P<0.001,最佳阈值2.034,特异度0.988,灵敏度0.875,约登指数0.863。
讨 论
研究指出,原发性肝癌患者中有80%~90%的人合并不同程度的肝硬化,肝硬化可降低患者肝脏组织再生能力,进而增加肝衰竭风险[8]。合并肝硬化的原发性肝癌患者在肝切除术后可出现肝衰竭,致使肝细胞生长因子低表达,减少肝脏再生体积,增加原发性肝癌患者术后病死风险[9]。
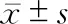
表2 发生肝衰竭组与未发生肝衰竭组术前NE、LY及NLR水平比较()

表3 术前NLR水平对原发性肝癌患者肝切除术后发生肝衰竭的影响分析

图1 术前NLR水平预测原发性肝癌患者肝切除术后发生肝衰竭的ROC曲线图
研究表明,原发性肝癌的发生、发展与全身或局部炎症反应密切相关,炎症反应的发生不仅可促使大量新血管生成,也可阻止细胞凋亡,损坏脱氧核糖核酸(deoxyriboNucleic acid,DNA),进而促进肝脏癌变程度进一步发展[10]。NE经酶的作用可分泌大量激素物质,这些激素物质不仅能够有效调节血管口径,提高血管通透性,且可引发炎症反应及疼痛,进而影响凝血功能[11]。研究指出,NE是炎症反应发生与发展的主要因子之一,NE可直接影响宿主细胞免疫功能,进而降低宿主细胞抗癌能力;同时,NE可释放大量血管内皮生长因子,促使毛细血管增生,为肿瘤组织的生长及转移提供有利条件[12]。LY作为体积最小的白细胞,是机体免疫应答功能的重要细胞成分,可主导淋巴系统内的大部分免疫功能[13]。报道显示,LY能够显著阻止肿瘤细胞发生增殖及迁移,继而发挥抗肿瘤作用[14]。相关文献指出,LY低表达能够降低机体的抗癌能力,且LY与机体免疫反应有关,能够直接杀灭肿瘤细胞[15]。NLR表达情况受NE与LY表达影响,研究指出,NLR可有效反映机体炎症反应发生程度,且效果分别优于NE、LY单一指标[16]。术前NLR过表达已被研究证实是肾癌患者不良预后的独立危险因素,可显著提高肾癌患者病死风险[17]。此外,NLR水平是非小细胞肺癌独立预后因素[18]。相关研究证实,肝衰竭的发病基础是大量肝脏细胞发生坏死,炎性细胞浸润,进而引发多种炎症反应,促使肝脏发生缺血性损伤,引发肝功能障碍。故推测NLR也可能参与了原发性肝癌患者肝切除术后发生肝衰竭的发病过程,可能对早期评估原发性肝癌患者肝切除术后发生肝衰竭有一定价值。
本次研究结果显示,肝癌组术前NE及NLR水平均高于对照组,LY水平低于地对照组,初步表明术前NLR异常表达可能参与了原发性肝癌的发生,该结果也可能提示了术前NLR对患者肝切除术后发生肝衰竭的预测价值。进一步比较不同肝衰竭原发性肝癌患者术前NE、LY及NLR水平,结果显示,发生肝衰竭组术前NE、NLR水平均高于未发生肝衰竭组,LY水平低于未发生肝衰竭组,进一步表明术前NLR异常表达与原发性肝癌患者术后肝切除术后肝衰竭的发生有一定内在联系。做二元Logistic回归分析结果显示,术前NLR过表达是原发性肝癌患者肝切除术后发生肝衰竭的影响因素;最后绘制ROC曲线发现,术前NLR水平预测原发性肝癌患者肝切除术后发生肝衰竭的AUC为0.812,>0.80,预测价值较理想。上述结果均证实,术前NLR表达与原发性肝癌患者肝切除术后肝衰竭有关,可作为患者术后肝衰竭发生风险预测指标。但本研究仍存在较多不足之处,如本研究采取回顾性分析,回顾性分析在搜集患者临床资料时,具有诸多不可控制的因素,符合条件的样本数量较少、典型案例较少、研究数据不具有代表性等。鉴于此,希望未来能够开展多中心、大样本的前瞻性研究,加以佐证本次研究数据,以提高其可信度,旨在为未来临床该类患者的治疗提供科学依据。

