巯基棉富集分离-原子荧光光谱法测定高碳高硫地质样品中痕量硒
马万平, 温汉捷, 叶琴, 赵越, 杨季华
(1.东华理工大学地球科学学院, 江西 南昌 330013;2. 长安大学地球科学与资源学院, 陕西 西安 710054;3.中国科学院大学地球与行星科学学院, 北京 100049)
硒作为稀散元素之一,具有十分重要的工业价值,据美国地质调查局(USGS)报道2020年全球硒主要用于冶金、制造业、农业、化工、太阳能电池等领域[1];同样,硒在中国现代化建设中同样具有重要地位[2-3]。硒在地壳中的丰度很低,一般为0.05×10-6~0.09×10-6,主要伴生于富有机质岩石和硫化物矿物中[2-5]。硒不仅是重要的成矿元素,更可作为重要的地球化学示踪元素,指示成矿物质来源及生物地球化学过程等,在地球科学和环境科学研究中具有重要的意义[5-9]。
氢化物发生-原子荧光光谱法(HG-AFS)应用于测定砷、锑、铋、汞、碲、硒、锡、镉和铅等痕量元素方面具显著的优势,因而被广泛应用于环境检测、地质矿产、医学药物、材料化学等领域中痕量重金属元素的测定[10]。目前HG-AFS法已成为测定地质样品中硒的首选分析方法,该方法的优势在于操作简易、检测下限低、干扰因素少、灵敏度高、线性范围宽、准确率高等[10-12];但地质样品复杂的基质同样增加了分析难度,如与待测元素共存的阴阳离子、共存的过渡金属、有机质配合物等产生新的化学气体带来的测试干扰[10],特别是对富含有机质样品和硫化物样品,前处理是十分重要的。
巯基棉(thiol cotton fibre,TCF)富集分离硒是目前常规的前处理方法,但在处理富含有机质样品与硫化物样品时常会出现回收率不稳定、TCF过早饱和的现象,从而影响了富集分离效果和测试数据的准确性。因此,本文旨在建立一套适用于富含有机质与硫化物的地质样品中痕量硒的测定方法,以满足各种地质样品中痕量硒的检测需求。通过系统的实验比较,在前人的方法上进行了改进[13-14],建立了微波消解样品、巯基棉分离富集和HG-AFS法测定高碳高硫地质样品中痕量硒的方法。对于富含有机质样品使用双TCF柱法,两次吸附以减少有机质的干扰;针对硫化物样品,可通过增加TCF的用量或者减少称样量来提高硒的回收率;经过标准物质和实际样品的分析结果验证了该方法的可靠性。运用改进后的方法处理后的溶液,硒的回收率满足HG-AFS测试要求。该方法可为地质样品中的痕量硒测定和硒同位素前处理提供技术参考。
1 实验部分
1.1 标准物质和实验样品
实验中使用的标准物质包括:USGS-玄武岩参考物质标准(BHVO-2);USGS-油页岩参考标准物质(SGR-1b);水系沉积物成分分析标准物质(GBW07303);土壤成分分析标准物质(GBW07407);硫化物单矿物标准物质(GBW07270);锌矿石标准物质(GBW07237)。
实际样品:硫化物全岩样品(MA-1)采自陕西金堆城斑岩矿床,硫化物主要为黄铁矿,呈浸染状分布;硫化物全岩样品(MA-2)采自陕西金堆城斑岩矿床,硫化物主要为黄铁矿,呈网脉状分布;辉钼矿单矿物样品(MA-3)采自安徽沙坪沟斑岩钼矿床,辉钼矿呈脉状、浸染状分布;黑色页岩样品(MA-4)采自新疆塔里木盆地北缘阿克苏地区;黑色页岩样品(MA-5)采自贵州黔北地区泥页岩。
空白样品:将BHVO-2玄武岩标准样品,放置于马弗炉中1000℃恒温加热24h,以确保样品中的硒完全挥发。
1.2 标准溶液、材料和主要试剂
硒标准溶液:将国家钢铁研究总院研制的硒标准溶液[编号GSB G62029-90(3401)],逐级稀释至100μg/L。
实验所用材料:医用级脱脂棉、玻璃与聚四氟乙烯器皿等。实验所用玻璃与聚四氟乙烯器皿均使用30%硝酸浸泡48h以上,超纯水洗净后使用。
使用的主要试剂均为优级纯(GR),包括:硝酸、氢氟酸、盐酸、硫酸(无硒)、巯基乙酸、乙酸酐(无水乙酸)、冰乙酸、氢氧化钠、硼氢化钾。其中实验使用的盐酸、氢氟酸、硝酸均为二次亚沸蒸馏。
实验用水为电阻率18.3MΩ·cm的超纯水。
1.3 实验步骤
1.3.1巯基棉(TCF)的制备
在500mL棕色磨口瓶中依次加入53mL巯基乙酸、35mL乙酸酐(无水乙酸)、16.5mL冰乙酸、0.15mL浓硫酸、5mL超纯水和10g医用级脱脂棉。密闭瓶口并充分振荡后,将其放置于烘箱中,在40℃下干燥5天。5天后取出,将巯基棉置于分液漏斗中使用超纯水洗至中性,转移至干净棕色磨口瓶于40℃烘干[13-15]。由于TCF对紫外光十分敏感,需将TCF避光保存。
1.3.2样品消解和硒的分离纯化
(1)使用分析天平称量样品,置于微波消解罐中,加入6mL亚沸硝酸和2mL亚沸氢氟酸(V硝酸∶V氢氟酸=3∶1),拧紧后放入微波消解仪中,设定温度为200℃,90min后消解完成,温度降至室温后取出;将样品溶液转移至15mL聚四氟乙烯消解罐中50~60℃蒸干,赶酸后使用5mol/L盐酸定容至15mL,静置过夜。
(2)将5mol/L盐酸介质的样品溶液以沸水浴30min,冷却降至室温后,加入15mL超纯水,使得样品介质变为2.5mol/L的盐酸溶液,体积共30mL,离心后准备进行硒的富集分离。具体步骤如下:称取0.15~0.2g的TCF,放入长35mm、直径4mm的微柱中,并用5mL超纯水润洗TCF柱后,再用5mL 2.5mol/L盐酸调节TCF柱。将样品溶液以≤0.05mL/s的流速通过TCF柱,待所有溶液流尽后,使用5mL 2.5mol/L盐酸润洗所有容器以及TCF柱。待溶液滴完后,使用吹耳球将TCF柱中残留的溶液吹尽,并将TCF从微柱中取出,放入比色管中,加入2mL 12mol/L浓盐酸与2滴浓硝酸,沸水浴3min,冷却后转移至离心管,随后用3mL超纯水润洗3次残留于比色管壁的TCF,将清洗液转移离心管用振荡器振荡1min,随后再加入5mL超纯水重复以上操作。将上层清液全部转移,稀释后上机测试。
1.4 样品硒含量分析
分析仪器为AFS-8220双道原子荧光光度计(北京吉天仪器有限公司),包括蠕动泵和氢化物发生系统(HG),测定样品处理前后溶液中硒的含量。仪器工作条件:载气、屏蔽气为高纯氩气;载流为5%盐酸;还原剂为2%硼氢化钾溶液;载气流速300mL/min;屏蔽气流速800mL/min;使用双阴极硒空心阴极灯,灯电流80mA,光电倍增管负高压270V。主要分析步骤:采用标准曲线法,配制合适的浓度梯度曲线进行测试。实验标准曲线相关系数均>0.9997,标准溶液、载流、样品溶液的盐酸浓度保持一致。相对标准偏差(RSD)<0.8%。
2 结果与讨论
2.1 实验条件优化
分析测试前,样品的前处理是十分关键的。同样,巯基棉的吸附效率受多种因素影响,包括样品的消解、巯基棉的形态、硒的价态、溶液的流速、体积等[16-20]。实验优化了以下步骤:消解方法,Se(Ⅵ)还原为Se(Ⅳ)的相关处理,TCF吸附装置的适用性,Se(Ⅳ)的解吸步骤。
由于硒具有强烈的挥发性,因此不同的消解体系和条件对测试结果有不同程度的影响[21]。目前,测定地质样品中的硒时,常用的消解方法有:常压强酸消解[13-14,21]、高压闷罐消解[21]和微波消解等[22]。常压强酸消解法为了减少硒的损失,消解温度较低(一般为60℃),导致样品消解不完全,消解时间长。高压闷罐消解法虽能减少硒的挥发,但消解用时较长,过程繁琐。本研究采用效率更高的微波消解法,从测定结果(图1)可知:标准物质与实际样品中硒的测试值与推荐值一致,证明采用微波消解是可行的,相比其他消解方法,其具有消解彻底、高效、消耗试剂少、减少挥发元素损失的优势[22-25]。
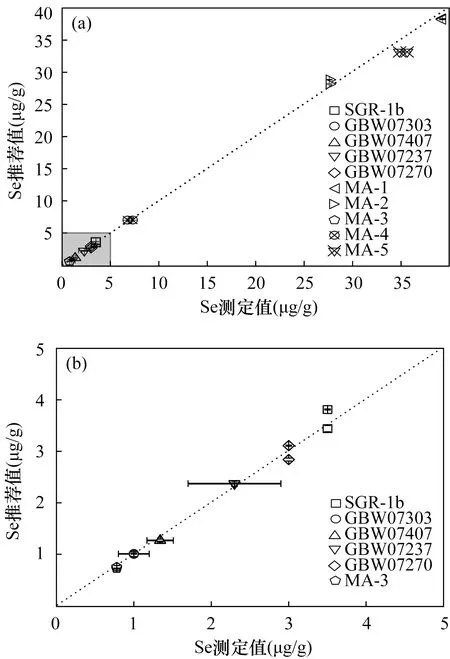
a—本研究实验样品中硒分析结果与推荐值对比图;b—图a左下角放大图。图1 使用微波消解-TCF分离富集后地质样品中硒的测定值与推荐值对比Fig.1 Comparison of the measured values and the recommen-ded values of selenium in the geological samples after using microwave digestion-TCF separation and enrichment
使用TCF的目的是最大限度地吸附硒,并与干扰元素分离。根据以往的研究,影响TCF吸附效率的主要因素有:巯基棉形态与质量、硒的价态、溶液上柱前酸的浓度、体积以及流速等[17-20,26-27]。关于溶液的盐酸的浓度、体积以及流速等已有较多的研究[16-20]。因此,本研究选择的过柱溶液为2.5mol/L的盐酸介质,溶液体积为30mL,溶液通过TCF的流速≤0.05mL/s。
样品中硒的价态是影响TCF的吸附率和HG-AFS测定硒含量准确度的重要因素。通常TCF只能吸附价态较低的离子,因此必须将消解溶液中的Se(Ⅵ)还原到Se(Ⅳ)以提高TCF的吸附率[13-20,28-29]。不同的还原剂,如氢溴酸、氢溴酸-盐酸、盐酸有不同的还原效果[16,30],已有学者的研究表明[15],虽然氢溴酸-盐酸的还原效果最好,但是尚不清楚Br对仪器的干扰,故首选盐酸作为还原剂。本文选择浓度为5mol/L的盐酸,在Se(Ⅵ)含量为400×10-9的前提下与文献中的数据[16]进行对比,使用5mol/L盐酸沸水浴30min后,溶液中的Se(Ⅵ)全部还原为Se(Ⅳ),与6mol/L的盐酸还原效果一致(图2),并节约了实验成本。
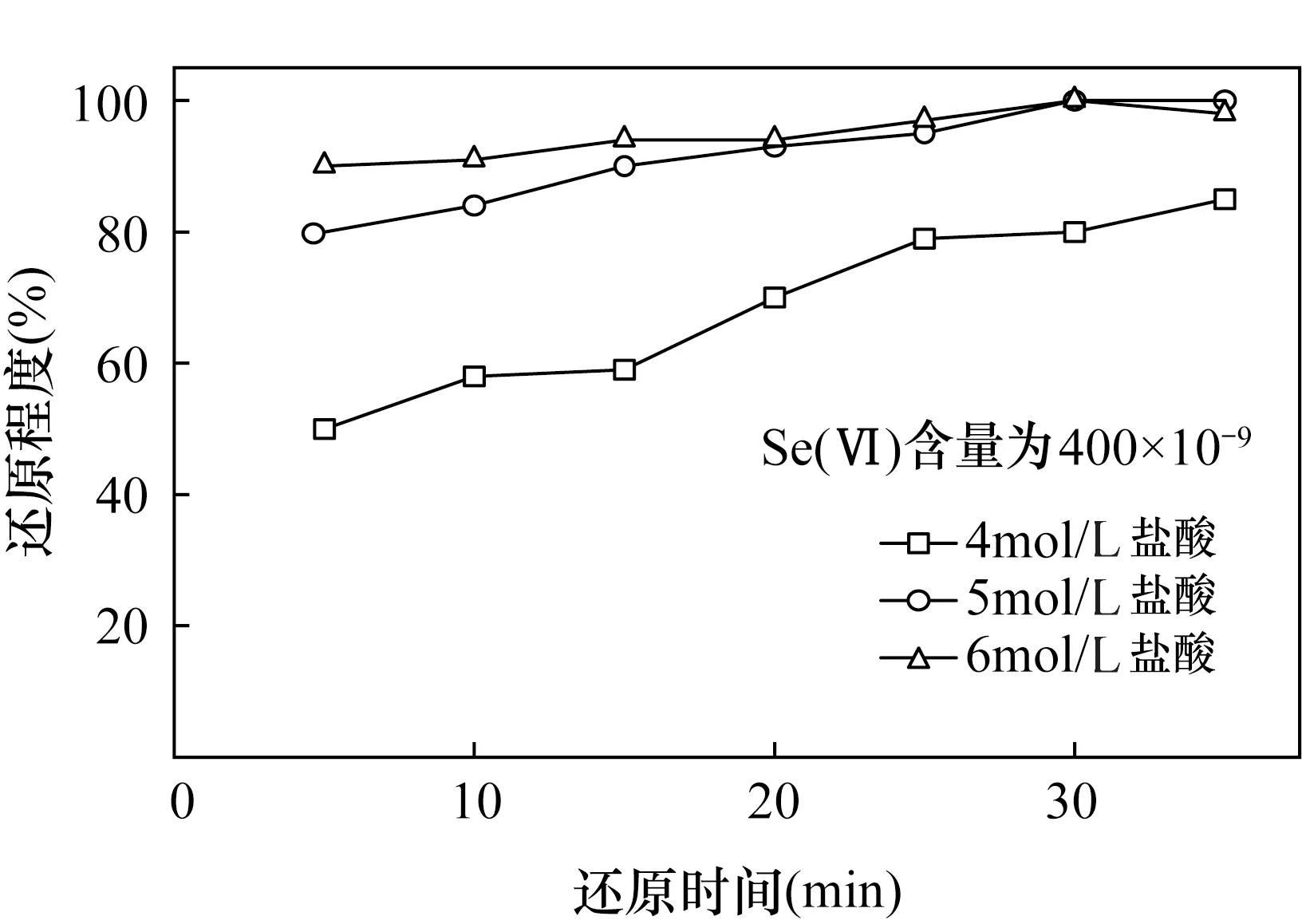
图2 盐酸浓度和时间对硒还原效果的影响Fig.2 Influence of hydrochloric acid concentration and time on reduction effect of selenium
将TCF吸附的硒解吸下来的方法,目前首选高效且简易的热脱法[16-20]。具体步骤是:将TCF取下放入比色管中,加入2mL 12mol/L浓盐酸和2滴浓硝酸,沸水浴加热3min后冷却至室温,转移至离心管中离心,将解吸后的TCF与溶液分离,此方法解吸后的TCF不能再次使用。为了保证较高的回收率,对TCF进行了多次洗涤[31],分别在分离溶液后的TCF中加入3mL和5mL超纯水,先后两次充分振荡后再次离心转移上层清液,尽可能将残留在TCF中的硒全部回收。
表1为优化后的整个实验流程,包括:消解,硒的还原、分离纯化、解吸和分析测试几个步骤。本研究优化的前处理流程,在前人研究的基础上作了改进,以适用于含有机质与硫化物样品的痕量硒分析。

表1 优化后的实验条件和流程
2.2 高有机质样品中硒的准确测定
已有研究表明,TCF在富集分离过程中其吸附能力会受到样品中有机质的强烈干扰[16,18-19,31],一般常用的解决方法是在消解过程中去除有机质。如采用高温焙烧去除样品中的有机质[32-33];当有机质含量较少时还可通过加入高氯酸进行去除[34-36]。由于硒在高温过程中易挥发的特性,而且赶酸时高氯酸易发生爆炸的危险性,故选择消解时添加H2O2(30%)减少有机质的干扰,并进行了对照实验。实验选择了三种常见且有机质含量有差异的标准物质(Corg代表有机碳含量):页岩标准物质SGR-1b(Corg=24.8%),土壤标准物质GBW07407(Corg=0.81%),水系沉积物标准物质GBW07303(Corg=0.73%);以及两个高有机碳的实际地质样品:黑色页岩MA-4(Corg=4.6%),黑色页岩MA-5(Corg=7.1%)。实验通过三种不同处理方法对比样品硒的回收率,mTCF=0.15g(m代表质量),分别为:单柱法(即消解溶液一次过柱分离纯化),其中T-1体系为消解时不加入H2O2,T-2体系为消解时加入2mL H2O2;双柱法(消解溶液过柱,所得的滤液再次过柱),T-3体系使用双柱法消解时不加入H2O2。
表2列出了三种含有机质的标准物质使用不同的处理方法所测定的数据。以GBW07303为例,对T-1体系,单柱法不加H2O2消除有机质时,硒的测定值与推荐值相差较大,硒的回收率低于85.5%±1.50%,其主要原因可能是样品中的有机碳干扰了TCF的吸附能力,造成回收率过低,这与前人实验结果一致[16]。T-2体系中,在消解步骤中加入了2mL H2O2处理有机质,再通过单柱法进行硒的富集分离,硒的回收率大于91.5%±1.50%。但一个关键的问题是,此过程虽然降低了样品中有机质的干扰,但需要将消解溶液中的H2O2预先彻底去除,否则残留的H2O2将破坏TCF结构,影响TCF的吸附能力[16]。
为了避免H2O2可能产生的干扰,本实验通过双柱法(T-3体系)两次富集样品中的硒,其平均回收率接近100%,很好地满足了TCF富集分离样品中硒的回收率要求。三种不同体系相比较(表2),从T-1(单柱法不加H2O2)到T-2(单柱法加H2O2)再到T-3(双柱法不加H2O2),硒的回收率为上升趋势,其中T-3(双柱法,不加H2O2)的回收率最高且稳定,故本文选择不添加H2O2消解样品后,使用双柱法富集分离为处理含有机质样品的优选前处理方法。
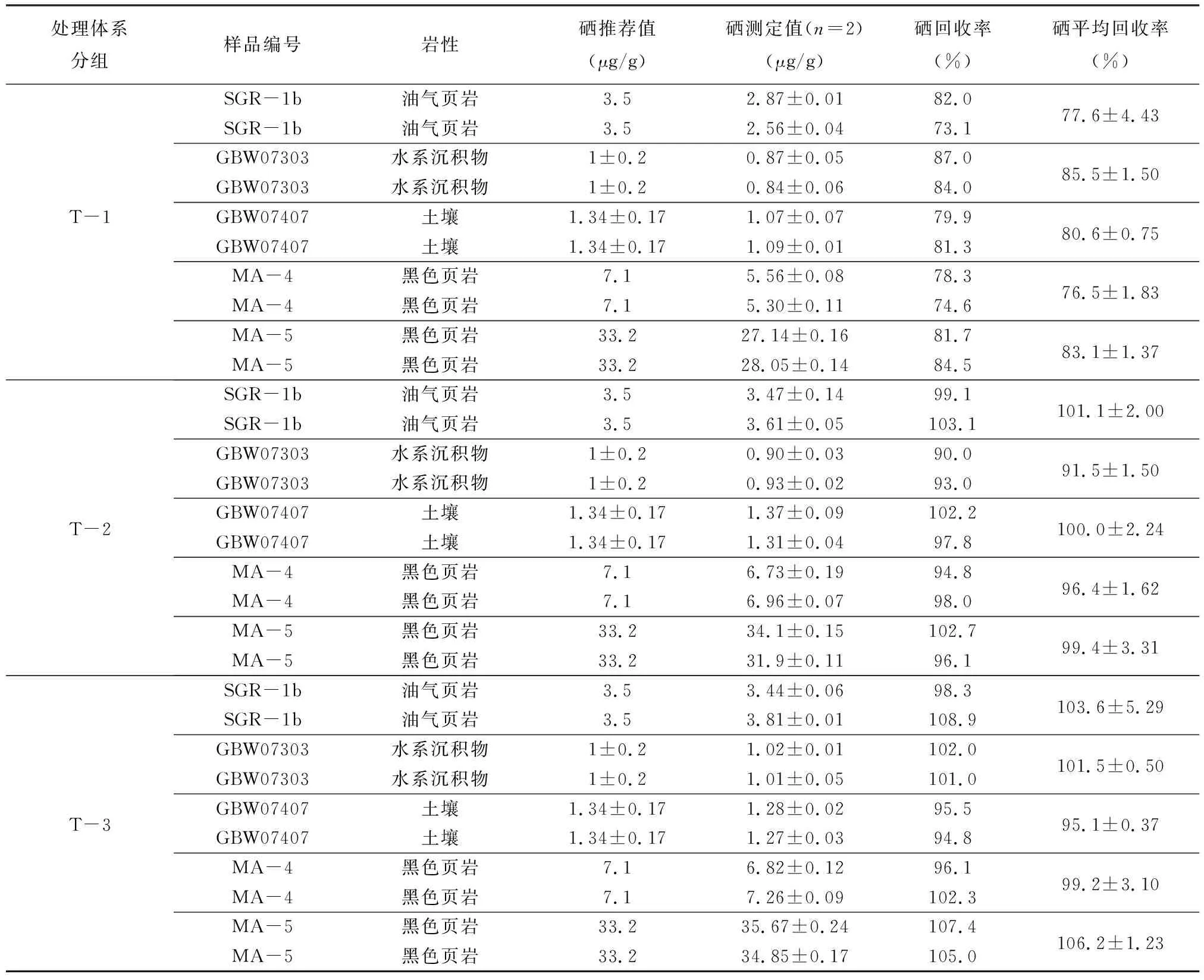
表2 不同处理体系测定富有机质地质样品中的硒含量结果
2.3 硫化物样品中硒的准确测定
TCF定量吸附一定的元素后就会饱和。Yu等[18-19]讨论了TCF的吸附与饱和条件,在盐酸溶液中,TCF在吸附硒的同时同样还会吸附其他的重金属元素,吸附顺序为:Bi(Ⅲ)≈Sn(Ⅱ)>Ag(Ⅰ)>Cu(Ⅱ)>In(Ⅲ)>Pb(Ⅱ)>Cd(Ⅱ)>Zn(Ⅱ)>Co(Ⅱ)≈Ni(Ⅱ)>Tl(Ⅰ)[19]。硒的化学性质与硫比较相似,因此硒主要以类质同象的方式存在于硫化物中[2-5],而硫化物样品往往富集上述亲硫元素。对硫化物样品进行硒的富集分离时,硫化物样品中钴、镍、铜、铅和锌的综合作用将会造成TCF提前饱和[18-19,37],TCF会显现红色。为了解决TCF过早饱和的问题,本文将硫化物标准及其硫化物样品分为两个体系进行对比实验:S-1组,mTCF=0.15g;S-2组,mTCF=0.2g(mTCF<0.15g时可能无法完全吸附溶液中的硒,mTCF>0.2g时会造成吸附后的硒无法完全解吸[20])。
临床病理教学针对临床诊断,其中有患者的个体因素需要考虑,学习内容复杂,临床症状差异万千,因此需要慕课平台投入大量的资源,在整个平台运行中,在线解说、答疑、和讨论要更多,所以要求注册平台的学生有一定的病理专业知识,同时更要有成为病理科专业医生的强大热情。这些特点符合C型慕课平台“非开放性”和“精英主义”的特点,将为临床病理培养更多的“病理专业精英医生”。
比较两种TCF用量的测试结果(表3),当mTCF=0.15g时(S-1组),硫化物标准物质及样品的回收率均小于89.6%±0.43%;其标准物质及实际样品硒含量的推荐值与测定值有一定差异。从现象观察,TCF呈红色(图3a),造成该体系回收率低的原因是硫化物中的多种亲硫元素占据了大部分巯基的位置,导致TCF过早饱和而无法再吸附Se(Ⅳ)[18-19,31]。相反,mTCF=0.2g时(S-2组),TCF未变色(图3b),硫化物样品回收率大于95.5%±1.92%,高回收率也代表纯化后溶液中的铜、铅、砷、银、金等元素对HG-AFS测定产生的干扰较小。
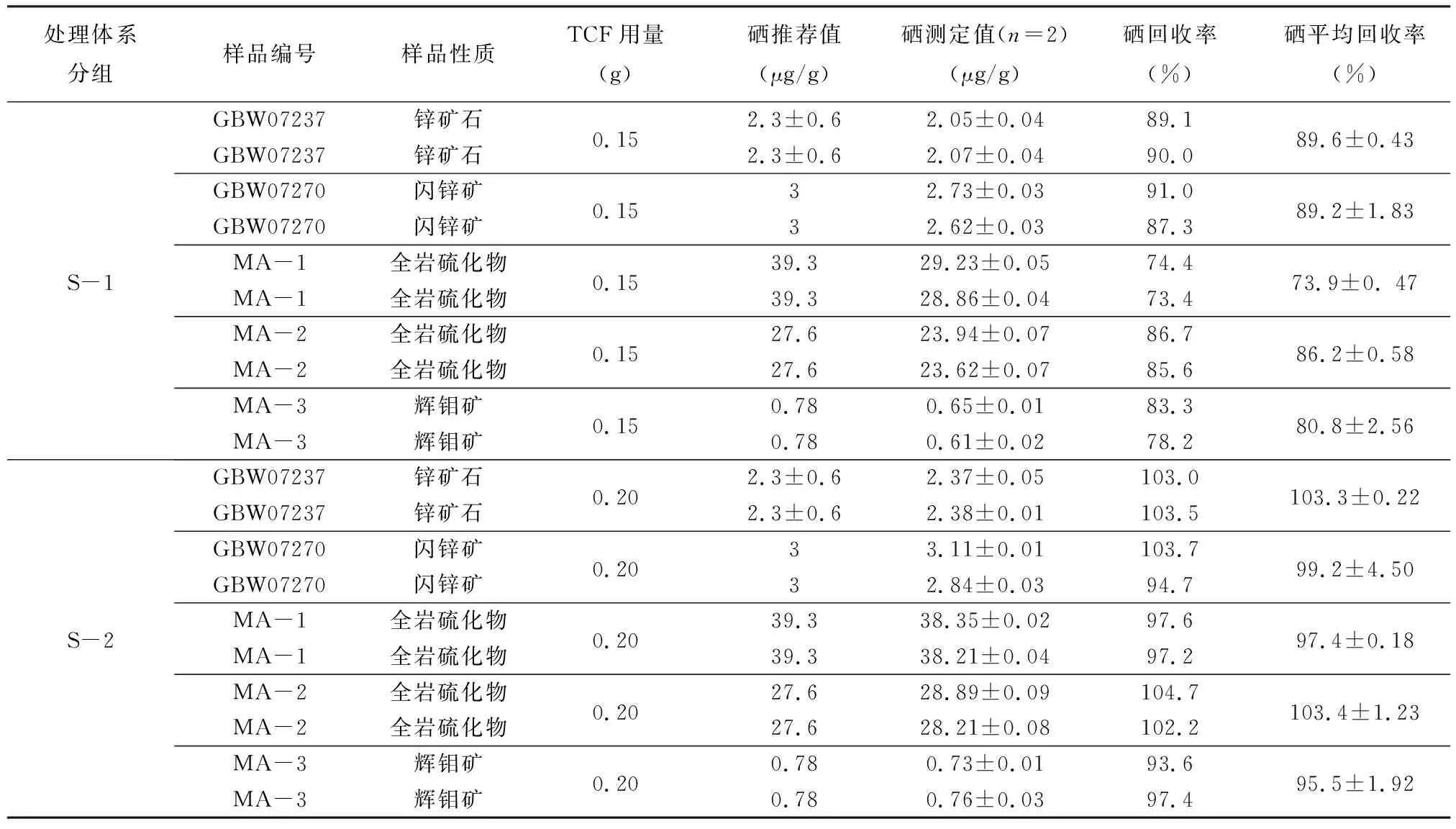
表3 不同处理体系测定硫化物样品中硒含量结果

a—巯基棉质量为0.15g(S-1组)发生饱和,显现红色;b—巯基棉质量为0.2g(S-2组)未发生饱和,无显色。
测试结果显示硒的回收率(表3),S-2组(mTCF=0.2g)>S-1组(mTCF=0.15g),且S-2组的标准物质和实际样品的硒测定值与推荐值一致(图1、表3),表明通过增加TCF的量来达到预期回收率是可行的,故选择S-2组的处理方法,0.20g的TCF富集分离硫化物样品中硒的效果最佳。同时也说明通过减少称样量,以防止TCF的提前饱和来提高硒的回收率是可行的。实验中可通过TCF变色(红色)来判断其是否饱和。
2.4 硒标准溶液中硒的准确测定
同样,当使用硒标准溶液检验TCF的吸附效果时,硒的回收率并不能达到100%,故对硒标准溶液进行了TCF富集实验,使用单柱法(mTCF=0.15g)。为了比较不同步骤处理后的结果,实验中使用控制变量法将样品因不同处理步骤分为五组,样品共10个(表4),分别为:B-1组(β-1、β-2)无硒玄武岩,按正常样品处理,经过消解、硒还原、解吸等整个实验流程;B-2组(β-3、β-4)纯硒溶液,经过消解、解吸流程,不作硒还原处理;B-3组(β-5、β-6)纯硒溶液,经过消解、硒还原、解吸等整个实验流程;B-4组(β-7、β-8)纯硒溶液,在消解前加入250mg无硒玄武岩,经过消解、硒还原、解吸等整个实验流程;B-5组(β-9、β-10)纯硒溶液,先将250mg无硒玄武岩消解后再添加至硒溶液中,再经过硒还原、解吸等整个实验流程。
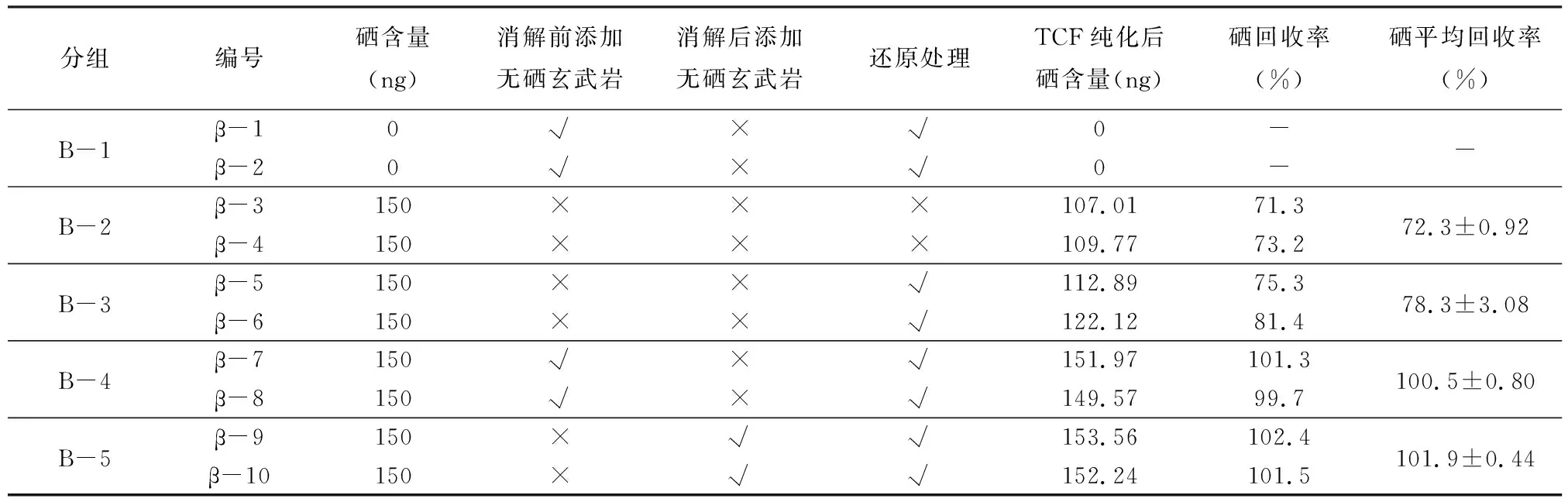
表4 不同处理步骤硒标准溶液的回收率
表4列出了五个不同处理流程中硒标准溶液的回收率。作为样品空白的无硒玄武岩(B-1),其硒含量为0,且经过10次重复测定,反映了本文制作的无硒玄武岩的可靠性。当纯硒溶液经过TCF富集分离时,不经过还原处理(B-2),回收率仅为72.3%±0.92%,经过还原处理的纯硒溶液(B-3)其回收率也仅为78.3%±3.08%。然而,在消解前添加250mg无硒玄武岩作为基质改进剂(B-4),经过所有的实验流程,其回收率可达100.5%±0.80%。同样地,将消解的无硒玄武岩后添加至纯硒溶液中后(B-5),经过实验的所有流程,其回收率可达101.9%±0.44%。这些结果表明如果在硒标准溶液中不添加任何矿物基质时,硒可能在还原分离步骤中损失,硒的这种损失可能是在溶液中的总硒被还原为Se(Ⅳ)的过程中,当硝酸盐/阳离子不存在时,形成单质硒(Se0)的原因而造成的[13-14]。因此,当使用硒标准溶液来检验硒的富集分离效果时,通过添加无硒玄武岩改进基质来提高硒的回收率是必要的。
不同性质的矿物、岩石标准物质使用本研究的前处理方法对硒富集分离后,采用HG-AFS测定样品中痕量硒的含量,分析结果与其他研究中文献报道值、推荐值进行比较,结果见表5。可见本研究的硒测定值与文献报道值[38-39]、推荐值相符,数值差异在误差范围之内。同样,采用改进后的方法对实际样品的处理结果(表3、表4)验证了本文前处理方法的可靠性,表明改进后的前处理方法同样适用于实际的地质样品。
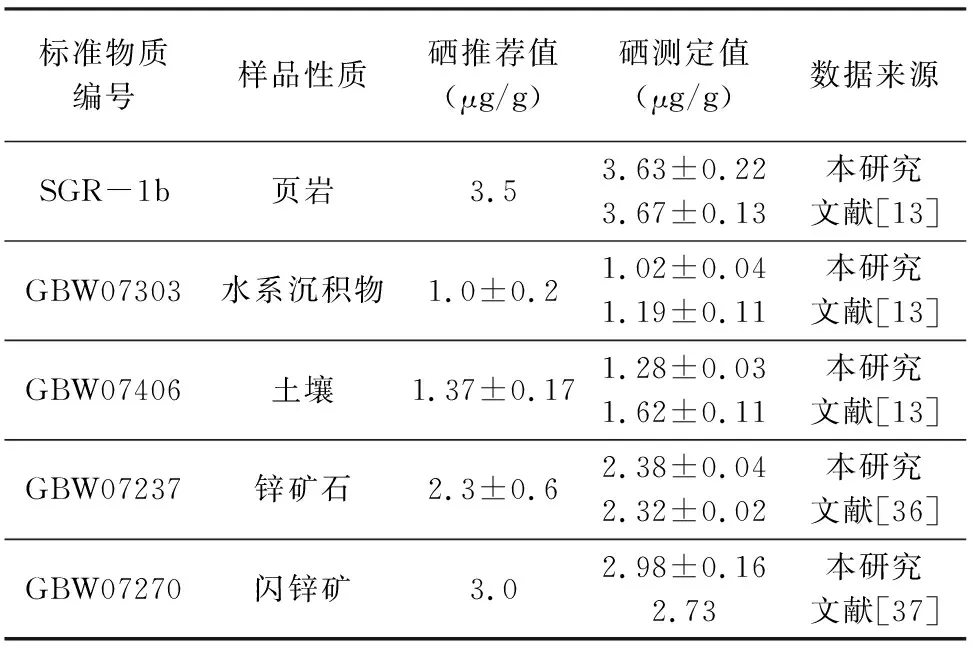
表5 改进后的方法与不同研究中硒的测定值比较
3 结论
本研究建立了微波消解、TCF富集分离、HG-AFS法测定高碳高硫地质样品中硒含量的方法。在传统的TCF富集分离地质样品中硒的方法基础上,针对高碳地质样品,可通过使用双柱法,两次通过TCF柱来减少有机质的干扰,达到高回收率的效果,回收率大于95.1%±0.37%。针对高硫地质样品,可通过增加TCF用量,或者减少称样量来提高TCF的吸附率,回收率大于95.5%±1.92%。当使用硒标准溶液作为TCF富集分离硒的效果参考时,添加无硒玄武岩改进基质来提高硒的回收率是必要的。

