榄香烯放射治疗增敏作用机制的研究进展
吴文博 段国辰
据世界卫生组织(WHO)发布的2018年最新全球癌症统计数据显示,2018年全球新增1 810万例癌症病例,死亡人数高达约960万[1]。据国家癌症临床研究中心最新报道,在过去的半个世纪,我国所有癌症的发病率和死亡率在不断增加,癌症已成为我国主要的死亡原因[2]。放射治疗是治疗恶性肿瘤的主要治疗手段之一[3]。临床上,由于临近正常组织对射线耐受剂量的限制,很难达到抗肿瘤所需要的足够照射剂量,由此造成治疗的失败,因此,如何增加肿瘤对射线的敏感性,即在不损伤正常组织的前提下,在较低放射剂量下如何实现较高的治疗效果,是临床肿瘤放射治疗面临的最突出问题。近年来,中药的抗肿瘤作用日益被大家所关注,榄香烯是我国从姜科植物温郁金的根茎中自主提取的具有抗肿瘤活性的中药,是一种萜烯类化合物,对榄香烯基础研究方面的大量循证医学证据证实榄香烯具有毒副作用小、抗瘤谱广、临床疗效确切等特点[4]。近年来,榄香烯作为放射治疗增敏剂,临床增敏效果已得到认可,但其增敏作用机制是国内外研究的重点和热点,通过阅读国内外文献,搜集整理,归纳出榄香烯的放射治疗增敏作用机制如下。
1 影响肿瘤细胞DNA双链损伤修复
DNA依赖蛋白激酶(DNA-PK)是由DNA-PKcs、Ku70和Ku80 3个亚基组成,其参与多种细胞通路,已成为癌症的治疗靶点,在细胞DNA双链断裂的修复(DSB)、DNA损伤的应答中起到关键作用,因此DNA-PK在维持基因组完整性方面起着重要作用[5-7]。
有研究发现榄香烯在干扰放射治疗致肿瘤细胞 DNA双链损伤修复而发挥增敏作用,通过克隆形成实验观察β-榄香烯对肺腺癌A549细胞放射敏感性影响,采用彗星分析法探讨其损伤修复的作用机制,结果发现β-榄香烯与放射治疗疗联合作用于A549细胞时,对细胞DNA损伤明显增加,并对其修复有明显的抑制作用,提示其增敏作用机制与β-榄香烯对细胞的DNA放射损伤及修复作用有关[1]。田莹莹等[8,9]研究发现抑制Ku70、Ku80参与的双链损伤修复途径可能是β-榄香烯放疗增敏的作用机制。张卓等[10,11]报道,榄香烯对A549细胞具有放射增敏作用,其分子机制可能与下调DNA-PKcs基因表达抑制DSB修复和下调凋亡抑制基因Bcl-2、上调凋亡基因P53表达促进细胞凋亡有关。在多形性胶质母细胞瘤中也证实了榄香烯的放疗增敏作用,Liu等[12]在β-榄香烯通过抑制ATM信号通路增强多形性胶质母细胞瘤(GBM)的放射敏感性和化学敏感性实验研究中提出β-榄香烯通过抑制ATM信号通路的活化来减少 DNA 损伤修复,从而增强 GBM 细胞对放疗的敏感性。
2 阻滞细胞周期的运转
细胞周期(cell cycle)是指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,分为间期与分裂期2个阶段。间期又分为3期、即DNA合成前期(G1期)、DNA合成期(S期)与DNA合成后期(G2期)。细胞分裂期即M期。在细胞周期中有两个决定性阶段,即G1/S期和G2/M期。近年来在榄香烯放射治疗增敏方面的研究尤以G2/M期阻滞较为突出。
在脑胶质瘤的实验研究中,丁华等[13]采用不同浓度的榄香烯作用于脑胶质瘤SHG-44细胞株,证明了榄香烯对脑胶质瘤SHG-44细胞株有肯定的增殖抑制作用,其放射治疗的增敏机制与G2/M期细胞比例增加、S 期细胞比例减少及抑制Bcl-2蛋白表达诱导肿瘤细胞凋亡有关。关晓燕[14]在榄香烯对人胶质瘤U251细胞株体外放射治疗增敏机制研究中发现榄香烯通过降低p-cdc2(Thr161)、cdc2及放射诱导的cyclinB1表达来诱导细胞G2/M期阻滞进而增加人胶质瘤U251细胞体外放射治疗的敏感性。在肝癌的实验研究中,杨道科等[15]研究发现,β-榄香烯并非由单一机制引起增敏作用,与G2/M期阻滞作用和诱导细胞凋亡有密切关系。在胃癌的实验研究中,贺任才等[16]研究发现,β-榄香烯增强了胃癌MKN28细胞的放射治疗敏感性。从机制上讲,β-榄香烯主要通过诱导G2/M期阻滞、抑制亚致死性损伤修复和诱导细胞凋亡来增强放射治疗的杀伤作用,从而影响MKN28细胞的细胞周期分布而发挥增敏作用。
研究者也在肺腺癌细胞及结肠癌细胞中证实榄香烯的放射治疗的增敏作用,周兴芹[17]通过体外实验发现,榄香烯乳对肺癌A549细胞的放疗增敏作用机制可能与榄香烯乳引起细胞G2/M期阻滞及调控凋亡相关蛋白(Bcl-2蛋白及Bax蛋白)表达,诱导凋亡有关。张明等[18]在β-榄香烯对结肠癌SW480细胞放射治疗增敏作用实验研究中发现,β-榄香烯是通过抑制PI3K/Akt信号通路激活,引起G2/M期阻滞及促进细胞凋亡相关蛋白表达来提高对SW480细胞的放射敏感性。
3 抑制肿瘤血管形成
血管内皮生长因子(vascular endothelial growth factor,VEGF)为肿瘤发生发展过程中调节和促进血管再生的最重要细胞因子,在肿瘤细胞的增殖、迁移、抗凋亡、血管生成中发挥了重要作用[19]。临床研究已经证实,肿瘤组织具有血管依赖性,其中微血管密度(microvascular density,MVD)是反映肿瘤组织血管生成效应的最主要参数,MVD被作为判断肿瘤血管生成的“金标准”,而且与肿瘤的侵袭性及预后密切相关[20,21]。
樊辉等[22-24]均通过β-榄香烯作用于A549肺腺癌移植瘤进行实验研究,3个实验均出现一致的结果,即单纯用药组的抑瘤能力较弱,而其与放射治疗联合应用时,抑瘤效果得到显著放大,体现出明显的放疗增敏作用,Western blot及免疫组化分析结果显示,单纯放疗后血管内皮生长因子(VEGF)和微血管密度(MVD)表达水平明显提高,而β-榄香烯与放射治疗联合作用时,VEGF和MVD表达水平受到显著抑制,结果证明β-榄香烯在此移植瘤模型中,通过抑制血管内皮生长因子VEGF的表达和下调微血管密度MVD,改善肿瘤血管而发挥放射治疗的增敏作用。
同样,有研究者也在乳腺癌细胞移植瘤及宫颈癌细胞证实了β-榄香烯的放射治疗增敏作用。龚敏等[25]在β-榄香烯对小鼠乳腺癌移植瘤放射治疗的增敏效果及对血管形成的影响实验研究中发现,β-榄香烯可作为乳腺癌放射治疗的有效增敏剂,同时可有效的降低VEGF和MVD的表达,从而抑制肿瘤内微血管的形成。张思[26]在β-榄香烯对人宫颈癌Hela乏氧细胞放射治疗增敏作用实验研究中通过RT-PCR和细胞免疫组化SP方法表明VEGF及HIF-1αmRNA和蛋白表达水平在单纯放射治疗组明显增高,而在联合组中其表达受到显著抑制,提示β-榄香烯对人宫颈癌Hela乏氧细胞的增敏作用机制可能是通过抑制HIF-1α与VEGF表达,进而抑制肿瘤血管生成。
4 诱导肿瘤细胞凋亡
在众多的凋亡调控基因中Bcl-2蛋白家族、caspase家族和IAP家族最受关注。Bcl-2蛋白家族是一类特别的凋亡调控家族,主要通过作用于线粒体和内质网来调控细胞凋亡,其成员中有一部分可促进细胞凋亡,如Bax、Bad、Bid,而还有些成员阻止凋亡,如Bcl-2、 Bcl-w、Bcl-x[27-29]。Caspase(半胱氨酸天冬氨酸酶)也是一种促使细胞凋亡的蛋白酶,在细胞凋亡机制网络中位于核心地位,其中 Caspase-3在细胞凋亡的调控机制中处于核心位置,作为关键的细胞凋亡执行者,激活Caspase-3并促进其表达是凋亡信号传导通路中的关键的环节[30]。Survivin是凋亡抑制蛋白家族(IAP)中蛋白分子量最小的成员,结构独特,具有抑制细胞凋亡和调节细胞有丝分裂的双重功能;Livin是IAP家族的新成员,也是一种抗凋亡蛋白,Survivin、Livin基因广泛表达于各种恶性肿瘤中,但在正常的组织细胞中不表达或者低表达[31,32]。
4.1 调节Bcl-2家族相关基因蛋白表达 在对宫颈癌HeLa细胞体外实验研究中,曾春生等[33,34]发现,榄香烯能显著提高HeLa细胞的放射敏感性,与促进Bax表达,下调Bcl-2表达及上调p53参与细胞凋亡调节相关。在肺癌和肾癌方面的实验研究也与上述结论一致,据肺癌的体外实验研究报道[35],β-榄香烯具有良好的放射增敏作用,其机制可能与上调p53、下调Bcl2,诱导细胞凋亡有关。王子明等[36]在β-榄香烯对人肾癌裸鼠移植瘤的放疗增敏作用及相关基因表达变化研究中发现,β-榄香烯放疗增敏的机制与改变 Bcl-2/Bax 比例诱导肾癌细胞凋亡有关。
4.2 上调Caspases蛋白酶活性 文兰香等[37]在β-榄香烯联合卡铂对结肠癌SW480细胞放射治疗增敏作用的实验研究中发现,β-榄香烯联合卡铂能增加结肠癌SW480细胞放射治疗敏感性,抑制结肠癌SW480细胞增殖、侵袭水平,提高凋亡水平,其机制与β-榄香烯联合卡铂能促进SW480细胞Caspase-3、Caspase-6 mRNA和蛋白高表达有关。佘军军等[38]在β-榄香烯对兔VX2肾癌放射治疗增敏作用中Caspase-3及Bcl-2的表达实验研究中通过免疫组化方法发现,空白组Caspase-3蛋白表达为阴性,与单纯放射治疗组比较,增敏组为中等阳性且差异有统计学意义(P<0.05)。表明榄香烯对兔VX2肾癌具有放射治疗增敏,与上调Caspase-3表达相关。
4.3 抑制凋亡相关蛋白IAP家族的表达 李小龙等[39,40]先后用β-榄香烯作用于人肺腺癌裸鼠移植瘤探索放射治疗增敏机制,均通过免疫组织化学染色检测各组Survivin的表达,在2个实验研究中均发现β-榄香烯具有明确的放射治疗增敏作用,依据免疫组化半定量分析方法结果显示,与其他各组相比较,榄香烯与放射治疗联合组中Survivin的表达明显降低(P<0.05);而与单纯空白对照组比较,单独放疗组Survivin的表达明显增强(P<0.05),表明β-榄香烯可能通过下调Survivin的表达,而达到放射治疗增敏的作用。佟恩娟[41]随后在研究乏氧肺癌细胞体外实验中也得出榄香烯可能下调HIF-1α/Survivin通道来促进细胞凋亡,由此来发挥乏氧肺癌细胞的放射增敏作用。
汪凤等[42]在榄香烯对人胶质瘤U251细胞的放射增敏机制实验研究中发现,榄香烯可能通过下调Cdc2蛋白、降低cyclin B1表达、抑制cylcin B-Cdc2复合物的形成、下调Survivin表达等方面增强U251细胞对放疗的敏感性。
赵庆涛等[43]在β-榄香烯联合照射对肺腺癌A549细胞凋亡及Livin基因表达的影响实验研究中发现,与单纯放射和单纯用药榄香烯组比较,榄香烯与放射联合组A549细胞凋亡率明显增高(P<0.05),结合PCR结果显示与单纯放射组相比,联合组Livin基因mRNA表达量显著下降 (P<0.01),表明β-榄香烯乳具有放射增敏作用,其增敏机制与抑制A549细胞增殖,下调凋亡基因Livin的表达,促进A549细胞凋亡有关。
5 临床应用
榄香烯具有较好的放射治疗增敏作用,能发挥稳定的抗肿瘤效果,目前榄香烯联合放射治疗在恶性肿瘤的临床应用上已取得了一定的进展。
钱静等[44]通过对老年食管癌患者在放疗期间增加口服榄香烯乳,来评估观察近期疗效时发现同步加量调强放疗联合榄香烯口服乳治疗老年食管癌近期疗效较好,患者易耐受,费用较为适中。杨梅等[45]通过榄香烯乳注射液联合全颅放疗治疗乳腺癌脑转移患者,结果发现榄香烯乳注射液与放射治疗联合治疗乳腺癌脑转移具有协同作用,不但可以改善患者症状,且不良反应较轻。王记南[46]通过榄香烯乳注射液联合放射治疗对骨转移癌疼痛的临床疗效观察,发现联合榄香烯乳注射液对骨转移癌疼痛放射治疗效果显著,优于单纯的放射治疗,可在临床上推广应用。高忠媛[47]在榄香烯同步放射治疗对宫颈癌不良反应的临床研究中发现,放射治疗同时应用榄香烯注射液在预防骨髓抑制不良反应中起到积极作用。
还有临床研究人员对肺癌脑转移患者进行了系列研究报道,宦佳乐等[48]发现榄香烯注射液联合放射治疗不仅能有效提高肺癌脑转移患者的治疗反应率,而且有效的减少患者的不良反应,提示榄香烯注射液与放射治疗联合治疗肺癌脑转移具有很好的临床应用价值。Sun等[49]研究发现,将榄香烯与全脑放疗联合应用于肺癌多发脑转移患者后,与单独进行全脑放疗的对照组相比,试验组患者的1年生存率为30.0%,中位OS持续时间为9个月,而对照组分别为21.9%和7.1个月,神经系统无进展生存期(n PFS)在试验组和对照组分别为5.2个月和3.7个月(均P<0.05);值得注意的是,接受榄香烯与全脑放疗联合应用的患者与单独进行全脑放疗的患者相比,头痛的发生率明显减少(P<0.05)。提示了榄香烯联合全脑放射治疗肺癌多发脑转移患者,可延长nPFS,减少头痛的发生率,提高患者的生活质量。一项包含765例肺癌脑转移患者的荟萃分析表明,与单纯放疗组的患者比较,接受榄香烯注射液联合放疗的患者客观缓解率(ORR)有更大的改善;而且联合组患者在骨髓抑制及白细胞减少症等不良反应的发生率方面明显低于单纯放疗组,差异均有统计学意义(P<0.05),以上说明了榄香烯注射液联合放射治疗肺癌脑转移患者可以提高治疗效果,减轻患者的症状,并减少放疗引起的不良反应[50]。
此外,很多患者因长期接受放射治疗后,造成机体免疫功能降低,导致放疗毒副作用增加,因而无法耐受放疗进程,有相当一部分患者甚至被迫选择中止放疗,而当中止放疗后,机体内残留的肿瘤细胞往往会迅速增殖,进而导致肿瘤的浸润、转移,最终影响患者的预后。机体的免疫功能在抵御肿瘤过程中发挥着重要作用,有不少临床研究表明榄香烯联合放疗可明显改变和增强肿瘤细胞的免疫原性,诱发和促进机体对肿瘤细胞的免疫反应。
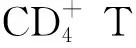
肿瘤的复发、侵袭及转移是影响癌症患者预后的关键因素,肿瘤细胞的运动和黏附能力与瘤细胞浸润和转移密切相关。基质金属蛋白酶(matrix metalloproteinase,MMP)是一个大家族,MMP-2和MMP-9是其主要成员,可对纤维粘连蛋白、弹性蛋白及Ⅳ型胶原等细胞外基质成分降解,对肿瘤细胞的侵袭及转移有促进作用[53]。郑瑞明等[54]研究发现,将榄香烯注射液联合放疗应用于原发性肝癌患者观察近期疗效,结果显示,与单一使用放射治疗的对照组患者比较,榄香烯注射液联合放疗的观察组患者总有效率显著增高;对照组治疗前后MMP-2和MMP-9血清浓度分别下降(46.28±10.12)ng/L和(39.66±9.43)ng/L,观察组分别下降(89.36±11.03)ng/L和(85.28±8.32)ng/L,与对照组比较,观察组治疗前后MMP-2和MMP-9血清浓度的下降程度明显增高,差异有统计学意义(P<0.05)。还有临床研究人员比较了榄香烯注射液联合放疗与单独放疗在晚期肺癌、食管癌患者的近期疗效,结果显示,榄香烯注射液联合放疗可以有效提高肺癌、食管癌患者的治疗后部分缓解率及完全缓解率,治疗前2组患者的血清MMP-2和MMP-9水平差异无统计学意义(P>0.05),而观察组患者接受治疗后的血清MMP-2及MMP-9含量明显低于对照组患者,差异有统计学意义(P<0.05)[51,55]。以上提示使用榄香烯注射液联合放疗较单一放射治疗方式效果更优,可以有效抑制MMP-2和MMP-9介导的肿瘤转移过程,对抑制肿瘤的进展具有重要作用。
综上所述,榄香烯对肿瘤的放射治疗增敏作用机制主要是影响DNA双链损伤修复、阻滞细胞周期(主要G2/M期)、抑制肿瘤血管形成、诱导肿瘤细胞凋亡等,体现了其广谱而有效的特点。目前虽然对榄香烯放射治疗增敏作用的分子机制有了一定认识,但仍还存在一些不足之处。首先,由于不同的实验细胞株和实验动物对药物及放射治疗敏感性不一致,以及不是在完全相同的实验条件下进行的研究,难免导致相关基因及蛋白表达的研究结果并不完全一致。其次,榄香烯作为增敏剂的实验研究仍然偏少,其已发现的放射治疗增敏作用分子机制,也仅仅局限于某些肿瘤,因此应扩大各个肿瘤的体外细胞实验和体内动物肿瘤模型实验,一方面可以验证已发现的增敏作用分子机制是否在其他肿瘤上也存在同样效应,另一方面可由此来探索更多潜在未知的放射治疗增敏作用分子机制。
随着进一步的深入研究,相信将会有更多榄香烯抗肿瘤细胞的放射治疗增敏作用机制被发现,建议从已发现榄香烯放射治疗增敏作用机制的分子水平入手,尤其在某一基因水平的上下游基因方面,探索发挥增敏机制作用的内在联系,从而发现榄香烯新的放射治疗增敏作用靶点。

