远端缺血后处理防治胃粘膜损伤的实验观察
汪涛,周业庭,朱安祥,陈新年,周巧林
缺血再灌注损伤(ischemic reperfusion injury,IRI)可通过氧化应激反应产生过量自由基和/或活性氧族(ROS),引发胃肠道粘膜损伤[1]。早期研究结果表明,通过短暂夹闭大鼠腹腔动脉引发的IR可导致胃粘膜损伤且伴随有大量自由基的产生[2]。远端缺血后处理(remote ischemic postconditioning,RIP)可减少急性心肌梗塞后心肌梗死面积[3]、减轻局灶性脑缺血后脑损伤[4]和下肢IRI后肺损伤[5]。虽RIP对重要脏器(心、肺和脑)的保护作用已明确,但其对肢体IR诱发胃粘膜损伤的影响及作用机制尚不清楚。为此,本研究在笔者前期研究[6]基础上,观察RIP对大鼠肢体IR诱发胃粘膜损伤的影响并探讨其可能的作用机制。
1 材料与方法
1.1 动物及分组 健康成年雄性Wistar大鼠108只,体质量220~250 g,来自兰州大学医学院实验动物中心。标准条件(室内12 h昼夜循环、温度22 ℃~24 ℃)下适应性饲养1周后,采用随机数字表法分为3组:对照组(C组)、缺血再灌注组(IR组)及远端缺血后处理组(RIP组),每组36只。
1.2 肢体IRI模型的制备及分组处理 参照文献[7-8]方法制备肢体IRI模型,模型制备前禁食12 h,饮水自由。吸入2%~3%异氟醚浅麻醉,将大鼠仰卧位固定于实验台,应用市售弹力橡皮筋(直径2.5 cm)环扎大鼠双下肢近心端(压力290~310 mmHg)3 h,再灌注24 h。C组不阻断血流;IR组阻断血流;RIP组阻断血流并于再灌注即刻对双下肢近心端重复进行3次30 s再灌注、30 s缺血;除C组外,其余各组均再灌注24 h。
1.3 标本采集及指标测定 分别于再灌注0 h(T0)、1 h(T1)、3 h(T2)、6 h(T3)、12 h(T4)和24 h(T5)采集下腔静脉血后即刻放血、处死大鼠;取胃小弯侧胃粘膜组织,等分为2份,分别置于-20 ℃冰箱存放和用4%中性甲醛固定备用。(1)取血清,按照试剂盒(南京建成生物工程研究所)说明书,于721型分光光度计(上海第三分析仪器厂)上采用比色法测定乳酸脱氢酶(LDH)和肌酸激酶(CK)的活性,于SM-3自动化酶免分析仪(北京天石医疗用品制作所)上采用ELISA法测定TNF-α和IL-10的浓度。(2)取冻存的胃粘膜组织,制备10%组织匀浆,按照试剂盒(南京建成生物工程研究所)说明书,于721型分光光度计上采用黄嘌呤氧化酶法测定超氧化物歧化酶(SOD)活性,邻联茴香胺比色法测定髓过氧化物酶(MPO)活性,考马斯亮蓝蛋白法检测组织蛋白浓度,化学比色法测定黄嘌呤氧化酶(XOD)活性,硫代巴比妥酸(TBA)法测定丙二醛(MDA)含量。(3)取4%甲醛固定的胃粘膜组织,常规石蜡包埋、切片,HE染色,光镜下观察胃粘膜组织病理学变化,采用胃粘膜损伤指数评分[9]来评价胃粘膜组织的损伤情况。评分标准:胃粘膜上皮累积损伤长度范围≤1 mm,1分;>1 mm和≤2 mm,2分;>2 mm和≤3 mm,3分;对损伤宽度>1 mm,损伤评分加倍。

2 结果
2.1 3组大鼠血清中LDH、CK活性和TNF-α、IL-10浓度比较 与C组比较,IR和RIP组血清LDH、CK活性及TNF-α、IL-10浓度升高(P<0.05);与IR组比较,RIP组血清LDH、CK活性及TNF-α浓度均于再灌注6 h时显著降低,而RIP组IL-10浓度于再灌注3h时显著升高(P<0.05)。见表1。

表1 3组大鼠血清LDH、CK活性和TNF-α 、IL-10浓度比较
2.2 3组大鼠胃粘膜组织中SOD、MPO、XOD活性和MDA含量比较 与C组比较,IR和RIP组胃粘膜组织中SOD活性降低,MPO、XOD活性及MDA含量升高(P<0.05);与IR组比较,RIP组SOD活性于再灌注6 h时升高,MPO、XOD活性及MDA含量均于再灌注6 h时降低(P<0.05)。见表2。

表2 3组大鼠胃粘膜组织SOD、MPO、XOD活性和MDA含量比较
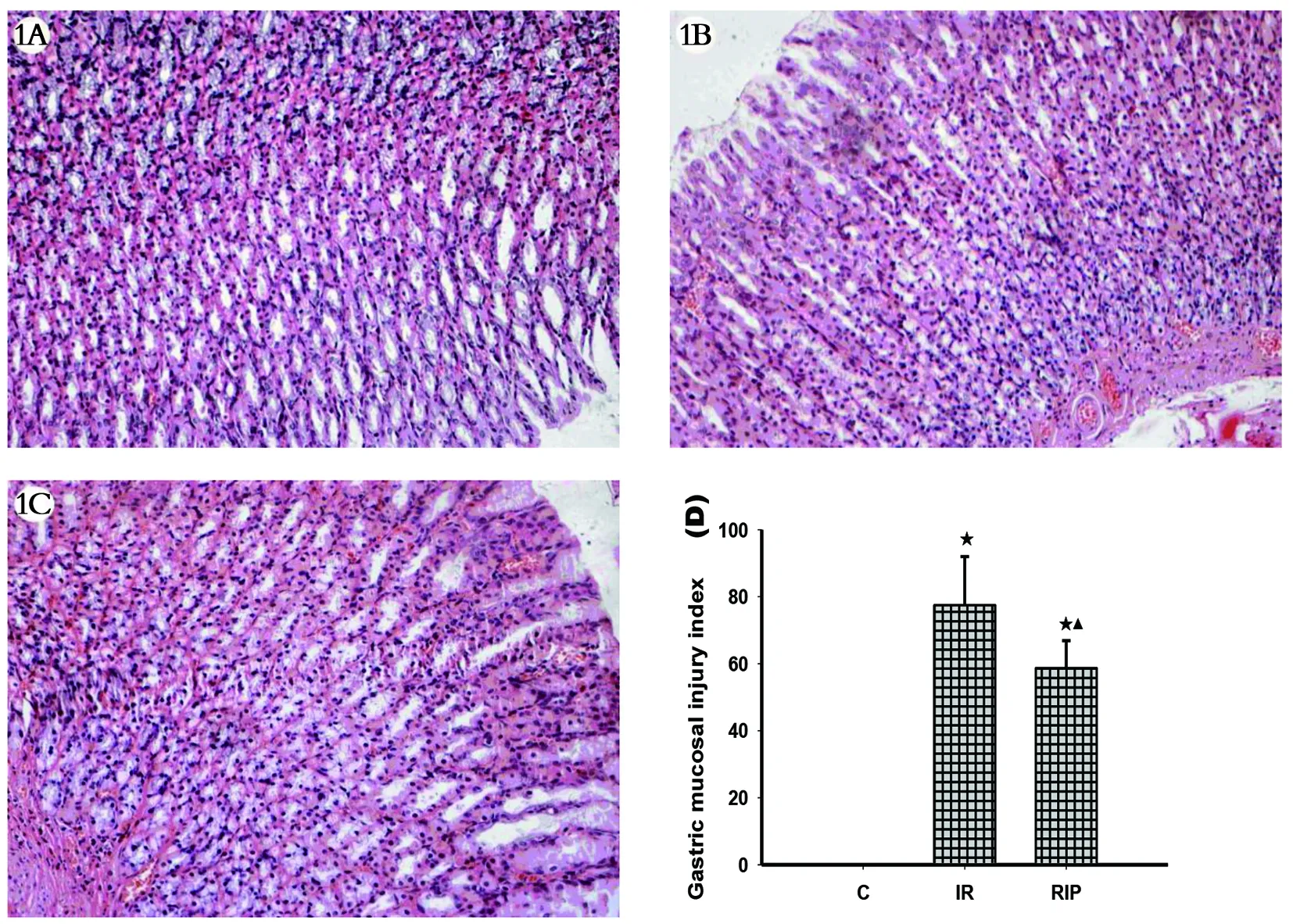
1A 对照组 1B 缺血再灌注组 1C 远端缺血后处理组 1D 3组胃粘膜损伤指数(与C组比较,★P<0.05;与IR组比较,▲P<0.05)。图1 光镜下3组T3亚组动物胃粘膜组织病理学变化(HE×400)及胃粘膜损伤指数评分。
2.3 胃粘膜组织病理学改变 与C组比较,IR和RIP组再灌注6h后见部分胃粘膜肌层与腺体间嗜酸性粒细胞和少量中性粒细胞浸润或部分胃粘膜与腺体间少许嗜酸性粒细胞浸润、偶见中性粒细胞浸润,间质血管扩张充血并粘膜深层少量出血或间质血管扩张充血,胃粘膜组织损伤明显及其损伤评分升高(P<0.05);与IR组比较,RIP组再灌注6 h后胃粘膜组织损伤减轻及其损伤评分显著降低(P<0.05)。见图1。
3 讨论
肢体IRI是日常生活中非常普遍现象,不仅使缺血组织(骨骼肌)出现严重的损伤,而且可引致远端器官(心、肺、肝、肾及胃肠道)损伤[10-11]。本研究参照文献[7-8],应用市售弹力橡皮筋(直径2.5 cm)环扎大鼠双下肢近心端(压力290~310 mmHg)3 h后再灌注24 h的方法制备肢体IRI模型。结果表明,与C组比较,IR组血清LDH、CK活性升高且可见部分胃粘膜肌层与腺体间嗜酸性粒细胞和少量中性粒细胞浸润、间质血管扩张充血及粘膜深层少量出血,说明肢体IRI导致胃粘膜损伤模型制备成功。
ROS、内皮素、微循环障碍、多形核白细胞(PMN)浸润及NO释放[12-13]等在氧化应激和IRI诱发的胃粘膜损伤病理机制中起着决定性的作用,可导致胃粘膜组织损伤和功能障碍。缺血后处理是一种有效的、非侵入性治疗技术[14],可减轻下肢大血管手术期间引发的不同器官(肺、肾)IRI。近年来随着缺血后处理概念的演变及延伸,RIP日益被应用到不同组织器官缺血的保护研究。有研究已证实,RIP可通过降低ROS产生、中性粒细胞浸润、炎症因子释放和促进抗炎因子产生及改善微循环功能和细胞能量代谢,减少急性心肌梗塞后心肌梗死面积[3]、减轻局灶性脑缺血后脑损伤[4]、下肢IRI后肺损伤[5]及肠道损伤[6]。
本研究结果显示,IR组胃粘膜组织中SOD活性降低,XOD和MPO活性及MDA含量升高,提示肢体IRI可引起胃组织抗氧化能力降低,ROS产生增多和细胞膜脂质过氧化反应增强,导致胃组织的氧化性损伤;而RIP组SOD活性升高,XOD和MPO活性及MDA含量降低,提示RIP可提高机体的抗氧化能力,减少ROS的生成,维持机体氧化-抗氧化稳定及降低细胞膜脂质过氧化反应,以减轻胃组织的氧化损伤。另外,本研究中肢体IRI诱发胃粘膜水肿及上皮出血,间质充血,糜烂和炎症细胞浸润等病理变化发生于肢体IR后6 h,此与Brzozowska等[15]的研究结果相一致。
TNF-a通过激活PMN及上调内皮细胞和粒细胞中粘附分子的表达在全身性炎症反应中起着重要作用[16],可间接造成或加重胃IRI[17];IL-10可通过抑制细胞因子(TNF-α和IL-6)的释放和PMN在组织器官的聚积来减轻组织IRI[18]。本研究结果显示,IR组血清TNF-α、IL-10含量升高,提示肢体IRI诱发的胃IRI可引起胃粘膜组织中PMN浸润、聚积而导致胃粘膜组织的炎性损伤;而RIP组血清TNF-α含量降低、IL-10含量升高,表明RIP可抑制PMN在胃组织中的激活、聚集和大量炎症因子的释放及促炎因子的产生,从而减轻胃粘膜组织的炎性损伤。
综上所述,RIP可减轻肢体IRI诱发的胃粘膜损伤,有益于恢复和维持胃粘膜组织结构的完整性,作用机制可能与减少ROS的产生、抗炎和抗氧化效应等有关。

