电针经p38 MAPK信号通路对坐骨神经损伤大鼠脊髓中AQP1和AQP4表达的影响*
宋安华,黎世贵,冯星源,于海波
(1.三亚市中医院 三亚572000;2.深圳市中医院 深圳518001)
周围神经损伤通常发生在道路交通事故、工业事故或家中受伤,临床治疗后很难完全恢复。神经损伤通常会导致永久性的部分运动功能和感觉功能丧失,或两者兼而有之[1]。由恢复不充分而导致的创伤后运动和感觉障碍会严重影响患者的生活质量。因此,寻找新的促进周围神经损伤后完全修复的治疗方案尤为重要。针灸是非手术治疗腰椎间盘突出症的主要传统中医疗法,是临床治疗腰间盘突出症的有效方法之一。既往研究发现,电针(electroacupuncture,EA)对腰间盘突出症坐骨神经损伤具有明显治疗效果[2],但EA治疗坐骨神经损伤的分子机制还未知。研究发现,水通道蛋白4(Aquaporin 4,AQP4)在大鼠坐骨神经损伤导致的神经病理性疼痛中具有重要促进作用[3]。AQPs是一个小的整体膜蛋白家族,通过调节体内水的转运,对水的内环境平衡有重要作用[4]。据报道,AQP1和AQP4在周围神经损伤模型中起重要作用[3,5],但其相关作用机制尚不完全清楚。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是一组能被不同的细胞外刺激激活的丝氨酸-苏氨酸蛋白激酶,主要包括细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和p38 MAPK信号通路,能被炎症细胞因子、氧化应激和生长因子激活来参与机体神经损伤[6]。研究发现,激活小胶质细胞中p38MAPK的磷酸化能引发相关神经损伤及感觉功能障碍[7]。因此,本研究提出电针修复坐骨神经损伤与AQPs的关系,通过构建坐骨神经损伤大鼠模型,探讨电针对坐骨神经损伤的修复作用以及可能的分子机制。本研究是国家重点研发计划课题子课题(2019YFC1712205)的延伸内容,由该子课题提供经费支持。
1 材料与方法
1.1 实验动物
SPF清洁级雄性Sprague Dawley(SD)大鼠60只,鼠龄7-8周,体质量(300±20)g,购自北京维通利华实验动物技术有限公司,许可证编号:SCXK(京)-2018-0011。大鼠分笼饲养,室内温度保持在20-26℃,相对湿度40%-70%,更换新鲜空气10次·h-1,光照循环条件12 h/12 h。适应性饲养1周后进行造模。
1.2 药品与仪器
p38MAPK抑制剂SB203580购自美国Promega公司;BCA试剂盒购自上海碧云天生物技术有限公司;ECL试剂购自美国Thermo公司;兔抗p38MAPK、pp38MAPK(Thr180/Thr182)、β-tubulin、AQP1和AQP4抗体购自英国ABCAM公司;BX60显微镜购自日本Olympus公司;7500荧光定量PCR仪购自美国ABI公司;RM2235石蜡切片机购自上海徕卡显微系统有限公司;6805-A电针仪购自汕头市医用设备厂有限公司;BL-410电生理系统BL-410生物机能实验系统由成都泰盟科技有限公司提供。
1.3 实验分组及模型制备
采用随机数字表法将60只SD大鼠分成假手术组(Sham组)、模型组(Model组)、电针组(EA组)、抑制剂组(SB203580组)和电针+抑制剂组(EA+SB203580组),每组12只。造模前1天,大鼠禁食,正常饮水。所有大鼠均经腹腔注射50 mg·kg-1戊巴比妥钠麻醉,然后参照文献[8],采用钳夹法构建大鼠坐骨神经损伤模型,即将大鼠常规固定消毒后,沿着右侧股后坐骨神经干走向做切口,钝性分离并暴露股骨中段坐骨神经。用血管钳钳夹坐骨神经10 s,放松10 s,重复3次,血管钳扣第3齿,约5 kg钳夹力,完成神经挤压后,复位受损的坐骨神经,逐层缝合手术切口。其中sham组大鼠不进行坐骨神经钳夹,仅暴露坐骨神经。造模成功标准[9]:造模30 min后,各组随机选取2只大鼠测量运动神经传导速度(motor nerve conduction velocity,MNCV)。若造模大鼠MNCV<20 m·s-1,则说明造模大鼠运动能力下降,坐骨神经损伤大鼠模型成功。
1.4 分组干预
EA组、SB203580组和EA+SB203580组分别于造模24 h后进行电针或SB203580干预,其中EA+SB203580组同时进行电针和SB203580干预。电针干预穴位为患侧“环跳”穴[10],即大鼠右侧后肢股骨大转子与尾骨、髂骨结合部连接线外1/3与内2/3的交点处,待大鼠出现瞬间肌肉抽搐和足趾颤动,“负极”刺入鼠尾正中,启动电针仪,设置电流强度2 mA,频率2 Hz/100 Hz疏密波,持续15 min,每天1次,连续14天。SB203580干预即用50% DMSO溶解B203580,以0.5 μg·mL-1[11]剂量鞘内注射10 μL,每天1次,持续14天。
1.5 观察指标
1.5.1 测定大鼠坐骨神经功能指数(Sciatic Function Index,SFI)
于干预前以及干预后第7天和第14天分别测定各组大鼠SFI,将大鼠后足蘸墨水后,从自制足印行走箱(长50 cm、宽8 cm、高10 cm)一端走向另一端。每侧留下4或5个足印,分别测量实验侧足和正常侧足足印的3个变量(足印长度、足趾宽度和中间足趾距离),根据Bain公式[8]计算得出SFI。
1.5.2 HE染色观察大鼠损伤部位坐骨神经病理学变化
干预14天后,腹腔注射50 mg·kg-1戊巴比妥钠麻醉大鼠,经造模切口暴露受损神经,取3 mm损伤处远端神经组织,立刻固定于10%甲醛中固定24 h。经梯度乙醇脱水、二甲苯透明、石蜡包埋、石蜡连续切片(厚约5 μm)等常规石蜡切片标准制备过程后,进行HE染色。石蜡切片经二甲苯脱蜡、乙醇至水,加入苏木素染色5 min,流水冲洗5 min后,1%盐酸乙醇分化20 s,蒸馏水洗涤10 s,加入0.5%伊红染液复染3 min,蒸馏水洗涤30 s后,再经脱水、透明,树脂封片,置于显微镜下观察坐骨神经组织病理变化。
1.5.3 BL-410电生理系统测定大鼠神经传导速度(Nerve Conduction Velocity,NCV)
干预14天后,参考文献[12]操作步骤,经造模切口,拆除缝合线,取已分离了的坐骨神经,将两个引导电极分别置于股神经近侧端和远侧端,两引导电极间的距离为1 cm,最后利用BL-410生物机能实验系统检测各组大鼠NCV。
1.5.4 qRT-PCR检测大鼠脊髓中AQP1和AQP4 mRNA表达水平
干预14天后,取各组大鼠坐骨神经损伤处近、远端相应节段脊髓组织,利用TRIpure试剂提取组织总RNA,使用紫外分光光度计测定RNA浓度。使用反转录试剂盒将RNA反转录为cDNA。通过聚合酶链反应和特异性引物扩增cDNA,利用CFX96实时荧光定量PCR仪进行RT-PCR。PCR反应条件:95ºC 5 min,(40 cycles)95ºC变性5 s,60ºC退火20 s,72ºC延伸15 s。特异性引物:AQP1 F 5'-CCTGCTGGCCATTGACTACA-3',R 5'-TGGTTTGAGAAGTTGCGGGT-3';AQP4 F 5'-TTG GACCAATCATAGGCGC-3',R 5'-GGTCAATGTC⁃GATCACATGC-3';β-tubulin F 5'-AATCCCCACCTT TTCTTACTCC-3',R 5'-AAAGATGGAGGAGGTTCCC-3'。以β-tubulin为内参,采用2-△△Ct法计算AQP1和AQP4 mRNA相对表达水平。
1.5.5 Western blot检测脊髓中p38MAPK、p-p38MAPK、AQP1和AQP4蛋白表达水平
干预14天后,取各组大鼠坐骨神经损伤处近、远端相应节段脊髓组织置于EP管中,加入即用型苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)溶液后进行超声匀速裂解,将匀浆离心后收集的蛋白样品按1:5比例加入上样缓冲液混匀后,沸水浴5 min。使用BCA试剂盒检测样品蛋白浓度。用12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白样品,每个孔25 μg蛋白。电泳完成后,湿转法将蛋白转到PVDF膜上。室温下将PVDF膜置于5%脱脂牛奶中2 h,然后加入一抗抗体兔抗p38MAPK(稀释1∶2000)、p-p38MAPK(Thr180/Thr182)(稀释1∶1000)、AQP1(稀释1:2000)AQP4(稀释1∶1000)和β-tubulin(稀释1:1000)4ºC过夜孵育,其中β-tublin为内参蛋白。加入含0.1%吐温20的磷酸缓冲盐溶液(phosphate buffered solution+Tween 20,PBST)洗涤3次,每次5 min。在37℃下加入辣根过氧化物酶结合的山羊抗兔二抗孵育2 h。然后用增强化学发光(enhanced chemiluminescence,ECL)试剂发光,并将其暴露在X射线胶片上。利用Image J软件扫描并获得蛋白条带灰度值,样品的目的蛋白相对表达量为目的蛋白灰度值与内参蛋白β-tublin灰度值的比值。
表1 各组大鼠SFI值比较(±s)
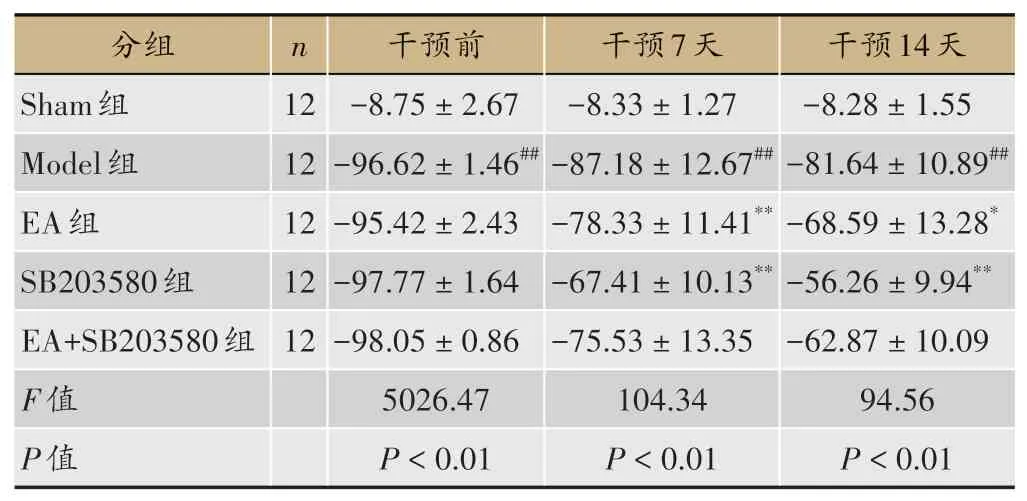
表1 各组大鼠SFI值比较(±s)
注:与Sham组比较,##P<0.01;与Model组比较,*P<0.05,**P<0.01。
?
1.6 统计学分析
数据以平均值±标准差表示。利用SPSS21.0统计分析软件,采用单因素方差分析和Turkey多重事后验分析各组间的统计学差异。采用t检验分析两组之间的显著差异。P<0.05被认为具有统计学意义。
2 结果
2.1 大鼠坐骨神经功能指数(SFI)
干预前,与Sham组比较,Model组的SFI值显著降低(P<0.01);与Model组比较,EA组和SB203580组SFI值无显著性改变(P>0.05);与SB203580组比较,EA+SB203580组SFI值无显著性变化(P>0.05)。干预后第7天和第14天,与Sham比较,Model组SFI值显著降低(P<0.01);与Model组比较,EA组和SB203580组SFI值显著升高(P<0.01);与SB203580组比较,EA+SB203580组SFI值无显著性变化(P>0.05)。
2.2 大鼠损伤部位坐骨神经病理学变化
Sham组大鼠坐骨神经组织结构完整,细胞排列规则、紧密有序。Model组大鼠坐骨神经组织结构松散,细胞肿胀、间质水肿,细胞核发生皱缩或溶解,出现明显炎症浸润。EA组和SB203580组大鼠坐骨神经组织相较于Model组细胞肿胀较轻、组织结构相对较规则和完整,炎症浸润散在组织中。EA+SB203580组大鼠坐骨神经组织与SB203580组的差异不大。
2.3 大鼠神经传导速度(NCV)的检测

图1 HE染色观察大鼠坐骨神经病理变化(×200)
与Sham比较,Model组大鼠NCV显著降低(45.37±6.28 m·s-1vs11.60±4.98 m·s-1,P<0.01);与Model组比较,EA组和SB203580组大鼠NCV显著升高(11.60±4.98 m·s-1vs22.07±4.45 m·s-1,P<0.01;11.60±4.98 m·s-1vs29.46±3.21 m·s-1,P<0.01);与SB203580组比较,EA+SB203580组大鼠NCV无显著性变化(29.46±3.21 m·s-1vs30.25±5.26 m·s-1,P>0.05)。
2.4 电针对大鼠脊髓中AQP1和AQP4 mRNA和蛋白表达水平的影响
与Sham比较,Model组大鼠脊髓中AQP1 mRNA和蛋白表达水平显著升高(P<0.05);与Model组比较,EA组和SB203580组大鼠脊髓中AQP1 mRNA和蛋白表达水平明显降低(P<0.05,P<0.01);与SB203580组比较,EA+SB203580组大鼠脊髓中AQP1 mRNA和蛋白表达水平无显著性变化(P>0.05)。
2.5 电针对大鼠脊髓中p38MAPK、p-p38MAPK蛋白表达水平的影响
与Sham比较,Model组大鼠脊髓p-p38MAPK/p38MAPK显著升高(P<0.01);与Model组比较,EA组和SB203580组大鼠脊髓p-p38MAPK/p38MAPK显著降低(P<0.01);与SB203580组比较,EA+SB203580组大鼠脊髓p-p38MAPK/p38MAPK无显著性变化(P>0.05)。
3 讨论

图2 大鼠脊髓AQP1和AQP4 mRNA和蛋白表达水平
针灸是一种中医治疗方法,已有2000多年的历史。电针是一种改良的针灸技术,在周围神经损伤治疗中已使用了几十年。电针通过外源性电刺激,引起神经细胞膜通透性发生剧变,导致相应电化学改变,对损伤神经的修复有积极作用,可以改善行为、电生理学和形态学[13-14]。因此,本研究通过电针刺激坐骨神经损伤大鼠“环跳”穴,观察其对坐骨神经损伤大鼠的神经恢复的疗效及可能的机制。研究表明,直接电刺激损伤部位可加速坐骨神经再生[15]。在神经生长过程中应用电场能直接影响神经分支[16]。这些结果为电刺激对神经损伤恢复具有积极作用提供了科学依据,并与本研究的功能和组织形态学评估结果一致。在本研究中,采用SFI方法进行功能评估,在电针或抑制剂干预前、干预7天和14天时,测量五组大鼠的后爪印。通常大鼠神经损伤一周后,SFI值逐渐下降[17]。临床上NCV作为电生理检查,是诊断神经损伤类疾病和和判断药物疗效的有效手段之一。本研究结果表明,坐骨神经损伤后,损伤部位远端组织病理结构发生明显改变,出现细胞肿胀、结构松散和间质水肿,出现明显炎症浸润;SFI值和NCV明显降低。电针刺激后,损伤部远端组织细胞肿胀和炎症浸润情况得到有效缓解,SFI值和NCV明显升高,说明电针刺激损伤部位能有效缓解大鼠坐骨神经损伤,促进周围神经的恢复。
p38MAPK信号通路可由紫外线、渗透压变化、生理应激等通过3级激酶级联反应磷酸化激活p38蛋白,调控机体炎症反应、细胞存活以及信号转导。研究发现,p38MAPK抑制剂能减轻坐骨神经炎性疼痛大鼠模型中炎症引起的痛觉异常[18],磷酸化p38蛋白低表达对坐骨神经损伤大鼠背根神经节细胞凋亡有抑制作用[19]。这些数据说明p38MAPK通路活性对周围神经损伤疾病具有调控作用。本研究发现,大鼠坐骨神经损伤后,脊髓中p38MAPK活性明显升高,而电针刺激后,p38MAPK活性明显降低,说明电针对坐骨神经损伤的治疗作用可能与p38MAPK信号通路活性的抑制有关。而且,p38MAPK抑制剂组(SB203580)也表现出明显的治疗效果,其疗效比电针刺激更好,从侧面印证了p38MAPK信号通路是坐骨神经损伤后周围神经恢复的重要一环。另外,电针+SB203580组与SB203580组的检测结果差异不显著说明电针可能无法通过其他途径改善坐骨神经损伤,从反面验证电针可能是通过抑制p38MAPK信号通路发挥作用。AQPs作为定位于细胞膜上的蛋白质,在细胞膜上组成“孔道”,控制水的进出,调节细胞渗透压,其中AQP1和AQP4是在神经组织中表达较多的AQPs。研究发现,AQP1在缺氧损伤的雪旺细胞中异常高表达,与雪旺细胞水肿密切相关[3]。抑制AQP4可以减轻神经损伤产生的病理性疼痛痛觉异常[4],AQP4抑制剂还能有效治疗大鼠脊髓损伤后脊髓水肿和组织损伤[20]。本研究结果表明,坐骨神经损伤能引起脊髓AQP1和AQP4异常高表达,这与之前的研究结果一致。说明AQP1和AQP4参与了坐骨神经损伤过程。电针刺激后,脊髓中AQP1和AQP4蛋白表达水平明显降低。结合之前的研究结果,可以推测电针治疗坐骨神经损伤可能通过抑制p38MAPK信号通路活性,进而抑制脊髓AQP1和AQP4蛋白表达水平,调节神经细胞内外渗透平衡,缓解组织炎症,保护神经组织。
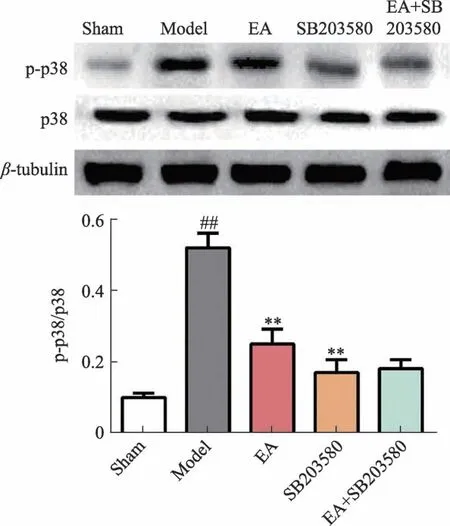
图3 大鼠脊髓p-p38和p38蛋白表达水平
综上所述,电针刺激能有效缓解大鼠坐骨神经损伤,促进周围神经组织恢复,这可能是由于电针刺激可以抑制p38MAPK信号通路活性,进而抑制神经细胞AQP1和AQP4的表达,防治神经组织的水肿和炎症反应。

