灰树花菌包营养供应对子实体的影响*
胡汝晓,王春晖,周 宇,黄民勇,胡素如,彭运祥,王小艳
(湖南省食用菌研究所,湖南 长沙 410013)
灰树花 [Grifola frondosa(Dicks.)Gray],又名舞茸,属担子菌亚门(Basidiomycotina) 层菌纲(Hymenomycetes) 多孔菌目 (Polyporales) 皱孔菌科(Meruliaceae) 树花菌属(Grifola),是一种珍稀食(药)用菌[1-2]。近几年,灰树栽培技术研究在多层次展开,探索性栽培[3]在食用菌欠发展省份仍然很有必要,木屑替代料栽培[4-7]可有效缓解菇木紧缺,精细化配方研究[8-9]不断推进优质高效栽培,工厂化栽培研究[10-11]是栽培研究的新起点,专用品种筛选[12-13]进一步突显优势栽培模式,关键生育期研究[14]是研究精细化的标志,生理研究[15]是栽培创新的基础积累。研究灰树花出菇期菌包营养对子实体生长的影响,既具有较强的栽培实践意义,又是栽培基础生理研究,旨在为栽培创新提供一定的理论基础。
1 材料与方法
1.1 供试菌株与培养基
1.1.1 供试菌株
供试菌株为灰树花5号,湖南省食用菌研究所保藏菌株。原种作栽培种用。
1.1.2 培养基配方
母种采用PDA培养基,原种培养基配方:棉籽壳35%、木屑35%、麸皮14%、玉米粉14%、白糖1%、石膏粉1%,含水量60%。
生产配方:棉籽壳34%、木屑34%、麸皮10%、玉米粉10%、白糖1%、石膏粉1%、山表土10%,含水量60%。
1.2 试验方法
1.2.1 制棒
棉籽壳和木屑于制棒前1 d预湿,先将除山表土外的其他原料按配方拌匀,再加入山表土拌匀,菌棒采用15 cm×48 cm聚乙烯塑料袋,菌棒长30 cm~32 cm,常压灭菌,冷却至30℃以下接种箱接种,每个菌棒单面接种2穴,20℃~30℃培养至菌丝满棒。
1.2.2 并棒
挑选长势一致的菌棒进行并棒出菇试验。对照组:单根菌棒出菇。处理1:在每根菌棒的一侧割出长10 cm、宽1 cm的长缝,然后将2根菌棒的割缝对准并用胶带捆绑在一起出菇。处理2:先将1根菌棒的两侧分别割出长10 cm、宽1 cm的长缝,然后将另外2根菌棒的一侧也割出长10 cm、宽1 cm的长缝,再将后面2根菌棒的割缝与前一根菌棒的两侧割缝分别对准并用胶带捆绑在一起出菇。割缝及并棒操作参见图1。

图1 灰树花菌棒处理Fig.1 Treating of artificial bed-log of Grifola frondosa
1.2.3 出菇管理
并棒当天即进行割口出菇管理,详细操作参见专利“一种灰树花袋栽割口覆瓦式催蕾方法”(专利号CN201110440050.8)[16],其中对照处理在菌棒2个接种孔中间割口出菇,处理1在2个菌棒中的任意1个菌棒2个接种孔中间割口出菇,处理2在中间菌棒2个接种孔中间割口出菇。
1.2.4 取样、模型假设与结果观察
分别于割口当天,割口后第8天、第16天及第24天,取割口处培养物测定培养物全氮、pH及水分含量。采收期为从割口出菇至菇盖边缘深色生长带消失的时间。于割口后第22天,测定幼菇直径(d) 和高(h),假设幼菇为锥体,其体积计算公式(V体积,cm3)为:
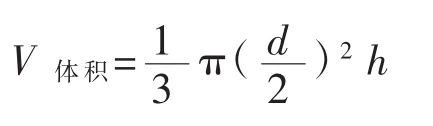
式中:d表示幼菇直径(cm);h表示幼菇高(cm)。
碎菇为采菇时菇盖小于1 cm且菇柄明显短于正常菇柄的菇,碎菇率为每个处理随机取5朵菇计算碎菇率再取平均值。
1.2.5 全氮、pH、水分含量测定方法及统计分析方法
全氮采用NY/T 53-1987测定[17],pH采用三爱思精密试纸(pH为3.8~5.4) 直接测定,水分采用烘箱100℃烘干至恒重并计算水分含量。试验对照组及每个处理25个重复,每次取样消耗1个重复,最后幼菇体积及计产每个处理20个重复。数据处理、绘图及统计分析在IBM SPSS Statistics 19上完成。
2 结果与分析
2.1 出菇期培养物中全氮、pH及水分变化趋势
出菇期不同处理培养物全氮变化情况见图2。

图2 出菇期不同处理培养物全氮变化趋势曲线Fig.2 Variation trend curves of total nitrogen content of culture of different treatments in fruiting period
从图2可以看出,出菇过程中,菌棒培养物中的全氮含量总体呈下降趋势。其中,开口后0~8 d下降幅度最大,这一时期为灰树花原基形成期,说明原基形成需要从培养物中吸收大量氮营养;开口后8 d~16 d菌棒培养物中全氮含量变化较小,其中对照组和处理2中氮含量甚至有所回升,这一时期是灰树花原基分化期,说明原基分化不需要从培养物中吸收大量氮营养,而对照组和处理2的氮含量回升,可能是菌棒培养物氮营养转运所致;开口后16 d~24 d全氮含量变化在处理间出现较大差异,其中处理1和处理2变化较为一致,且为明显下降趋势,而对照组全氮含量变化不明显,这一时期是灰树花菇片展开期,对照组菇体比处理1和处理2要小得多,这里出现了一个矛盾,即菌棒培养物全氮含量低的菇体反而长的较大,但如果结合0~16 d全氮含量情况,也可能是对照前期氮营养较低,限菌了灰树花原基的发育,从而导致其子实体后期对菌包营养的吸收能力较弱。出菇期不同处理培养物pH变化见图3。

图3 出菇期不同处理培养物pH变化趋势曲线Fig.3 Variation trend curves of pH of culture of different treatments in fruiting period
从图3可以看出,出菇过程中,菌棒培养物的pH整体呈下降趋势。其中,开口后0~8 d的对照组及2个处理均呈现下降趋势,且处理1及处理2小于对照组,其中处理1下降最显著;开口后8 d~16 d,对照组与处理变化趋势出现明显不同,对照组仍呈明显下降趋势,处理1则出现明显的回升,处理2则几乎没有变化。开口后16 d~24 d,对照组与2个处理变化趋势几乎一致,最终对照组pH要明显低于处理1和处理2,处理1与处理2相比pH则没有明显差异。出菇期不同处理培养物含水量变化情况见图4。

图4 出菇期不同处理培养物含水量变化趋势曲线Fig.4 Variation trend curves of water content of culture of different treatments in fruiting period
从图4可以看出,出菇过程中,菌棒培养物含水量总体变化不大,波动范围在初始含水量上下5%以内。其中,开口后0~8 d,对照组与处理1及处理2菌棒培养物含水量变化趋势差异较大,对照组呈明显的下降趋势,处理1变化最小,处理2呈明显的上升趋势;开口后8 d~16 d,对照组及2个处理均呈现明显上升趋势;开口后16 d~24 d,对照组、处理1及处理2菌棒培养物含水量变化趋势较为一致,呈明显下降趋势,这一时期是灰树花菇体快速生长期,菇体需要从培养物中吸收大量水分,培养物含水量下降与菇体快速生长体现了明显的一致性。
2.2 不同处理出菇效果
不同处理出菇效果及数据统计见图5和表1。

图5 不同处理出菇效果Fig.5 Effects of fruiting of different treatments
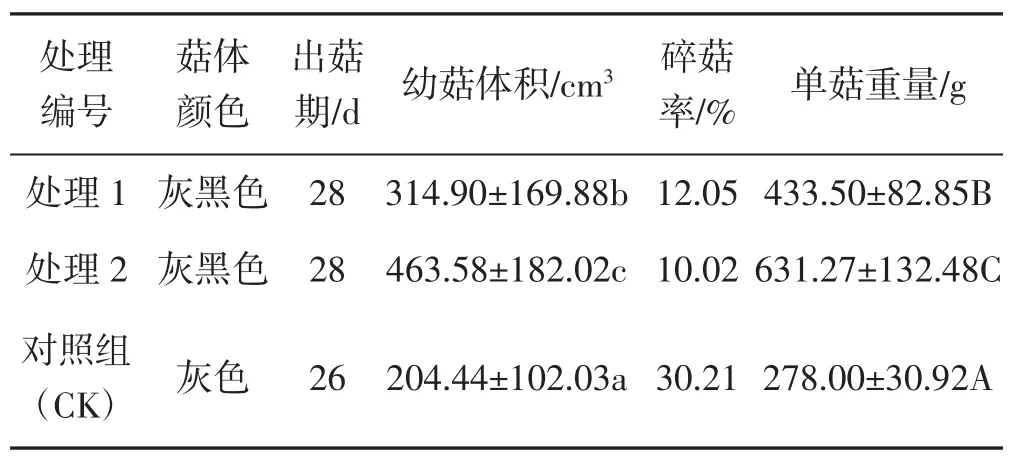
表1 不同处理出菇结果Tab.1 Results of fruiting of different treatments
从图5及表1可以看出,处理1和处理2与对照组相比,菇体颜色明显较深,处理1与处理2之间差异不明显,灰树花子实体颜色一般在幼菇时较深,随着菇体变老其颜色也会逐渐变浅,因此推测并棒可以延长出菇期,这一点在出菇期也可看出。幼菇体积对照组与2个处理,及2个处理间均存在显著差异,单菇重量对照组与2个处理,及2个处理间均达到极显著差异,说明并棒可以提高幼菇大小及单菇重量。
3 讨论
3.1 菌包营养与灰树花子实体发育间的双向影响性
菌包营养对灰树花子实体大小的影响研究更多集中在不同配方对子实体大小的影响,通过并棒研究了菌包大小对子实体大小的影响,或者说营养供给的稳定性对子实体大小的影响。试验得到一个看似矛盾的结果,即并棒后,菇体积较大,产量较高,而最终培养物中氮含量反而较低,但结合出菇全过程看,出菇前期(开口出菇前16 d) 并棒处理培养物全氮含量较高,这一时期可能是决定灰树花子实体大小的关键时期,稳定的营养供给形成了健壮的原基、幼蕾乃至小菇,而健壮的小菇营养吸收能力较强,从而导致最终培养物中全氮含量较低。这说明菌包营养与灰树花子实体发育之间可能存在双向影响。
3.2 菌包营养供应对灰树花子实体品质的影响
多蕾出菇品种如灰树花、平菇、金针菇等有些菇蕾由于营养供应不足而不能完全发育,形成大小不等的幼蕾或小菇,栽培上称之为碎菇。碎菇过多会严重影响商品菇的品相。研究发现并棒处理可极大程度的减少碎菇率,进而提高商品菇品相。这一现象在以往不同规格菌包出菇试验中表现不明显,这可能是并棒不仅改变了菌棒大小,还在于营养供给上有一个时间差,即并棒前期只有一个菌棒为出菇提供营养,而后才是2个或3个菌棒为出菇提供营养,从而确保了出菇中后期的营养供应,因此确保了每个小菇蕾都有足够的营养完成发育,这为高效育菇提供了新思路。
4 结论
主要采用并棒构建灰树花子实体生理研究新模型,与配方试验相比,排除了营养丰度差异的影响,结果表明营养供应稳定性对多蕾出菇品种品质及产量有明显影响,同时灰树花菌包营养与子实体发育间的双向影响亦得到体现,其深层影响机理还有待进一步研究。

