术前纤维蛋白原水平对肝细胞癌微血管侵犯及预后的影响
林联库,刘红枝,黄霆峰,陈一帆,曾永毅
(福建医科大学孟超肝胆医院 肝胆外科,福建 福州 350025)
我国肝细胞癌(HCC)占全世界病例一半以上,且HCC在我国男性癌症相关死亡原因中位居第二(15.2%),女性中排第五(8.9%)[1-2]。肝切除术依然是HCC患者获得长期生存的重要治疗手段,但根治性肝切除术后5 年复发率超过70%,严重影响HCC患者的远期生存[3]。既往研究已经证实微血管侵犯(microvascular invasion,MVI)是影响根治性治疗后HCC复发和患者长期存活的重要因素之一[4–5],通过术前预测MVI的发生风险从而指导临床决策是可行的[6]。虽然在临床上MVI几乎都需依靠病理诊断,但已发现甲胎蛋白、异常凝血酶原或γ-谷氨酰转移酶等标志物与MVI相关,因此认为新的血清生物标志物有望成为未来无创性MVI检测的方法[7]。有研究表明,血清纤维蛋白原(FIB)升高与HCC患者预后不良独立相关[8–10],但FIB与MVI的关系却鲜有报道。故本研究拟通过分析术前血清FIB水平与MVI的关系及FIB对HCC预后的影响,为探索新的MVI相关血清标志物,为预估HCC患者术后的状况提供依据。
1 材料和方法
1.1 一般资料
对福建医科大学孟超肝胆医院2015 年1 月至2019 年4 月行根治性肝切除手术的566 例HCC患者的临床数据进行回顾性分析。纳入标准:(1)行根治性手术;(2)术后病理证实为HCC。排除标准:(1)行姑息性肝切除;(2)行肝切除联合局部消融治疗;(3)在肝切除前行局部消融治疗或经动脉化疗栓塞或全身治疗;(4)围手术期死亡;(5)肿瘤侵犯门静脉、肝静脉主干或肿瘤侵犯邻近器官;(6)合并其他系统恶性肿瘤。
通过我院大数据系统收集患者的资料,包括性别、年龄、肿瘤数目、肿瘤大小、肝硬化、肿瘤分化程度、MVI等,收集患者术前的AFP、FIB、中性粒细胞/淋巴细胞比值(NLR)、间接中性粒细胞/淋巴细胞比值(dNLR)、血小板/淋巴细胞比值(PLR)、淋巴细胞/单核细胞比值(LMR)、ALB、TBIL及ALBI评分。ALBI评分的计算公式=(log10TBIL×0.66)+(-0.085×ALB),TBIL单位为μmol/L、ALB单位为g/L;具体划分为3级[11]:1级评分为≤-2.60,-2.60<2级评分≤-1.39,3级评分为>-1.39。
1.2 随访
通过查阅电子病案系统复查记录、电话、短信、门诊等方式每3 个月随访1 次。截止日期为2020 年12月31日,随访时间为3~60个月。总体生存率(OS)定义为从手术日期到死亡或最后一次随访日期;无复发生存率(RFS)定义为从手术日期到第一次复发或最后一次随访日期。
1.3 统计学分析
采用SPSS 22.0版软件进行统计分析。运用ROC曲线评价预测效能,确定最佳截点;计量资料采用()表示,组间比较采用独立样本t检验;分类变量采用χ2检验或Fisher检验。Kaplan-Meier法计算生存率,并以Log-rank方法比较组间的生存率差异,Cox单因素和多因素分析用于确定预后影响因素。P<0.05表示具有统计学意义。
2 结果
本研究共纳入经组织病理学证实为HCC的566例患者,所有患者皆接受根治性肝切除手术治疗。其中男469例,女97例,平均年龄(56.1±10.8)岁。
2.1 FIB及各炎症指标与MVI的关系
根据ROC曲线(见图1)确定FIB预测MVI最佳截点值为2.7 g/L。NLR、dNLR、PLR、LMR、FIB预测MVI的AUC(见表1)分别为0.570、0.565、0.569、0.566、0.596,其中FIB预测MVI的AUC最高(95%CI0.555~0.637)。

表1 FIB与炎症相关指标预测MVI的ROC曲线AUC
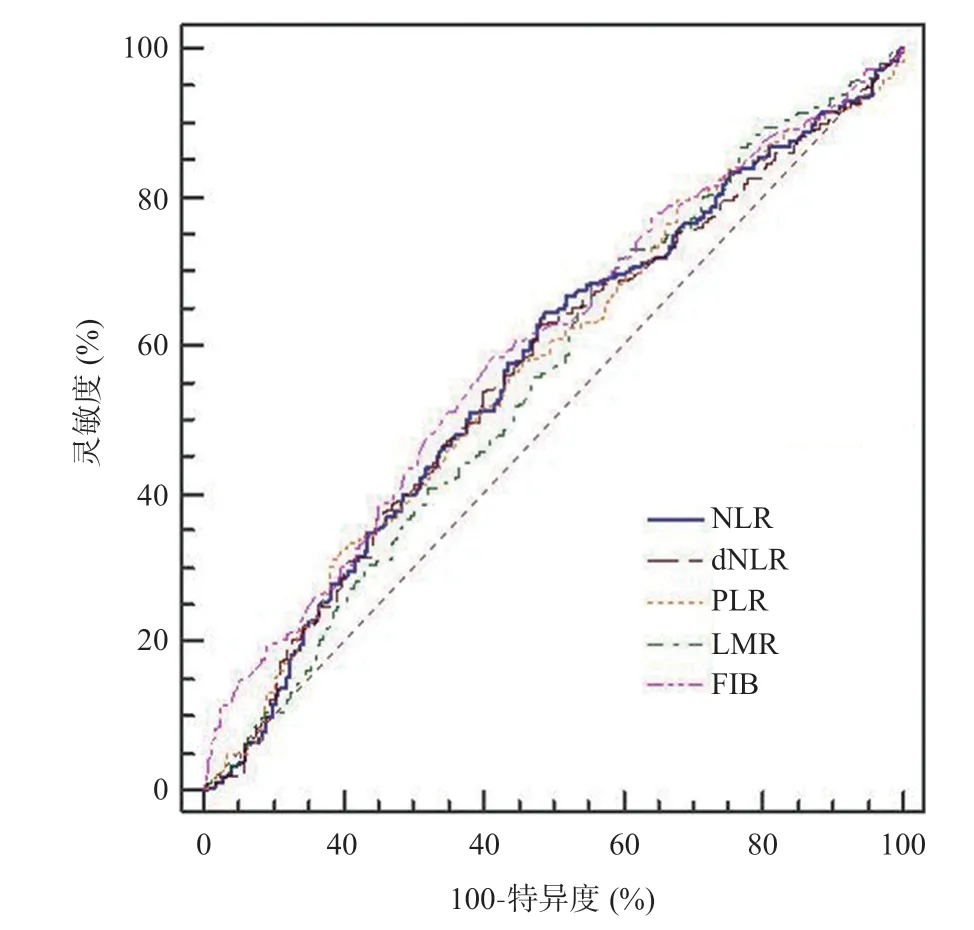
图1 FIB与炎症指标预测MVI的ROC曲线
2.2 FIB与HCC临床病理特征的相关性分析
术前FIB预测MVI最佳界值为2.7 g/L,将FIB>2.7 g/L作为高FIB组,将FIB≤2.7 g/L作为低FIB组。两组肝细胞癌肿瘤大小、肝硬化程度、MVI、ALB、TBIL、ALBI有统计学差异(均P<0.05),其中高FIB组中MVI阳性率为64.0%,明显高于低FIB组的47.0%(P<0.01)(见表2)。
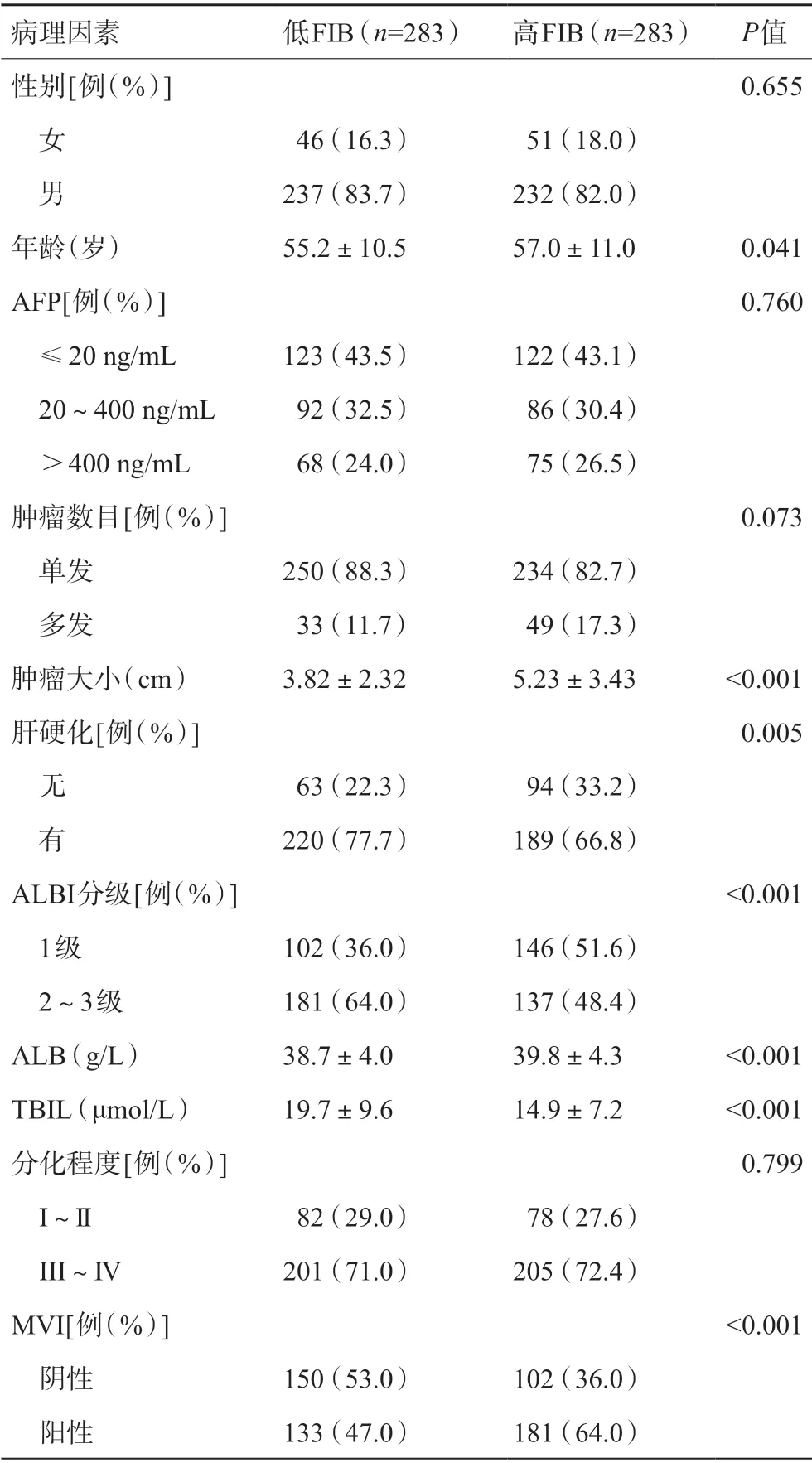
表2 FIB相关临床病理因素分析
2.3 FIB与HCC预后的关系分析
通过Log-rank法分析显示,高FIB组和低FBI组患者术后1、2、3 年的总体生存率(OS)分别为94.4%、92.4%、82.5%和95.8%、91.9%、89.5%,差异无统计学意义(P=0.14,见图2A);低FIB组患者的无复发生存率(RFS)优于高FIB组(71.5%、60.0%、48.3%vs68.6%、47.0%、35.4%,P<0.05,见图2B)。

图2 高FIB组与低FIB组总体生存率比较(A)及无复发生存率比较(B)
2.4 影响患者术后总体生存率(OS)和无复发生存率(RFS)的单因素及多因素Cox回归分析
单因素Cox回归分析结果显示AFP、肿瘤大小、MVI是影响HCC患者的OS的危险因素(P<0.05)(见表3);而年龄、AFP、FIB、肿瘤数目、肿瘤大小、分化程度及MVI是影响HCC患者的RFS危险因素(P<0.05)(见表4)。多因素Cox回归分析结果显示,肿瘤大小、MVI是影响HCC患者OS的独立危险因素(P<0.05)(见表3);而年龄、肿瘤数目、肿瘤大小、分化程度及MVI是影响HCC患者RFS的独立危险因素(P<0.05)(见表4)。
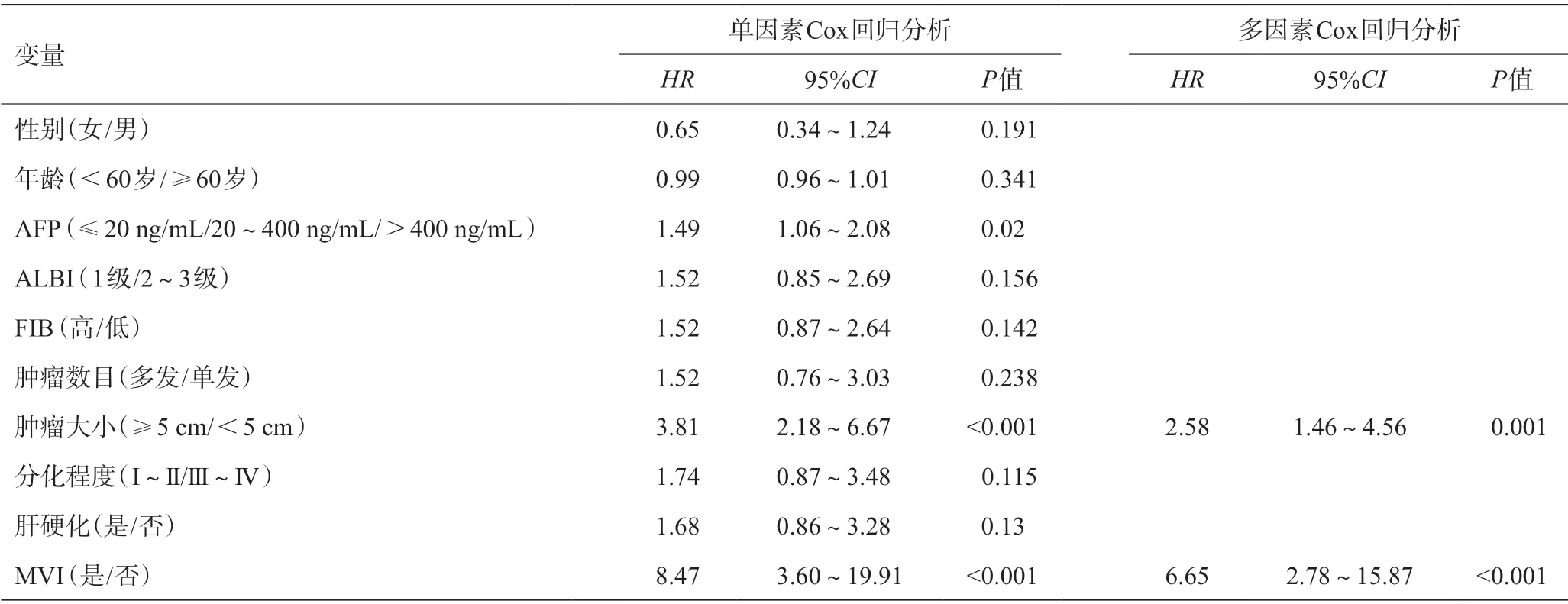
表3 影响OS的单因素和多因素Cox回归分析
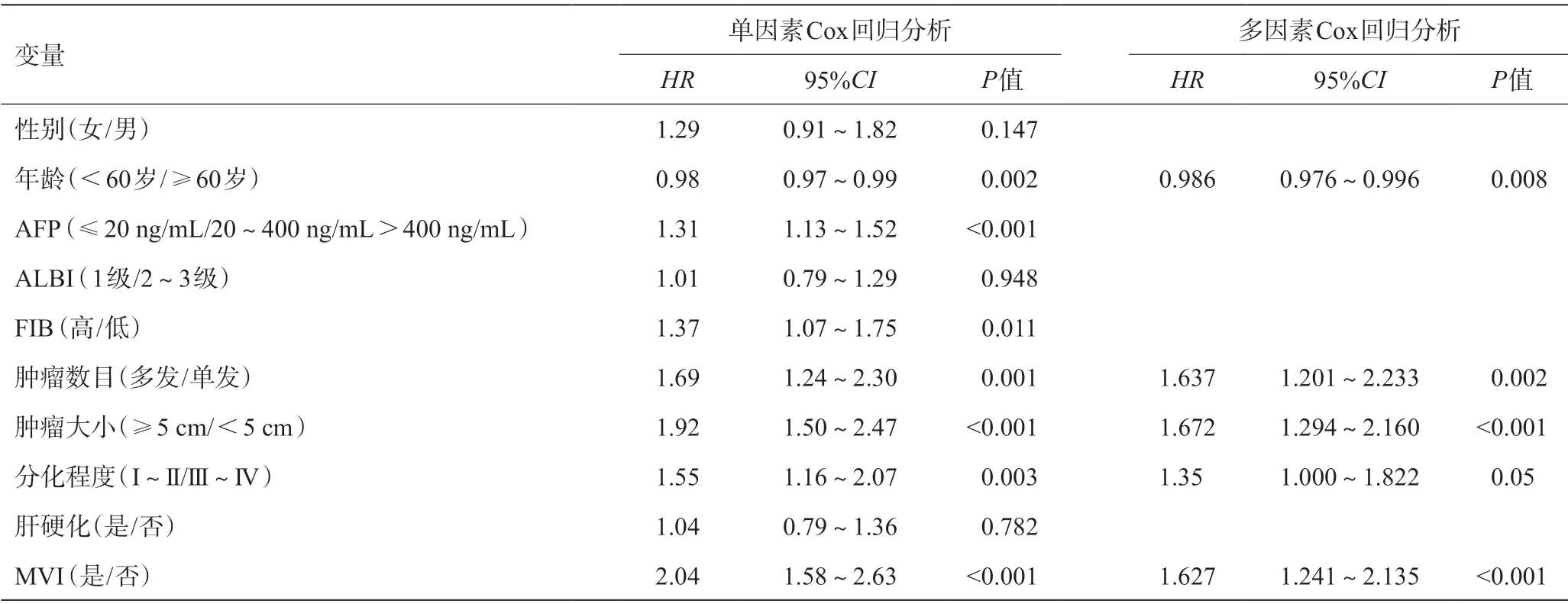
表4 影响RFS的单因素和多因素Cox回归分析
3 讨论
MVI是反映HCC侵袭特性的重要表现之一,是肿瘤细胞经瘤周血管扩散的早期迹象,是肝内肿瘤扩散的关键机制。MVI被广泛认为是HCC行根治性肝切除或肝移植早期复发和预后不良的病理现象,甚至有报道认为,MVI是比米兰分期标准更敏感的预测移植和手术切除后肿瘤复发和存活的指标[4-7,12]。亦有报道,MVI阳性的HCC患者肿瘤复发时间短,总体生存率差,且再次接受手术的机会较少[13]。本研究分析显示,MVI是影响HCC患者预后的独立危险因素(P<0.05)。
既往研究证实,血清纤维蛋白原(FIB)水平升高与HCC患者预后不良独立相关[8–10],本研究数据分析提示FIB是影响HCC患者的RFS危险因素(P<0.05),FIB与RFS呈负相关,低FIB组RFS优于高FIB组(P<0.05)。虽然本研究中Log-rank检验显示高、低FIB组患者OS无统计学差异(P=0.14),但从图2A可以看出,从术后30个月起,随术后时间延长两组间OS的差异有变为更明显的趋势,因此本文中两组患者的OS无差异可能与我们随访时间不够长有关。同时本中心对于术后复发患者往往及时予综合治疗(二次手术、消融、介入或系统治疗等),这可能也会影响两组患者的近期OS的差异。Zhu等[14]证明血浆FIB水平升高与瘤栓形成存在相关性;Ye等[15]报道,术前血浆FIB水平升高与肝门部胆管癌(hilar cholangiocarcinoma,HC)血管侵犯有关,可能是HC患者预后不良的独立因素;胡月雷等[16]单因素分析发现FIB与单发HCC患者MVI相关(OR=3.483,95%CI1.687~7.190,P=0.001);梁志银等[17]多因素分析发现FIB是影响MVI发生的独立危险因素之一(OR=1.610,95%CI1.081~2.400,P=0.03)。我们的研究证实术前FIB水平与MVI发生呈正相关,高FIB组中MVI阳性率为64.0%,大于低FIB组47.0%(P<0.01)。FIB在全身炎症反应和肿瘤发生中起重要作用[18],其可以促进癌细胞与血小板的黏附,导致在癌细胞周围形成血小板聚集,这可能会阻止免疫攻击[19]。高水平的血清FIB可能与肿瘤组织中FIB沉积增加有关,并作为肿瘤细胞黏附或迁移的细胞外基质,这可能导致肿瘤转移,促进肿瘤新生血管和血管生成,增强黏附和侵袭,并在癌症进展中发挥重要作用[20-21]。FIB作为肿瘤和宿主细胞之间的桥梁因子,增强肿瘤细胞栓子在靶器官血管中的内皮黏附[22]。因此FIB可能促进MVI的发生。
研究表明,术后辅助TACE可改善HCC根治术后MVI阳性患者的OS和RFS[23]。若能提前了解HCC诊断时的MVI状态,并予相关辅助治疗后再行手术或许能改善预后,因此通过术前预测MVI的发生风险从而指导临床决策是可行的方法之一[6]。虽然目前MVI仍只能通过切除或肝移植手术标本的组织病理学来确诊,在进行任何侵入性治疗之前,没有明确的影像学检查或血清标志物来确定MVI。出于这个原因,未来的研究应该集中在预测MVI血清标志物或影像学检查的开发上,以准确预测患者MVI状态,用来帮助临床医师确定治疗计划。
本研究尚有以下不足之处:(1)此次为单中心回顾性研究,研究结果有待于多中心前瞻性数据进行验证;(2)研究纳入的样本量较少,随访时间偏短。
综上,本研究分析发现,术前FIB水平与MVI发生呈正相关,是影响HCC患者RFS的危险因素,FIB与HCC根治性切除术后的RFS呈负相关。术前FIB未来是否能成为MVI相关血清标志物之一,尚需多中心大样本数据进行前瞻性研究来进一步验证。

