蒙药乌日格斯图-阿日查(刺柏叶)的质量标准提升
袁小红 庞克坚 唐辉 张虹 管辉 魏沣 唐萍
中圖分类号 R282;R917 文献标志码 A 文章编号 1001-0408(2021)16-1949-07
DOI 10.6039/j.issn.1001-0408.2021.16.06
摘 要 目的:为完善蒙药乌日格斯图-阿日查(刺柏叶)的质量标准提供科学依据。方法:以不同采集地的10批乌日格斯图-阿日查药材为样品,对其进行性状观察和显微鉴别;采用薄层色谱法(TLC)对样品中的异槲皮苷、槲皮苷、穗花杉双黄酮、竹柏双黄酮A和扁柏双黄酮进行定性鉴别;参照2020年版《中国药典》(四部)通则中的相关方法测定样品中总灰分、酸不溶性灰分、醇溶性浸出物、重金属的含量;建立高效液相色谱法(HPLC)测定样品中上述5种成分的含量。结果:乌日格斯图-阿日查粉末呈绿色或黄绿色,管胞呈多角形,紧密排列成纵行;气孔为不等式;表皮细胞为近长方形;厚壁细胞呈类长方形,壁连珠状增厚。TLC结果显示,供试品在与上述5种成分对照品色谱相应位置上显相同颜色的斑点。10批样品中总灰分、酸不溶性灰分、醇溶性浸出物含量分别为7.37%~11.18%、0.75%~2.98%、16.55%~26.42%,平均值分别为8.51%、1.27%、22.35%;铅、砷、镉、汞、铜含量分别为2.00~5.44、0.65~1.65、0.044~0.100、0.034~0.160、4.59~6.79 mg/kg,平均值分别为3.73、0.97、0.078、0.061、5.23 mg/kg。异槲皮苷、槲皮苷、穗花杉双黄酮、竹柏双黄酮A、扁柏双黄酮检测质量浓度的线性范围分别为4.98~20.02、49.99~199.96、19.94~99.96、9.99~40.00、20.20~159.98 μg/mL(r均大于0.999 7);精密度、重复性、稳定性(24 h)试验的RSD均小于3.00%(n=6);平均加样回收率为100.62%~102.96%,RSD为1.21%~1.88%(n=6)。10批样品中上述5种成分的平均含量分别为0.089~0.379、1.379~4.250、1.077~2.026、0.162~0.423、0.016 9~0.117 0 mg/g。结论:本研究建立了蒙药乌日格斯图-阿日查药材的定性、定量分析方法,暂规定其总灰分不得超过10.22%,酸不溶性灰分不得超过1.53%,醇溶性浸出物不得低于17.88%,重金属铅不得超过5 mg/kg,砷不得超过2 mg/kg,镉不得超过0.3 mg/kg,汞不得超过0.2 mg/kg,铜不得超过20 mg/kg。
关键词 蒙药;乌日格斯图-阿日查;质量标准;薄层色谱法;高效液相色谱法;槲皮苷;穗花杉双黄酮;竹柏双黄酮A
Improvement of Quality Standard for Mongolian Medicine Juniperus rigida
YUAN Xiaohong1,PANG Kejian2,TANG Hui1,ZHANG Hong3,GUAN Hui1,WEI Feng1,TANG Ping1(1. School of Pharmacy/Key Laboratory of Xinjiang Phytomedicine Resource and Utilization, the Ministry of Education, Shihezi University, Xinjiang Shihezi 832000, China; 2. Hetian Uygur Pharmaceutical Co., Ltd., Xinjiang Hetian 848200, China; 3. Dept. of Pharmacy, Mongolian Medical Hospital of Bortala Mongolian Autonomous Prefecture, Xinjiang Bole 833400, China)
ABSTRACT OBJECTIVE: To provide scientific evidence for improving the quality standard of Mongolian medicine Juniperus rigida. METHODS: Totally 10 batches of J. rigida from different places were taken as samples to observe their characters and identify them by microscope; TLC method was adopted to qualitatively identify isoquercitrin, quercitrin, amentoflavone, podocarpusflavone A and hinokiflavone; the contents of total ash, acid-insoluble ash, ethanol-soluble extract and heavy metals were determined by related method stated in 2020 edition of Chinese Pharmacopeia (part Ⅳ). The contents of above 5 components in samples were determined by HPLC. RESULTS: The powder of J. rigida was green or yellowish green, polygonal tracheids, closely arranged in longitudinal with unequal stomatal; epidermal cells were nearly rectangular; sclerenchyma cells were quasi rectangular and the wall beadedly thickening. Results of TLC showed that the spots of the same color were found in the corresponding positions of chromatogram for test sample and substance control. The contents of total ash, acid-insoluble ash and ethanol-soluble extract in 10 batches of samples were 7.37%-11.18%, 0.75%-2.98%, 16.55%-26.42%, respectively; average contents were 8.51%, 1.27%, 22.35%. The contents of lead, arsenic, cadmium, mercury and copper were 2.00-5.44, 0.65-1.65, 0.044-0.100, 0.034-0.160, 4.59-6.79 mg/kg, respectively; average contents were 3.73, 0.97, 0.078, 0.061, 5.23 mg/kg. The linear ranges of isoquercitrin, quercitrin, amentoflavone, podocarpus- flavone A and hinokiflavone were 4.98-20.02, 49.99-199.96, 19.94-99.96, 9.99-40.00, 20.20-159.98 μg/mL (all r>0.999 7); RSDs of precision, repeatability and stability (24 h) tests were all less than 3.00% (n=6); the average recoveries were 100.62%-102.96%,RSDs were 1.21%-1.88% (n=6). Average contents of the above-mentioned 5 compounds in 10 batches of samples were 0.089-0.379, 1.379-4.250, 1.077-2.026, 0.162-0.423, 0.016 9-0.117 0 mg/g, respectively. CONCLUSIONS: The qualitative and quantitative analysis methods of Mongolian medicine J. rigida are established. It is preliminarily proposed that the total ash content shall not exceed 10.22%, the acid-insoluble ash content shall not exceed 1.53%, ethanol-soluble extract content shall not be less than 17.88%, heavy metal lead should not exceed 5 mg/kg, arsenic should not exceed 2 mg/kg, cadmium should not exceed 0.3 mg/kg, mercury should not exceed 0.2 mg/kg, copper should not exceed 20 mg/kg.
KEYWORDS Mongolian medicine; Juniperus rigida; Quality standard; TLC;HPLC;Quercitrin;Amentoflavone; Podocarpusflavone A
乌日格斯图-阿日查(刺柏叶)为柏科植物杜松Juniperus rigida Sieb. et Zucc.的干燥嫩枝叶,又名崩松、棒儿松,为蒙医临床常用药材,分布于我国黑龙江、吉林、新疆、内蒙古、甘肃及宁夏等省区,常生于比较干燥的地方,药用资源丰富[1-2]。据蒙医药有关书籍记载,乌日格斯图-阿日查具有清肾热、利尿、燥“协日乌素”、愈伤止血等功效[3-4]。
乌日格斯图-阿日查作为蒙医中的临床常用药材,是经典名方“五味甘露浴”“清肾热十味散”“吉祥安神丸”的主要成分之一,在肾病或泌尿系统疾病、妇科疾病、瘟病等方面应用比较广泛[5]。乌日格斯图-阿日查中含有黄酮类、萜类、木脂素类和香豆素类等化合物[6-9]。有研究表明,黄酮类成分具有很强的抗炎活性[10],其中双黄酮具有很强的抗炎、抗病毒活性[11]。有研究证实,乌日格斯图-阿日查中的异槲皮苷、槲皮苷、穗花杉双黄酮、竹柏双黄酮A、扁柏双黄酮等黄酮类成分的药理作用与该药清肾热、燥“协日乌素”等药效相一致[2,6,8,10-11],所以很有必要基于上述5种成分建立乌日格斯图-阿日查的质量标准。
乌日格斯图-阿日查收载于1998年版的《卫生部药品标准·蒙药分册》中,但此标准仅收录了该药材的外观性状、性味和功能主治等,缺乏其他鉴别项,也没有基于药效的化学成分含量测定。目前,有关乌日格斯图-阿日查活性成分的含量测定已有部分文献报道:崔鸿江等[12]采用高效液相色谱法(HPLC)对乌日格斯图-阿日查中主要活性成分之一的槲皮苷進行了含量测定研究。但该方法仅对单一成分进行了定量分析,难以全面评价药材的质量。
为了更好地控制蒙药乌日格斯图-阿日查的质量,本研究在《卫生部药品标准·蒙药分册》基础上,对药材进行了显微鉴别,对其中异槲皮苷、槲皮苷、穗花杉双黄酮、竹柏双黄酮A、扁柏双黄酮等5种成分进行薄层色谱(TLC)定性鉴别,同时增加了总灰分、酸不溶性灰分、醇溶性浸出物、重金属等检查项,并建立了上述5种成分含量测定的HPLC法,旨在为完善蒙药乌日格斯图-阿日查的质量标准提供科学依据。
1 材料
1.1 主要仪器
Primo Star型数码生物显微镜购自德国ZEISS公司;YOKO-ZS型TLC成像仪购自武汉药科新技术开发有限公司;e2695型HPLC仪[含2998型光电二极管阵列(PDA)检测器]购自美国Waters公司;KH-300DE型数控超声波清洗器购自昆山禾创超声仪器有限公司;BT125D型十万分之一分析天平购自德国Sartorius公司;iCAP 630型电感耦合等离子体质谱(ICP-MS)仪购自美国Thermo Fisher Scientific公司;ETHOS UP型微波消解仪购自意大利Milestone公司;XGY-1011A型原子荧光光度计购自廊坊开元高技术开发公司。
1.2 主要药品与试剂
异槲皮苷(批号P25J9F65872,纯度≥98%)、槲皮苷(批号Z15J11S115885,纯度≥98%)、穗花杉双黄酮(批号Y24J7K16726,纯度≥98%)、竹柏双黄酮A(批号Y09J8C28349,纯度≥98%)、扁柏双黄酮(批号R11A9F54295,纯度≥98%)对照品均购自上海源叶生物科技有限公司;G型硅胶板(批号20191109,规格100 mm×50 mm)购自青岛海洋化工有限公司;甲苯、硝酸银、甲酸乙酯、乙酸乙酯、甲酸、甲醇均购自天津市富宇精细化工有限公司,均为分析纯;乙腈购自美国Thermo Fisher Scientific公司,为色谱纯;铅、镉、砷、汞、铜标准溶液均购自国家有色金属及电子材料分析测试中心,质量浓度均为1 000 mg/L;其余试剂均为分析纯或实验室常用规格,水为纯净水。
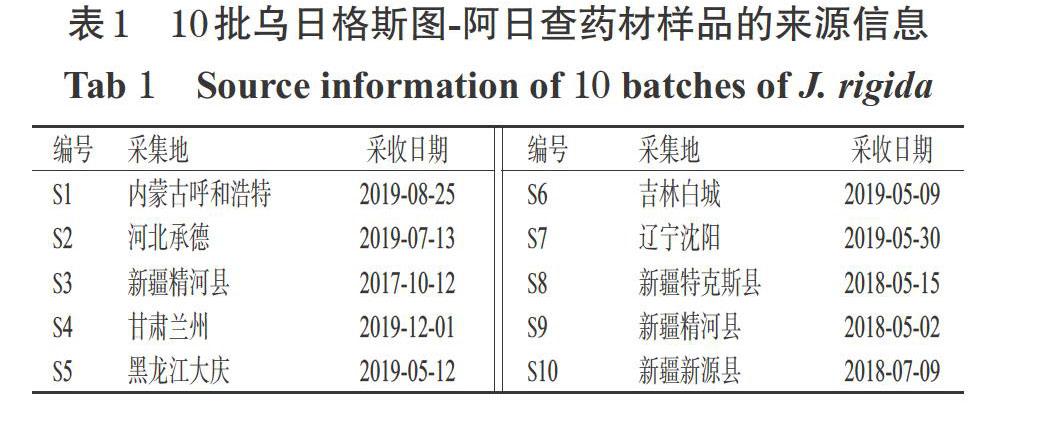
10批乌日格斯图-阿日查药材(编号S1~S10)由本课题组自行采集或购买所得,经石河子大学楚生辉教授鉴定均为柏科植物杜松J. rigida Sieb. et Zucc.的干燥嫩枝叶,其具体来源信息详见表1。
2 方法与结果
2.1 溶液的制备
2.1.1 对照品溶液 分别取异槲皮苷、槲皮苷、穗花杉双黄酮、竹柏双黄酮A、扁柏双黄酮对照品各适量,精密称定,加入甲醇溶解、稀释,混匀,制成质量浓度分别为0.402、0.856、0.608、0.292、0.808 mg/mL的单一对照品贮备液。分别取异槲皮苷对照品贮备液0.155 mL、槲皮苷对照品贮备液0.730 mL、穗花杉双黄酮对照品贮备液0.493 mL,竹柏双黄酮A对照品贮备液0.495 mL,扁柏双黄酮对照品贮备液0.198 mL,置于同一5 mL量瓶中,用甲醇稀释至刻度,混匀,制成质量浓度分别为12.46、124.98、59.95、28.91、31.99 μg/mL的混合对照品溶液,备用。
2.1.2 供试品溶液 取样品粉末(过30目筛)0.5 g,精密称定,置于100 mL圆底烧瓶中,加入甲醇20 mL,称定质量,加热回流处理1 h,取出,放冷至室温,再次称定质量,用甲醇补足减失的质量,混匀,过0.45 μm微孔滤膜,取续滤液,即得供试品溶液。
2.1.3 阴性对照溶液 取甲醇20 mL,置于100 mL圆底烧瓶中,除不放入药材样品外,其余按“2.1.2”项下方法操作,滤过,即得阴性对照溶液。
2.2 性状
乌日格斯图-阿日查药材,气芳香,有三叶轮生或两叶对生。其叶呈三棱针形,长约0.3~1.4 cm,宽约1 mm,表面淡黄绿色,腹面有一条深槽,背面有一明显的纵脊,先端尖锐,叶基有关节。其枝长短不等,质韧,易折断,直径1~2 mm,叶脱落痕迹明显可见,外表呈浅棕色或褐色,且粗糙、有纵皱,断面呈白色,详见图1。
2.3 显微鉴别
2.3.1 粉末显微鉴别 样品粉末(过30目筛)为绿色或黄绿色。显微镜下,表皮细胞呈近长方形;管胞呈多角形,壁木化,紧密排列成纵行,内可见细长螺纹管胞;厚壁细胞为类长方形,钝圆,纹孔多,壁呈连珠状增厚;气孔形状特异,为不等式,副卫细胞2个,详见图2。
2.3.2 茎横切面显微鉴别 样品茎横切呈正方形,对角处向内凹陷,周皮多脱落。显微镜下,表皮部为单列细胞,排列紧密整齐,壁稍厚且呈木栓化;皮层宽广,约占横切面的1/2,凹陷处皮层极狭窄;韧皮部有数列细胞,较小,排列整齐,射线宽1~2列细胞;木质部管胞呈方形,大小均匀,木薄壁细胞排列较宽,射线宽1~2列细胞;中央髓部狭小,略呈线型,详见图3。
2.3.3 叶横切面显微鉴别 显微镜下,上/下表皮均为1列横向延长的细胞,下表皮细胞稍圆,外被角质层;栅栏细胞呈长方形,2~3列,与海绵组织分化不明显;维管束为外韧型,导管木化;下表皮中部微向内凹,紧接凹陷部分有一圆形大油室,周围分泌细胞排列成环,详见图3。
2.3.4 TLC鉴别 按照2020年版《中国药典》(四部)通则“0502 薄层色谱法”相关要求[13]进行操作,分别吸取“2.1”项下5种成分的对照品贮备液各5 μL和供试品溶液10 μL,点于同一G型硅胶板上,以乙酸乙酯-甲醇-水-甲酸(100 ∶ 17 ∶ 13 ∶ 5,V/V/V/V)为展开剂,展至约3 cm,取出,晾干,再以甲苯-甲酸乙酯-甲酸(5.5 ∶ 4.5 ∶ 1,V/V/V)为展开剂,展开至前沿线,取出,晾干,喷以1%三氯化铝试液,105 ℃加热5 min,置紫外光灯(365 nm)下检视。结果,10批供试品在与异槲皮苷、槲皮苷、穗花杉双黄酮、竹柏双黄酮A、扁柏双黄酮对照品色谱相应位置上显相同颜色的斑点,详见图4。
2.4 检查
2.4.1 总灰分、酸不溶性灰分测定 按照2020年版《中国药典》(四部)通则“2302灰分测定法”相关要求[13]进行操作,测定10批乌日格斯图-阿日查药材的总灰分、酸不溶性灰分,每批样品平行测定3次。结果,10批样品的总灰分含量为7.37%~11.18%,平均值为8.51%;酸不溶性灰分含量为0.75%~2.98%,平均值为1.27%,详见表2。以平均值上浮约20%为标准[14-16],暂定乌日格斯图-阿日查药材中总灰分不得超过10.22%,酸不溶性灰分不得超过1.53%。
2.4.2 浸出物含量测定 按照2020年版《中国药典》(四部)通则“2201浸出物测定法”相关要求[13]进行操作,以50%乙醇为溶剂,采用热浸法进行提取,测定10批乌日格斯图-阿日查药材中醇溶性浸出物的含量,每批样品平行测定3次。结果,10批样品的醇溶性浸出物含量为16.55%~26.42%,平均值为22.35%,详见表2。以平均值下浮约20%为标准[14-16],暂定乌日格斯图-阿日查药材中醇溶性浸出物不得低于17.88%。
2.4.3 重金属元素测定 按照2020年版《中国药典》(四部)通则“2321铅、镉、砷、汞、铜测定法”项下“原子吸收分光光度法”和“ICP-MS法”相关要求[13]进行操作,测定10批乌日格斯图-阿日查药材中重金属铅、镉、砷、汞、铜的含量。取样品粉末(过30目筛)约0.25 g,精密称定,置微波消解罐中,加适量硝酸,于200 ℃下加热至样品完全溶解后,加入过氧化氢2 mL预消解,再置于微波消解仪内消解(消解程序见表3)。消解结束后,消解液用水稀释并定容至25 mL,摇匀,即得供试品溶液。同法制备不含样品的空白溶液。先用原子荧光光度计测定汞含量,随后用ICP-MS仪测定其他元素含量,每批样品平行测定3次。原子荧光分光光度计工作条件参数如下:负高压为300 V,总电流为30 mA,载气流速为400 mL/min,屏蔽气流速为1 000 mL/min,原子化气高度为10 mm,读数时间为10 s,延迟时间为1 s。ICP-MS仪工作条件参数如下:射频功率为1 300 W,等离子体流速为15 L/min,辅助气流速为0.70 L/min,载气流速为0.86 L/min,雾室温度为2 ℃,采样深度为10 mm,采样锥孔直径为1.0 mm,截取锥孔直径为0.45 mm。本方法的方法学考察结果均符合2020年版《中国药典》(四部)的相关要求[13]。
结果,10批样品中铅含量为2.00~5.44 mg/kg,平均值为3.73 mg/kg;砷含量为0.65~1.65 mg/kg,平均值为0.97 mg/kg;镉含量为0.044~0.100 mg/kg,平均值为0.078 mg/kg;汞含量为0.034~0.160 mg/kg,平均值为0.061 mg/kg;铜含量为4.59~6.79 mg/kg,平均值为5.23 mg/kg,详见表4。参考文献[17-19]相关规定,暂定乌日格斯图-阿日查药材中铅不得超过5 mg/kg,砷不得超过2 mg/kg,镉不得超过0.3 mg/kg,汞不得超过0.2 mg/kg,铜不得超过20 mg/kg。
2.5 5种黄酮类成分的含量测定
按照2020年版《中国药典》(四部)通则“0521高效液相色谱法”相关要求[13]进行操作。
2.5.1 色谱条件 以ACE C18 PFP(250 mm×4.6 mm,5 μm)为色谱柱,以乙腈(A)-0.1%甲酸溶液(B)为流动相进行梯度洗脱(0~5 min,15%A→20%A;5~15 min,20%A→25%A;15~20 min,25%A→40%A;20~30 min,40%A→65%A;30~40 min,65%A→80%A);流速为1 mL/min;检测波长为337 nm;柱温为30 ℃;进样量为5 μL。
2.5.2 系統适用性试验 取“2.1”项下混合对照品溶液、供试品溶液、阴性对照溶液各5 μL,按“2.5.1”项下色谱条件进样测定,记录色谱图。结果,在该色谱条件下,理论板数按槲皮苷计均不低于20 000,各色谱峰与相邻色谱峰的分离度均大于1.5,各成分的测定不受其他成分的干扰,详见图5。
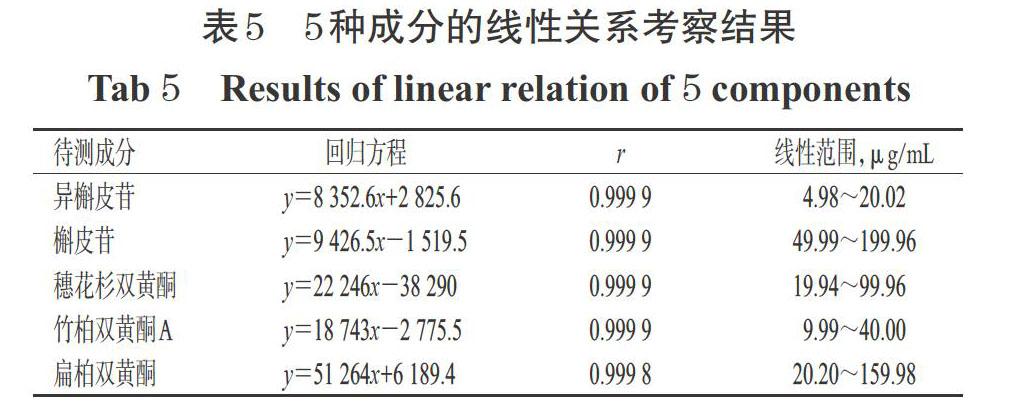
2.5.3 线性关系考察 取“2.1.1”项下各单一对照品贮备液,用甲醇稀释成异槲皮苷质量浓度分别为4.98、7.48、9.97、12.46、14.95、20.02 μg/mL,槲皮苷质量浓度分别为49.99、74.99、99.98、124.98、149.97、199.96 μg/mL,穗花杉双黄酮质量浓度分别为19.94、29.91、40.01、59.95、80.01、99.96 μg/mL,竹柏双黄酮A质量浓度分别为9.99、15.01、19.97、25.00、30.02、40.00 μg/mL,扁柏双黄酮质量浓度分别为20.20、39.60、59.79、79.99、119.58、159.98 μg/mL的系列混合对照品溶液,按照“2.5.1”项下色谱条件进样测定,记录峰面积。以5种成分的质量浓度(x)为横坐标、峰面积(y)为纵坐标进行线性回归,结果见表5。
2.5.4 精密度试验 精密吸取“2.1.1”项下混合对照品溶液5 μL,按照“2.5.1”项下色谱条件连续进样6次,记录峰面积。结果,异槲皮苷、槲皮苷、穗花杉双黄酮、竹柏双黄酮A、扁柏双黄酮峰面积的RSD分别为0.65%、0.81%、1.27%、1.39%、0.30%(n=6),表明仪器精密度良好。
2.5.5 重复性试验 分别称取同一批样品粉末(过30目筛,编号S6)6份,每份0.5 g,精密称定,置于100 mL圆底烧瓶中,按照“2.1.2”项下方法制备供试品溶液,再按照“2.5.1”项下色谱条件进样测定,记录峰面积并代入回归方程计算含量。结果,样品中异槲皮苷、槲皮苷、穗花杉双黄酮、竹柏双黄酮A、扁柏双黄酮含量的RSD分别为1.08%、0.62%、0.60%、0.43%、0.96%(n=6),表明本方法重复性良好。
2.5.6 稳定性试验 取同一批供试品溶液(编号S6),分别于室温下放置0、2、4、8、12、24 h时按照“2.5.1”项下色谱条件进样测定,记录峰面积。结果,供试品溶液中异槲皮苷、槲皮苷、穗花杉双黄酮、竹柏双黄酮A、扁柏双黄酮峰面积的RSD分别为2.62%、1.92%、2.22%、2.62%、1.92%(n=6),表明供试品溶液在室温下放置24 h内稳定。
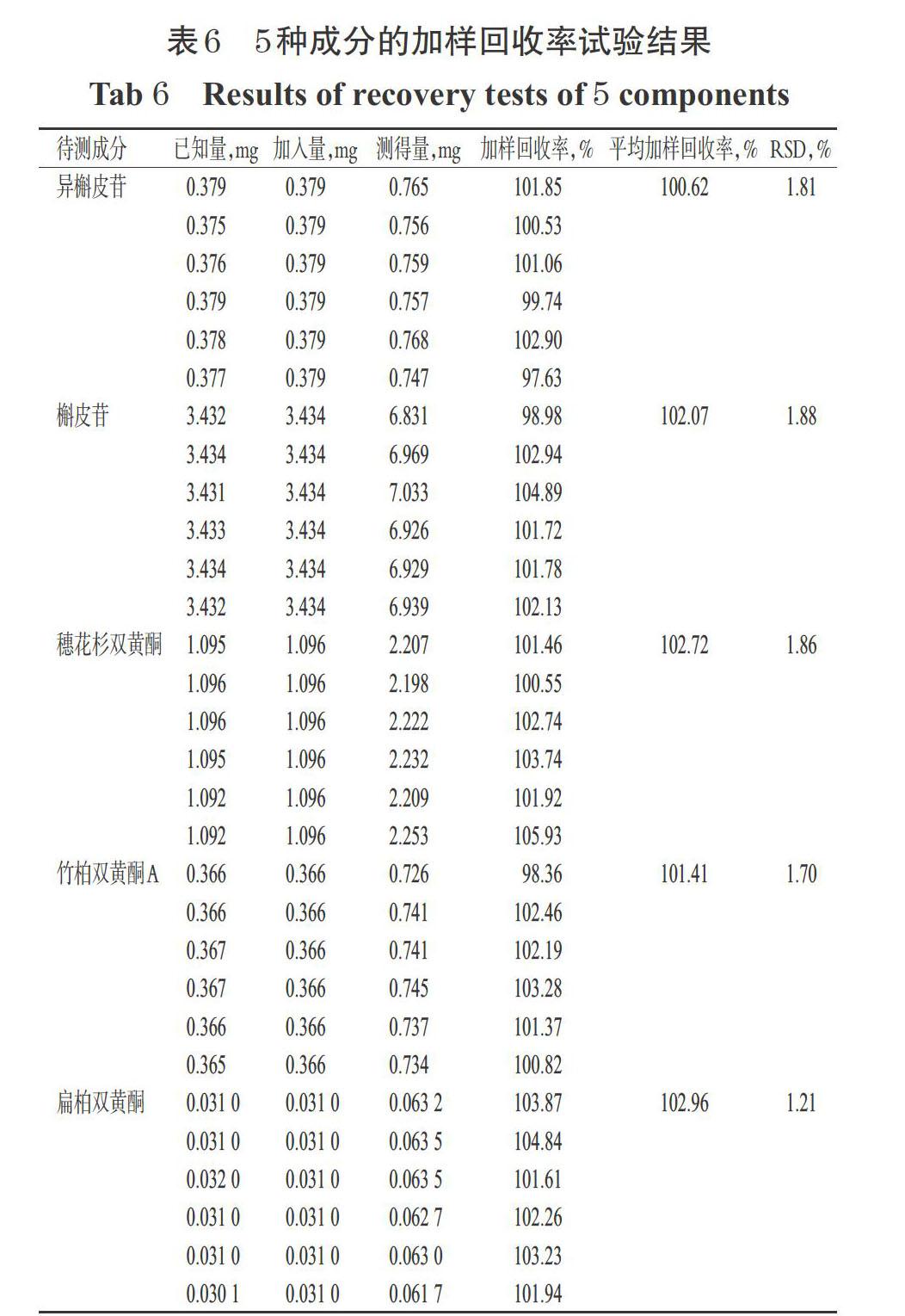
2.5.7 加样回收率试验 称取已知含量的样品粉末(过30目筛,编号S6)适量,共6份,精密称定并加入与相应成分等质量的对照品溶液,按照“2.1.2”项下方法制备供试品溶液,再按照“2.5.1”项下色谱条件进样测定,记录峰面积并计算加样回收率。结果,异槲皮苷、槲皮苷、穗花杉双黄酮、竹柏双黄酮A、扁柏双黄酮的平均加样回收率为100.62%~102.96%,RSD为1.21%~1.88%(n=6),表明本方法准确度良好,详见表6。
2.5.8 样品含量测定 取10批样品各0.5 g,按照“2.1.2”项下方法制备供试品溶液,再按照“2.5.1”项下色谱条件进样测定,记录峰面积并代入回归方程计算5种成分的含量,每批样品平行测定3次,取平均值。结果,10批样品中异槲皮苷、槲皮苷、穗花杉双黄酮、竹柏双黄酮A、扁柏双黄酮的平均含量分别为0.089~0.379、1.379~4.250、1.077~2.026、0.162~0.423、0.016 9~0.117 0 mg/g,详见表7。
3 讨论
3.1 提取条件的选择
在供试品的提取中,笔者对提取溶剂(甲醇、50%甲醇、乙醇、50%乙醇)、料液比(1 ∶ 40、1 ∶ 20、1 ∶ 10、1 ∶ 5, g/mL)、提取时间(0.5、1、2、3 h)等进行了筛选,综合考虑所得色谱峰的峰面积、分离度、峰形及操作方法的简便性等因素,最终确定以甲醇为提取溶剂,以料液比1 ∶ 40(g/mL)、加热回流时间1 h作为提取条件。
3.2 TLC展开剂的选择
本实验前期选用不同展开系统对不同产地乌日格斯图-阿日查药材进行了TLC鉴别,其中一次展开剂乙酸乙酯-甲醇-水(100 ∶ 17 ∶ 13,V/V/V)和乙酸乙酯-甲醇-水-甲酸(100 ∶ 17 ∶ 13 ∶ 5,V/V/V/V)的分离结果显示,在展开剂中加入甲酸后斑点拖尾情况有所改善,故一次展开剂选用乙酸乙酯-甲醇-水-甲酸(100 ∶ 17 ∶ 13 ∶ 5,V/V/V/V)。随后,笔者考察了一次展开剂的展开高度(2、2.5、3 cm),结果显示,当展开高度为3 cm时,各斑点能较好地分离,故选择一次展开剂的展开高度为3 cm。最后,笔者考察了二次展开剂甲苯-甲酸乙酯-甲酸(4.5 ∶ 4.5 ∶ 1,V/V/V)、甲苯-乙酸乙酯-甲酸(5 ∶ 5 ∶ 1,V/V/V)、甲苯-甲酸乙酯-甲酸(4.5 ∶ 5.5 ∶ 1,V/V/V)的展开效果,结果显示,以甲苯-甲酸乙酯-甲酸(5.5 ∶ 4.5 ∶ 1,V/V/V)为二次展开剂时各斑点的分离效果较好,故以其为二次展开剂。
3.3 检测波长的选择
笔者采用PDA检测器在190~400 nm波长范围内对混合对照品溶液和供试品溶液进行扫描,结合2020年版《中国药典》(一部)中各成分的出峰时间[20],并在比较供试品溶液在337、328 nm波长下的色谱图数据后发现,在337 nm波长下,所得色谱图的基线均平稳,异槲皮苷、槲皮苷、穗花杉双黄酮、竹柏双黄酮A、扁柏双黄酮均有较强吸收,故选择337 nm为检测波长。
3.4 流动相的选择
在选择流动相时,笔者以各色谱峰分离度、出峰时间、峰形为评价指标,比较了甲醇-水、甲醇-0.1%甲酸溶液、甲醇-0.1%磷酸溶液、乙腈-0.1%磷酸溶液、乙腈-0.1%甲酸溶液的分離效果。结果显示,以甲醇-水为流动相进行梯度洗脱时,柱压较高,峰形较差;以乙腈-0.1%磷酸溶液为流动相进行梯度洗脱时,峰形仍较差;以乙腈-0.1%甲酸溶液进行梯度洗脱时,柱压较低,各色谱峰分离良好且基线平稳,故选用乙腈-0.1%甲酸溶液为梯度洗脱流动相。
3.5 含量测定
本研究通过含量测定发现,10批样品中异槲皮苷、槲皮苷、穗花杉双黄酮、竹柏双黄酮A、扁柏双黄酮的平均含量分别为0.089~0.379、1.379~4.250、1.077~2.026、0.162~0.423、0.016 9~0.117 0 mg/g。其中,新疆伊犁哈萨克自治州不同产地乌日格斯图-阿日查药材(编号S8、S10)中异槲皮苷含量差异较大,虽然在同省区,但不同县之间气候温度环境存在差异,故药材成分含量还可能与其不同的生长环境等因素有关。
综上所述,本研究建立了蒙药乌日格斯图-阿日查药材的定性、定量分析方法,暂规定其总灰分不得超过10.22%,酸不溶性灰分不得超过1.53%,醇溶性浸出物不得低于17.88%,重金属铅不得超过5 mg/kg,砷不得超过2 mg/kg,镉不得超过0.3 mg/kg,汞不得超过0.2 mg/kg,铜不得超过20 mg/kg。由于不同产地的乌日格斯图-阿日查中异槲皮苷、槲皮苷、穗花杉双黄酮、竹柏双黄酮A、扁柏双黄酮等5种黄酮类成分的含量差异较大,故本研究未作含量规定。
参考文献
[ 1 ] 柳白乙拉.蒙药正典[M].北京:民族出版社,2006:113.
[ 2 ] 中国科学院中国植物志编辑委员会.中国植物志:第7卷[M].北京:科学出版社,1978:379-380.
[ 3 ] 卫生部药典委员会.中华人民共和国卫生部药品标准:蒙药分册[S].呼和浩特:内蒙古科学技术出版社,1998:23,169.
[ 4 ] 国家中医药管理局《中华本草》编委会.中华本草:蒙药卷[M].上海:上海科学技术出版社,2004:255.
[ 5 ] 包音胡.探讨蒙医五味甘露药浴的临床应用[J].世界最新医学信息文摘,2018,18(12):152,159.
[ 6 ] MASHIMA T,OKIGAWA M,KAWANO N. On the bisflavones in the leaves of Juniperus rigida Sieb. et Zucc.[J]. J Pharm Soc Jpn,1970,90(4):512.
[ 7 ] 武雪,宋平顺,赵建邦.两个不同产区藏药刺柏叶中挥发油成分的GC-MS分析[J].中国药师,2015,18(5):778- 781.
[ 8 ] JEONG E J,SEO H,YANG H,et al. Anti-inflammatory phenolics isolated from Juniperus rigida leaves and twigs in lipopolysaccharide-stimulated RAW264.7 macrophage cells[J]. J Enzyme Inhib Med Chem,2012,27(6):875- 879.
[ 9 ] WOO K W,CHOI S U,PARK J C,et al. A new lignan glycoside from Juniperus rigida[J]. Arch Pharmacal Res,2011,34(12):2043-2049.
[10] 葉勇,覃妮,庾茜,等.壮药战骨总黄酮提取物经皮给药对大鼠/小鼠的抗炎、镇痛作用研究[J].中国药房,2018,29(15):2090-2094.
[11] MENEZES J C J M D S,DIEDERICH M F. Bioactivity of natural biflavonoids in metabolism-related disease and cancer therapies[J]. Pharmacol Res,2021,167:105525.
[12] 崔鸿江,巴德玛,林燕.蒙药材刺柏叶中槲皮苷的含量测定[J].天然产物研究与开发,2013,25(2):221-223.
[13] 国家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:59,61,114,232,234-236,480-483.
[14] 刘利琴,彭潇,马雪,等.贵州产红孩儿药材的质量标准提升研究[J].中国药房,2020,31(12):1458-1462.
[15] 陈华林,徐俊,蔡晓洋,等.藏药奥色折布的质量标准研究[J].中国药房,2020,31(21):2609-2614.
[16] 吴依静,喜杰,钟国跃,等.蒙药地梢瓜的质量标准研究[J].中国药房,2020,31(18):2230-2234.
[17] 孔繁越.中药材重金属限量标准和农残限量标准研究及标准制定相关建议[D].北京:北京中医药大学,2017.
[18] 刘兰,张勇仓,钟铧,等.原子吸收分光光度法测定藏药二十五味珊瑚丸中5种重金属含量[J].中国药房,2018,29(7):973-976.
[19] 对外贸易经济合作部.中华人民共和国外经贸行业标准:药用植物及制剂进出口绿色行业标准[J].中药研究与信息,2001,3(8):9-10.
[20] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:225.
(收稿日期:2021-04-02 修回日期:2021-07-14)
(编辑:邹丽娟)

