木脂素对映异构体研究进展
辛本松,赵 鹏,黄肖霄,宋少江
•综 述 •
木脂素对映异构体研究进展
辛本松,赵 鹏,黄肖霄,宋少江*
沈阳药科大学,辽宁 沈阳 110000
在自然界中,天然产物通常以光学纯的形式存在,但越来越多研究发现一些类型的化合物是以对映异构体混合物的形式存在。虽然这些对映体理化性质一致,但它们的药效与毒性并不完全相同,且手性可能是导致活性发生变化的关键。木脂素作为自然界中一种非常重要的二次代谢产物,已经在多种植物中被发现是以对映体混合物的形式存在。对已报道的以对映体混合物形式存在的木脂素进行总结归纳,综述这些对映体的拆分方法、生源途径、主要药理活性,为木脂素对映体的进一步研究和开发奠定理论基础。
木脂素;对映异构体;手性拆分;生合成途径;药理活性
互为镜像的2种构型的异构体称之为对映异构体。一对对映体的药理作用可能因手性的不同而存在差异,进入体内后也可能引起不良反应甚至是毒副作用,所以手性药物以外消旋体形式应用于临床具有很高的风险性。因此对以对映体混合物形式存在的化合物进行手性研究尤为重要[1]。
木脂素是植物界中分布广泛的一类代谢产物,结构中含有2个或多个C6C3特征结构单元,在不同植物的根、茎、叶、花和种子等部位均有发现。以往的研究者认为,天然产物由酶催化生成,多为光学纯化合物,但随着研究的深入,逐渐发现有些天然产物是以外消旋体的形式存在,包括一些木脂素。
木脂素不仅结构类型多样,其生物活性也十分广泛而显著,主要有抗肿瘤作用、神经保护作用、肝保护作用、抗氧化作用、抗艾滋病病毒(HIV)作用、抗菌作用等。本文拟归纳总结木脂素对映体的分布以及有关木脂素的生合成途径和药理活性,有助于更好地研究与开发木脂素类化合物的药用价值[2]。
1 化学结构
本文总结了已报道的以对映异构体混合物形式存在的木脂素结构类型,主要分为以下6种:(1)8--4′型新木脂素;(2)苯骈二氢呋喃型新木脂素;(3)四氢呋喃型木脂素;(4)双四氢呋喃型木脂素;(5)倍半木脂素和二倍木脂素;(6)其他类型。代表性结构母核见图1。
1.1 8-O-4′型新木脂素
2个C6C3结构单元C-8和C-4′通过醚键相连的化合物为8--4′型新木脂素,是氧新木脂素中最常见的一类天然产物。这类木脂素被报道以对映异构体形式存在的比例较高,本文整理汇总了36对8-O-4′型新木脂素对映异构体,其分布的科属见图2。
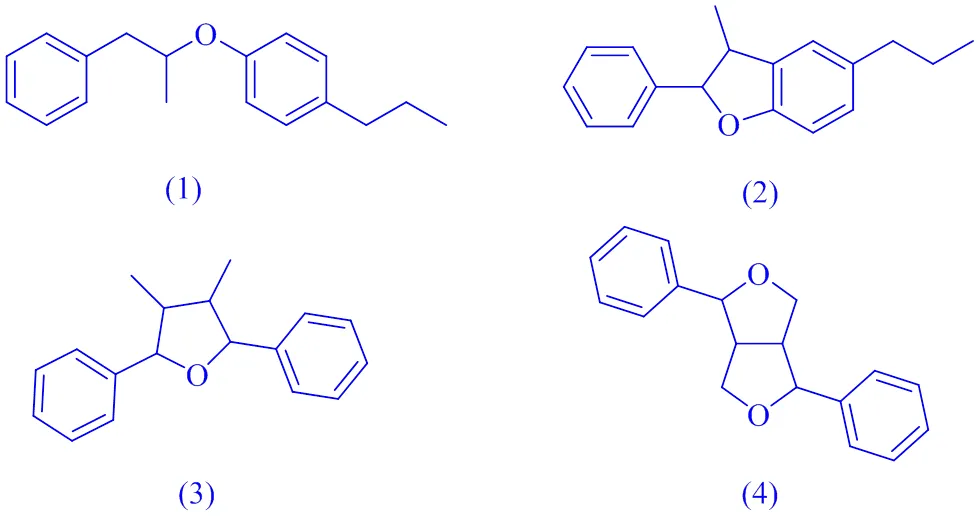
图1 木脂素对映体代表性结构类型及母核
由图2可见,8--4′型新木脂素对映异构体多在蔷薇科和苦木科中被发现,大约占总数58.0%。这表明苦木科和蔷薇科植物中的8--4′型新木脂素以对映体混合物存在的可能性很大,从该科植物分离8--4′型新木脂素时需注意化合物的电子圆二色谱(ECD)、旋光等光学性质。化合物具体来源及结构见表1和图3。
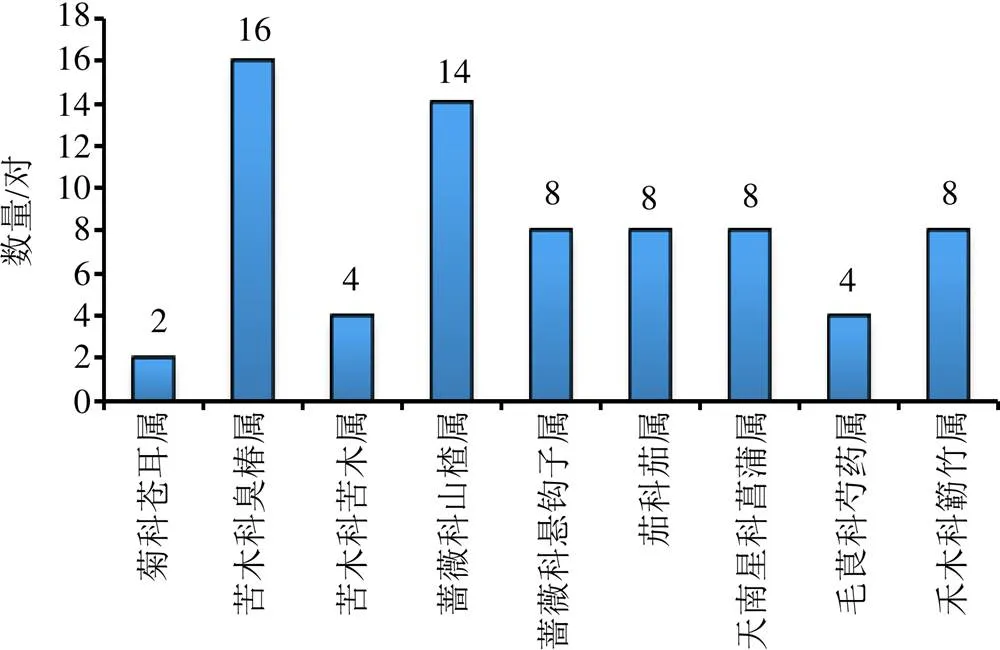
图2 8-O-4′型新木脂素对映异构体科属分布

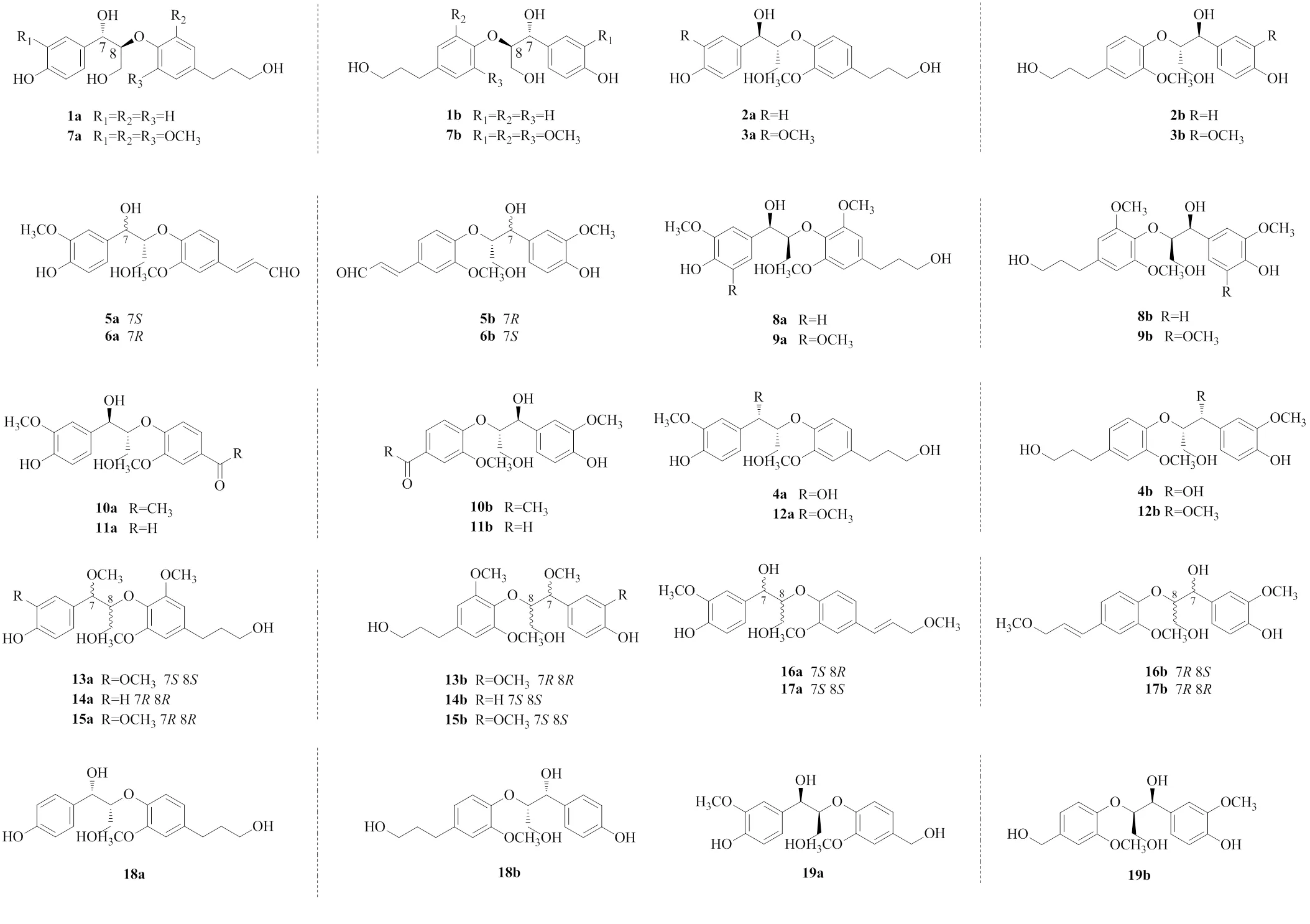
1 8-O-4′型新木脂素对映异构体

续表1
1.2 苯骈二氢呋喃型木脂素
2个C6C3结构单元通过C-8和C-3′相连,且C-7和C-4′氧化环合的木脂素为苯骈二氢呋喃型新木脂素。本文汇总了已报道的34对苯骈二氢呋喃型新木脂素对映体,其科属分布见图4。
由图4可以看出,苯骈二氢呋喃型新木脂素对映体同样在蔷薇科中被发现较多,大约占总数的46%,其中对映体数量最多的植物是蔷薇科悬钩子属的红树莓。化合物的具体来源及结构见表2和图5。
1.3 双四氢呋喃型木脂素
2个C6C3结构单元在C-8和C-8′直接相连的同时,C-7和C-9′以及C-7′或C-9同时氧化环合形成2个四氢呋喃结构的木脂素为双四氢呋喃型木脂素。本文汇总了已报道的12对该类型对映体,化合物科属分布、植物来源及具体结构见图6、表3和图7。
1.4 四氢呋喃型木脂素
2个C6C3结构单元在C-8和C-8′直接相连的同时,C-7或C-9和C-7′或C-9′氧化环合形成四氢呋喃结构的木脂素叫四氢呋喃型木脂素。其的结构骨架可分为3种类型,即7--7′型、7--9′型和9--9′型。本文汇总整理了已报道的17对该类型的对映体,化合物种属分布、植物来源及结构见图8、表4和图9。
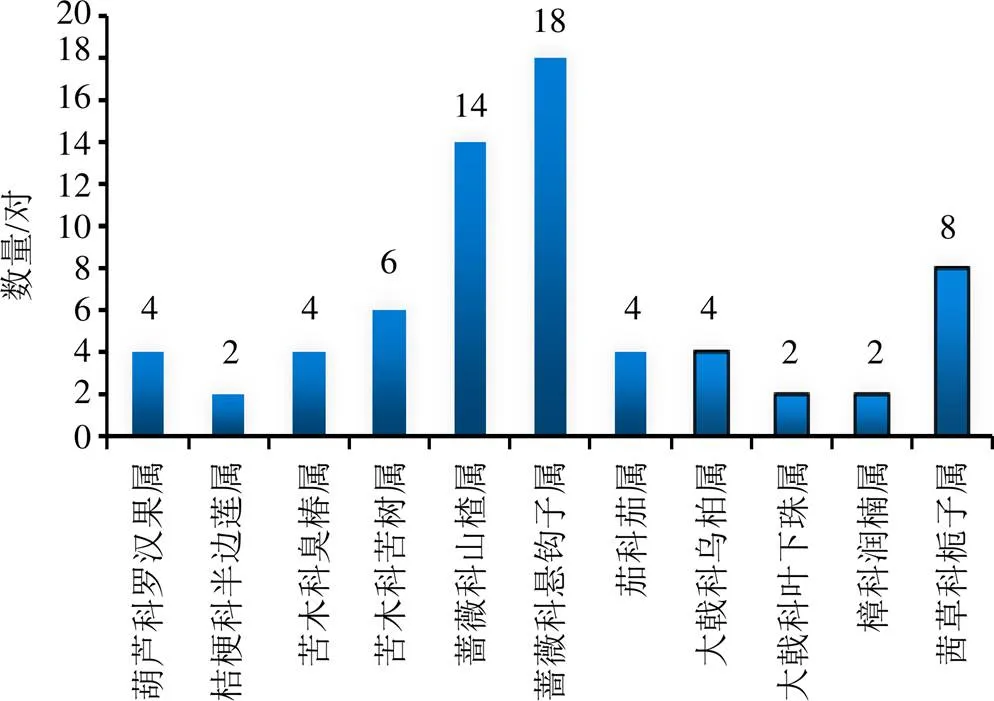
图4 苯骈二氢呋喃型新木脂素对映异构体科属分布

表2 苯骈二氢呋喃型新木脂素对映异构体
1.5 倍半木脂素和二倍木脂素
由3个C6C3结构单元相互连接形成的木脂素为倍半木脂素;由4个C6C3结构单元相互连接形成的木脂素为二倍木脂素。本文汇总整理了已报道的15对该类型对映体,化合物科属分布、植物来源及结构见图10、表5和图11。

图6 双四氢呋喃型木脂素对映异构体科属分布
Fig. 6 Distribution of family and genus of ditetrahydrofuran lignans enantiomers
1.6 其他类型
本文还整理了已报道的47对其他类型的木脂素,其中有17对结构比较新颖的木脂素对映体。化合物具体来源和结构见表6和图12。
本文汇总整理了已报道的161对木脂素对映异构体,包括36对8--4′型新木脂素对映体、34对苯骈二氢呋喃型新木脂素对映体、12对双四氢呋喃型木脂素对映体、17对四氢呋喃型木脂素对映体、15对倍半木脂素和二倍木脂素以及47对其他类型木脂素对映体。由图13可以看出,木脂素对映异构体多在蔷薇科中被发现,大约占总数29.81%,其中8--4′型新木脂素和苯骈二氢呋喃型新木脂素对映体存在的数量占主体地位,在蔷薇科中分离这2类木脂素时需要注意化合物的ECD、旋光性质,判断是否需要拆分;值得注意是由于光学混合物ECD光谱的不可靠性,采用ECD经验规则确定构型是不严谨的,想要对其结构进行准确确定,需要借助手性拆分技术将其拆分,并结合量子化学计算或X-单晶衍射等手段才能准确确定其结构;对映异构体比例大部分以1∶1的形式存在,少部分对映体比例也可能以3∶1的形式存在,需要特别注意。

表3 双四氢呋喃型木脂素对映异构体
2 木脂素对映体手性拆分方法
木脂素通常用高效液相色谱分离,通过选择不同色谱柱以及不同系统的流动相(甲醇水系统和乙腈水系统)实现化合物的分离。在获得木脂素单体后,通过本文的归纳整理,可以初步推断是否可能以对映体混合物的形式存在,通过观察ECD谱是否具有明显吸收,是否具有较大旋光值进一步判断是否为对映体。若为木脂素对映体混合物,则需要借助手性柱进行拆分。本文整理汇总了已报道的161对木脂素对映体拆分条件,结果如表7所示。结果显示AD-H和IC类型的手性柱可以用来拆分大部分类型的木脂素,流动相系统一般选择异丙醇与正己烷或者正己烷与乙醇。其中8--4′型新木脂素和苯骈二氢呋喃型新木脂素常用IC拆分柱拆分,流动相为异丙醇与正己烷,以上结果可以为已知或未知的木脂素化合物手性拆分提供一定的参考。

图8 四氢呋喃型木脂素对映异构体科属分布
3 木脂素对映异构体生源途径探讨
木脂素化合物是否以对映异构体的形式存在是由其生源途径决定的,如图14所示,以常见木脂素对映体松脂醇和落叶松脂素为例,它们都以苯丙氨酸最为起始,通过苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)催化脱氨形成肉桂酸,肉桂酸经过肉桂酸-4-羟基化酶(cinnamate-4- hydroxylase,C4H)催化生成4-香豆酸(-coumaric acid),辅酶A连接酶(4-coumarate:coenzyme A ligase,4CL)可以催化4-香豆酸生成4-香豆酰辅酶A酯(-coumaroyl-CoA),紧接着在莽草酸/奎宁酸羟基肉桂酰转移酶(shikimate/quinate hydroxycinnamoyl transferase,HCT)与香豆酸-3-羟基化酶(coumarate- 3-hydroxylase,C3H)的催化下生成羟基肉桂酸辅酶A(caffeoyl-CoA),在咖啡酰辅酶A氧甲基转移酶(caffeoyl CoA 3--methyl transferase,CCoAOMT)催化下发生甲基化,生成羟基肉桂酸的辅酶A酯(feruloyl-CoA),经肉桂酰辅酶A还原酶(cinnamoyl CoA reductase,CCR)催化还原成肉桂醛(conifer aldehyde),最后经过肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase,CAD)还原可以形成不具有手性中心的关键中间体松柏醇(coniferyl alcohol)[24,56]。
表4 四氢呋喃型木脂素对映异构体
以上生合成途径在大多是植物中都广泛存在,有研究报道证明如果植物中同时存在2种具有相反的立体特异性的同工酶例如松脂酚合成酶(pinoresinol synthase,PS),它们会在催化2个松柏醇单元的双分子苯氧基自由基偶联反应中发挥关键作用,从而形成1对对映异构体,即形成1对双四氢呋喃型木脂素对映体即(±)-松脂酚。接下来,在有相反对映选择性的 (±)-松脂酚/落叶松脂酚还原酶(pinoresinol reductase,PLR)的催化下,松脂酚又可以被立体选择性地还原为 (±)-落叶松脂酚和(±)-开环异落叶松脂酚[57-58]。因此具体到特定植物中的化合物,其是否以对映异构体的形式存在,还要看在植物中这2种酶是否同时存在。目前关于植物中生物合成关键酶的分子机制研究逐渐成为植物学研究的热点,通过阐明这些关键酶的分子机制,有助于解释其选择性催化底物反应的机制,阐明木脂素对映体是如何产生的,为木脂素进一步研究开发提供新思路[59]。

图9 四氢呋喃型木脂素对映异构体

图10 倍半木脂素和二倍木脂素对映异构体科属分布
4 药理活性
脂素生物活性也十分广泛而显著,主要具有细胞毒性和抗肿瘤作用、神经保护作用、肝保护和抗氧化作用、抗HIV病毒作用、抗菌作用等。由于对映异构体的药效与毒性并不完全相同,不同结构可能是导致活性变化的关键,现对文献报道的木脂素对映体生物活性进行总结。
4.1 细胞毒性和抗肿瘤作用
Yao等[4]研究发现化合物5b和6b对肝癌Hep3B细胞的杀伤作用分别强于化合物5a和6a,同时由于MEK/ERK信号通路下调,化合物5b和6b可诱导更多的细胞凋亡和更高的ROS积聚。Shang等[8]研究发现化合物24a/24b对肝癌Hep3B细胞有较好的细胞毒作用,IC50值分别为(34.97±2.74)、(17.42±0.71)μmol/L。此外,在Hep3B细胞中,化合物24b比24a诱导更多的凋亡和自噬细胞。Lou等[14]研究发现化合物42a/42b的不同构型决定了其对HepG2细胞的对映选择性,其细胞毒作用是通过诱导细胞凋亡和产生活性氧来实现的。Guo等[19]利用人肝癌细胞Hep3B和HepG2细胞对5对对映异构体(化合物54a/54b~57a/57b)进行了体外细胞毒性评价。其中,化合物55a对Hep3B细胞具有选择性细胞毒作用,IC50值为25.47 μmol/L,其对映体化合物55b对Hep3B细胞的IC50值为59.37 μmol/L。结果表明,化合物55a和55b的绝对构型对其细胞毒性有显著影响。进一步的流式细胞仪分析表明,与其对映体化合物50b相比化合物50a对诱导细胞凋亡的影响更为显著。
表5 倍半木脂素和二倍木脂素对映异构体
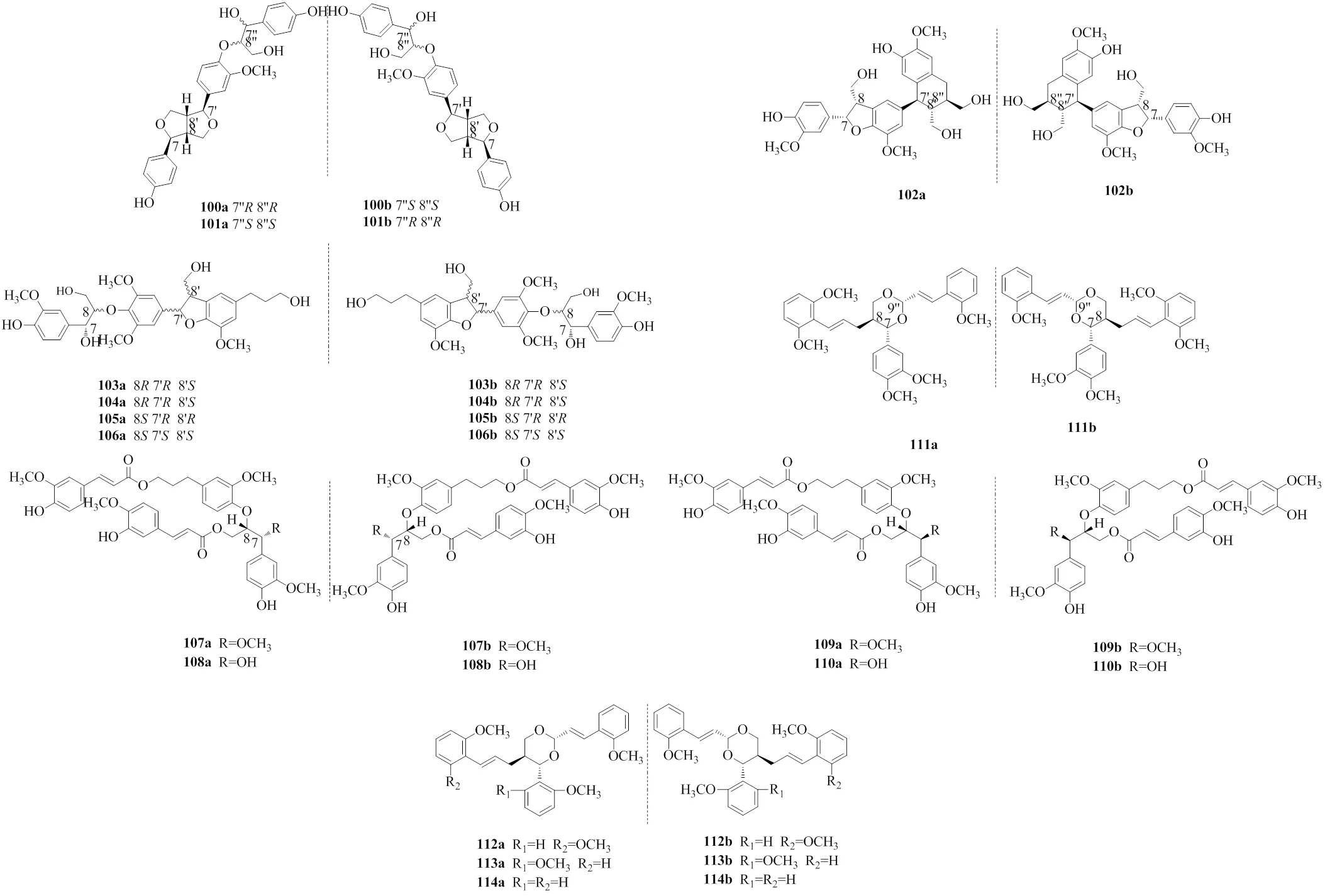
图11 倍半木脂素和二倍木脂素对映异构体

表6 其他类型木脂素对映异构体
图12 其他类型木脂素对映异构体
Fig. 12 Other types of lignans enantiomers

图13 木脂素对映异构体科属分布
4.2 神经保护作用
Zhou等[17]研究发现化合物49a比49b神经保护活性强,作用机制主要是能够减弱H2O2诱导的SH-SY5Y细胞凋亡、活性氧(reactive oxygen species,ROS)生成。Guo等[18]研究发现对映异构体化合物51a和51b显示出不同程度的神经保护活性,结果显示对映选择性,其中化合物51b表现出明显的神经保护活性,而其对映体51a仅在较低浓度下表现出明显的保护作用,进一步的研究表明,化合物潜在的保护作用似乎是通过抑制细胞凋亡来实现的。Guo等[19]研究发现2对对映异构体化合物57a/57b和58a/58b显示出对神经保护活性的不同影响,化合物58a显示出最有效的神经保护作用。进一步研究表明,化合物58a可通过增强过氧化氢酶(catalase,CAT)活性,选择性地抑制H2O2处理的人神经母细胞瘤SH-SY5Y细胞的凋亡诱导和ROS积累。Zhou等[38]研究了它们对H2O2诱导的人神经母细胞瘤SH-SY5Y细胞氧化应激的神经保护作用,结果表明它们具有对映体选择性,其中化合物116a具有明显的神经保护作用,而其对映体116b没有明显的保护作用。

表7 拆分柱及流动相汇总结果

图14 木脂素生物合成途径
4.3 抗老年痴呆作用
β-淀粉样蛋白是大脑皮质老年斑的主要成分,该蛋白能在体内聚合为可溶性二聚体,这种二聚体可以削弱突触结构和功能,从而引起阿尔茨海默病。Zhou等[3]以硫黄素-T为基础的荧光法检测SH-SY5Y对自身诱导抗体聚集的抑制作用,结果表明化合物1b、2a和2b具有显著的抗Aβ1-42聚集活性,并通过分子对接研究了对映体化合物1a/1b和3a/3b与β-淀粉样蛋白口袋位点的相互作用,揭示了不同立体化学结构对活性的影响。Zhou等[13]研究发现化合物37a对ABTS自由基的清除能力最强,化合物39b具有中等的抗Aβ1-42聚集活性。Wang等[26]在获得光学纯化合物的基础上,以姜黄素为阳性对照,用THT法评价了对Aβ1-42聚集的抑制作用。结果显示,化合物71b在20 μmol/L浓度下对Aβ1-42聚集的抑制率为(80.60±1.53)%,高于姜黄素对Aβ1-42聚集的抑制率(75.60±1.52%)%,表明化合物71b对Aβ1-42的聚集有明显的抑制作用,然而化合物71a具有中等的Aβ1-42聚集活性。这些研究为治疗阿尔兹海默症提供了前期研究基础。
5 结语与展望
宏观来看,了解木脂素对映异构体的分布,对以后分离木脂素类化合物有一定的指导意义,参考归纳总结的结果,可以初步判断出分离获得的木脂素是否有可能以对映体混合物的形式存在。通过研究植物生合成途径中的特异性酶的特性可以揭示木脂素对映体是如何产生,为进一步研究开发木脂素提供思路。深入探究木脂素对映体之间的活性差异,选择效果显著的光学纯化合物进行用药,不仅可以排除无效(或不良)对映异构体所以引起的毒副作用,还能减少人体对无效对映异构体的代谢负担。
利益冲突 所有作者均声明不存在利益冲突
[1] Alkadi H, Jbeily R. Role of chirality in drugs: An overview [J]., 2018, 18(2): 88-95.
[2] Parikh M, Maddaford T G, Austria J A,. Dietary flaxseed as a strategy for improving human health [J]., 2019, 11(5): E1171.
[3] Zhou L, Lou L L, Wang W,. Enantiomeric 8-O-4' type neolignans from red raspberry as potential inhibitors of β-amyloid aggregation [J]., 2017, 37: 322-329.
[4] Yao G D, Wang J, Song X Y,. Stereoisomeric guaiacylglycerol-β-coniferyl aldehyde ether induces distinctive apoptosis by downregulation of MEK/ERK pathway in hepatocellular carcinoma cells [J]., 2018, 81: 382-388.
[5] Zhao P, Zhang H, Han F Y,. Chiral resolution and neuroprotective activities of enantiomeric 8-O-4' neolignans from the fruits ofBge [J]., 2019, 136: 104164.
[6] Du Y Q, Lin B, Yan Z Y,. Enantiomeric 8, 4'-type oxyneolignans from the root barks of(Mill.) Swingle and their neuroprotective effects against H2O2-induced SH-SY5Y cells injury [J]., 2019, 139: 104403.
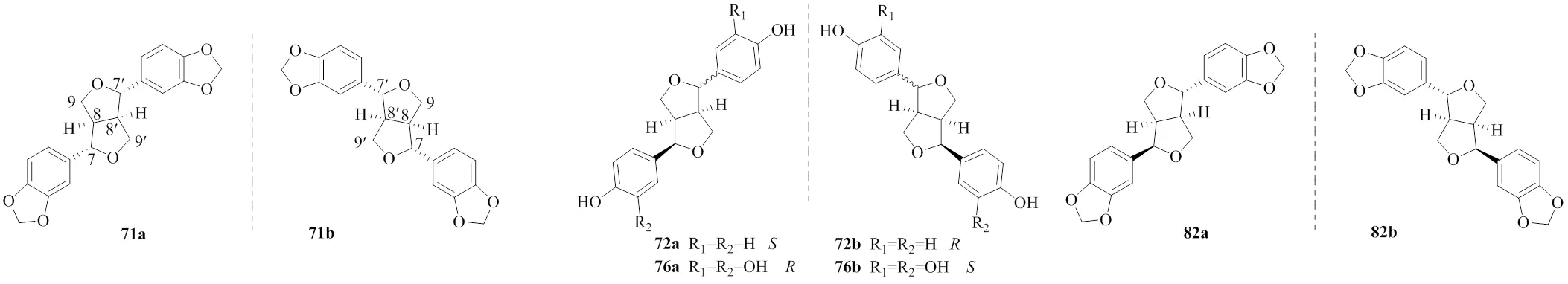
[7] Li S S, Hou Z L, Yao G D,. Lignans and neolignans with isovaleroyloxy moiety fromThunb.: Chiral resolution, configurational assignment and neuroprotective effects [J]., 2020, 178: 112461.
[8] Shang X Y, Guo R, Yu X Q,. Enantiomeric 8--4'-type neolignans fromexhibit cytotoxic effect via apoptosis and autophagy in Hep3B cells [J]., 2020, 104: 104267.
[9] Xia Z, Xu T Q, Zhang H X,. New phenylpropanoids from the fruits ofand their anti-inflammatory activity [J]., 2020, doi: 10.1080/14786419.2020.1806273.
[10] Lu Y Y, Xue Y B, Liu J J,. (±)-acortatarinowins A-F, norlignan, neolignan, and lignan enantiomers from[J]., 2015, 78(9): 2205-2214.
[11] Liu X, Yang M H, Wang X B,. Lignans from the root ofand their anti-β-amyloid aggregation activities [J]., 2015, 103: 136-142.
[12] Sun J, Yu J, Zhang P C,. Enantiomeric determination of four diastereoisomeric oxyneolignans fromMunro [J]., 2015, 26(1): 54-60.
[13] Zhou L, Xi Y F, Wang W,. Chiral resolution and bioactivity of enantiomeric benzofuran neolignans from the fruit ofL. [J]., 2018, 127: 56-61.
[14] Lou L L, Yao G D, Wang J,. Enantiomeric neolignans fromexhibit distinctive cytotoxicity on hepatic carcinoma cells through ROS generation and apoptosis induction [J]., 2018, 28(8): 1263-1268.
[15] Zhou L, Wang J, Guo R,. Discovery of dihydrobenzofuran neolignans fromL. with enantioselective anti-Aβ1-42aggregation activity [J]., 2018, 80: 64-69.
[16] Yan Z Y, Chen J J, Duan Z K,. Racemic phenylpropanoids from the root barks of(Mill.) Swingle with cytotoxicity against hepatoma cells [J]., 2018, 130: 234-240.
[17] Zhou L, Yao G D, Lu L W,. Neolignans from red raspberry (L.) exhibit enantioselective neuroprotective effects against H2O2-induced oxidative injury in SH-SY5Y cells [J]., 2018, 66(43): 11390-11397.
[18] Guo R, Lv T M, Han F Y,. Chiral resolution and neuroprotective activities of enantiomeric dihydrobenzofuran neolignans from the fruit of[J]., 2019, 85: 469-474.
[19] Guo R, Lv T M, Shang X Y,. Racemic neolignans from: Chiral resolution, configurational assignment, and cytotoxic activities against human hepatoma cells [J]., 2019, 137: 104287.
[20] Chen J X, Huang S H, Wang L,. Two pairs of enantiomeric neolignans from[J]., 2010, 5(10): 1627-1630.
[21] Hu F, Hu Y J, Su B J,. Enantiomeric lignans with antineuroinflammatory activities from[J]., 2021, 42: 18-23.
[22] Wu Z D, Lai Y J, Zhou L,. Enantiomeric lignans and neolignans from: Enantioseparation and their absolute configurations [J]., 2016, 6: 24809.
[23] Tshitenge D T, Feineis D, Awale S,. Gardenifolins A-H, scalemic neolignans from: Chiral resolution, configurational assignment, and cytotoxic activities against the HeLa cancer cell line [J]., 2017, 80(5): 1604-1614.
[24] Finefield J M, Sherman D H, Kreitman M,. Enantiomeric natural products: Occurrence and biogenesis [J]., 2012, 51(20): 4802-4836.
[25] Yu M, Zhang Y L, Liu J L,. Sesquineolignan and neolignan enantiomers from[J]., 2020, 103: 104147.
[26] Wang J, Zhou L, Cheng Z Y,. Chiral resolution and bioactivity of enantiomeric furofuran lignans fromMaxim [J]., 2020, 34(15): 2225-2228.
[27] Zhou L, Han F Y, Lu L W,. Isolation of enantiomeric furolactones and furofurans fromL. with neuroprotective activities [J]., 2019, 164: 122-129.
[28] Liu W J, Chen Y J, Chen D N,. A new pair of enantiomeric lignans from the fruits ofand their absolute configuration [J]., 2018, 32(8): 933-938.
[29] Yamauchi S, Ichikawa H, Nishiwaki H,. Evaluation of plant growth regulatory activity of furofuran lignan bearing a 7, 9': 7', 9-diepoxy structure using optically pure (+)- and (-)-enantiomers [J]., 2015, 63(21): 5224-5228.
[30] Devendra S, Nisha N, Ashok K,(±)-Asarinin [J]., 2013, 69: 89-92.
[31] Lu Y, Xue Y, Chen S,. Antioxidant lignans and neolignans fromtatarinowii [J]., 2016, 6: 22909.
[32] Zhao P, Guo R, Zhang Y Y,. Phenylpropanoid and dibenzofuran derivatives fromwith antiproliferative activities on hepatoma cells [J]., 2019, 93: 103354.
[33] Wang Y X, Lin B, Zhou L,. Anti-β-amyloid aggregation activity of enantiomeric furolactone-type lignans from(Jack) I.C.N [J]., 2020, 34(4): 456-463.
[34] Zou Y Y, Wang D W, Yan Y M,. Lignans fromand their anti-inflammatory activities [J]., 2021, 18(8): e2100231.
[35] Jiang C, Luo P, Zhao Y,. Carolignans from the aerial parts ofand their anti-HIV activity [J]., 2016, 79(3): 578-583.
[36] Cheng Z B, Lu X, Bao J M,. (±)-Torreyunlignans A-D, rare 8-9' linked neolignan enantiomers as phosphodiesterase-9A inhibitors from[J]., 2014, 77(12): 2651-2657.
[37] Wang Y X, Zhou L, Wang J,. Enantiomeric lignans with anti-β-amyloid aggregation activity from the twigs and leaves ofBenth [J]., 2018, 77: 579-585.
[38] Zhou L, Yao G D, Song X Y,. Neuroprotective effects of 1, 2-diarylpropane type phenylpropanoid enantiomers from red raspberry against H2O2-induced oxidative stress in human neuroblastoma SH-SY5Y cells [J]., 2018, 66(1): 331-338.
[39] Xi Y F, Liu S F, Hong W,. Discovery of cycloneolignan enantiomers fromFortune with neuroprotective effects against MPP+-induced SH-SY5Y cell injury [J]., 2019, 88: 102926.
[40] Zhu Y, Huang R Z, Wang C G,. New inhibitors of matrix metalloproteinases 9 (MMP-9): Lignans from[J]., 2018, 130: 281-289.
[41] Vu V T, Chen X L, Kong L Y,. Melipatulinones A-C, three lignan-phloroglucinol hybrids from[J]., 2020, 22(4): 1380-1384.
[42] Vu V T, Nguyen M T, Wang W L,. Patulignans A-C, three structurally unique lignans from the leaves of[J]., 2020, 18(34): 6607-6611.
[43] Zhang H, Wang S, Liu Q,. Dracomolphin A-E, new lignans from[J]., 2021, 150: 104841.
[44] Guo R, Zhao P, Yu X Q,. (±)-Pinnatifidaones A–D, four pairs of highly modified neolignan enantiomers with a rare spirocyclohexenone skeleton from[J]., 2021, 8(5): 953-960.
[45] Shi Y, Liu Y, Li Y,. Chiral resolution and absolute configuration of a pair of rare racemic spirodienone sesquineolignans from[J]., 2014, 16(20): 5406-5409.
[46] Guo R, Lv T, Han F Y,. New norlignan enantiomers from the fruit ofwith neuroprotective activities [J]., 2020, 31(5): 1254-1258.
[47] Shirakata H, Nishiwaki H, Yamauchi S. Syntheses of all eight stereoisomers of conidendrin [J]., 2020, 84(10): 1986-1996.
[48] Cretin B N, Sallembien Q, Sindt L,. How stereochemistry influences the taste of wine: Isolation, characterization and sensory evaluation of lyoniresinol stereoisomers [J]., 2015, 888: 191-198.
[49] Karasawa S, Yoza K, Tung N H,. Determination of the absolute configuration of the novel anti-trypanosomal iridoid molucidin isolated fromby X-ray analysis [J]., 2015, 56(52): 7158-7160.
[50] Li L Z, Liang X, Sun X,. Bioactive norditerpenoids and neolignans from the roots of[J]., 2016, 14(42): 10050-10057.
[51] Li D W, Leng A J, Qi Y,. Simultaneous quantification of schisandrin B enantiomers in rat plasma by chiral LC-MS/MS: Application in a stereoselective pharmacokinetic study [J]., 2018, 159: 186-191.
[52] Yang D T, Lin S S, Chen J H,. (+)- and (-)-liriodenol, a pair of novel enantiomeric lignans fromhybrid [J]., 2015, 25(9): 1976-1978.
[53] Tian X H, Yue R C, Zeng H W,. Distinctive effect on nerve growth factor-induced PC12 cell neurite outgrowth by two unique neolignan enantiomers from[J]., 2015, 5: 16982.
[54] Lai Y J, Liu T T, Sa R J,. Neolignans with a rare 2-oxaspiro[4.5]deca-6, 9-dien-8-one motif from the stem bark of[J]., 2015, 78(7): 1740-1744.
[55] Bao J M, Cheng Z B, Zhang J S,. Determination of the absolute configuration of two pairs of C-8 - C-9' linked neolignan enantiomers [J]., 2014, 26(12): 825-828.
[56] Lau W, Sattely E S. Six enzymes from mayapple that complete the biosynthetic pathway to the etoposide aglycone [J]., 2015, 349(6253): 1224-1228.
[57] Zhang D D, Li J Y, Ruan D Q,. Lignans fromroots and their inhibitory effects on nitric oxide production [J]., 2019, 137: 104189.
[58] Kezimana P, Dmitriev A A, Kudryavtseva A V,. Secoisolariciresinol diglucoside of flaxseed and its metabolites: Biosynthesis and potential for nutraceuticals [J]., 2018, 9: 641.
[59] Harada E, Murata J, Ono E,. (+)-Sesamin-oxidising CYP92B14 shapes specialised lignan metabolism in sesame [J]., 2020, 104(4): 1117-1128.
Research progress on lignan enantiomers
XIN Ben-song, ZHAO Peng, HUANG Xiao-xiao, SONG Shao-jiang
Shenyang Pharmaceutical University, Shenyang 110000, China
In nature, optically pure natural products are widely distributed. However, increasingly studies have found that some types of compounds exist enantiomers. Although they have the same physical and chemical properties, their efficacy and toxicity are not completely coincident, and chirality may be the key factor for different activities. As a very important secondary metabolite in nature, lignans have been found to exist as a mixture of enantiomers in many plants. This article aims to summarize the reported lignan enantiomers, and discuss their chiral separation methods biogenic pathways and pharmacological activities. It will contribute to the further research and development of the medicinal value of lignan enantiomers.
lignans; enantiomers; chiral separation; biosynthetic pathway; pharmacological activities
R284;R28
A
0253 - 2670(2021)17 - 5311 - 18
10.7501/j.issn.0253-2670.2021.17.024
2021-07-15
辽宁省“兴辽英才计划”青年拔尖人才项目(2007180);中国医药教育协会2020重大科学攻关问题和医药技术难题(2020KTS003)
辛本松(1999—),男,硕士研究生,研究方向为天然药物化学。Tel: 17640454982 E-mail: xbs13165209986@163.com
宋少江,沈阳药科大学57期药学(英语强化班)专业校友,二级教授、博士生导师,国家百千万人才工程人选——有突出贡献中青年专家,国务院学位委员会药学学科评议组成员,享有国务院政府特殊津贴,辽宁省优秀专家,辽宁省特聘教授。主要研究方向为天然药物中抗肿瘤有效成分、药食同源植物的功能成分及其药理作用机制研究,以及抗阿尔茨海默病新药的研究与开发。Tel: 13998392228 E-mail: 13998392228@163.com
[责任编辑 王文倩]

