基于药品全生命周期的中药监管模型的构建研究
黄 哲,赵祥琦,林学怡,徐凤翔
·药事管理·
基于药品全生命周期的中药监管模型的构建研究
黄 哲1, 2,赵祥琦1,林学怡1,徐凤翔2*
1. 沈阳药科大学工商管理学院,辽宁 沈阳 110016 2. 沈阳药科大学药品监管科学研究院,辽宁 沈阳 110016
随着2020版《药品管理法》正式增设药品上市许可持有人(marketing authorization holder,MAH)制度、药品监管科学行动计划以及《关于结束中药配方颗粒试点工作的公告》的正式实施,标志着中药正式进入全生命周期监管时代。当前,我国尚未能建立起一个符合中药规律和发展特点的全生命周期中药监管体系,中药产品疗效不稳定,我国的中医药产品安全性和使用有效性难以取得国际市场的重视和认可。因此,迫切需要建立一套全生命周期的中药监管体系,加强对中药的科学监管来推动其高质量发展。结合我国中药全生命周期实际监管中存在的问题,提出研制、生产、流通、使用环节指标,构建科学的中药全生命周期监管的评价体系,采用基于模糊群决策的评价方法科学评价各因素,以期规范中药全生命周期监管,促进中药质量标准与国际接轨。
药品管理法;全生命周期;中药监管;模糊群决策;评价指标;质量控制
中药是以中国传统医药理论指导采集、炮制、制剂,说明作用机制,指导临床应用的药物,在中医理论指导下,可用于疾病的预防、治疗或诊断工作。2020年版《药品管理法》[1]增设了药品上市许可持有人制度(Marketing Authorization Holder,MAH),对持有人提出了更高的要求——要对药品全生命周期负责。2021年2月国家发布公告,特别指出:中药配方颗粒将从试点期间属于生产、临床试用的产品属性转变为涵盖研发、生产、流通、使用的具备全生命周期属性的上市药品,并纳入中药饮片监管范畴[2]。首批和第2批国家药品监管科学行动的陆续发布,标志着中药正式进入全生命周期监管时代。
中医药在中国已经传承和运用几千年,具备中医学的基础性理论和技术指导,本应面向世界,但由于中药为天然药物,且临床大多采用复方制剂,产业链长,质量控制难,风险环节多[3],使中药监管工作更具难点与特点。在中药注册审批方面,我国是世界各国中医药的研究和推广应用主导者之一,作为国际人用药品注册技术协调会(International Council for Harmonization of Technical Requirements for Pharmaceuticals for Human Use,ICH)中的一员,中药和天然药物的监管和新药申请(new drug application,NDA)要求将对标国际,但报告不完整、分析不充分以及前期沟通不足等一些注册审批方面的共性问题仍屡见不鲜[4]。在中药生产方面,由于各种类别中药材的质量标准没有得到完全统一、各生产厂家因为中药材提取的原料相对差异性、设备和工艺或者是有不同、质量管理和控制水平不同等种种原因,导致市场上中药材的质量一致性比较差。在中药流通方面,中药仓储极易受环境的影响,并且会影响中药质量和疗效。近几年我国对中药材和饮片质量监督检测的结果显示,因仓储问题所造成不合格中药材占比依旧很高[5]。此外,信息不对称、流通链冗杂等问题也存在于流通环节中,表现出以次充好、掺杂等现象。其中掺杂是导致造成食用中药材和饮片质量不合格的重要原因,随着抽验监督力度加大,假冒伪劣药品逐渐减少,但以次充好的现象逐渐增多。在中药材使用方面,医疗机构用药存在配伍禁忌、处方错误、饮片质量不理想、未执行脚注等现象,引起患者一系列不良反应,危及患者生命健康[6]。由此,应当尽快建立中药全生命周期监管体系,在中药发挥疗效的同时,把好安全性关口,拉起警戒线,推动中医药健康发展。
近年来,国内专家学者对中药监管研究大多聚焦于法律法规、质量管理现状分析、质量标准制定或某一环节的研究。赵迪等[7]从流通信息、流通成本、中药流通质量的角度分析流通环节存在的问题并提出相应的对策。李慧等[8]聚焦于中成药、中药材与中药饮片,以及医疗机构中药制剂,梳理了相关的政策、法规。刘晴晴等[9]通过梳理中药追溯法律规制现状,发现目前中药追溯法律及规章制度存在一些现象,如主体责任不明确、部门监管职责存在交叉、追溯法律制度不够完善等问题,提出主体要明确追溯的相关责任、明晰监管部门职责、完善追溯法律制度等方面的建议。
对于中药全生命周期监管研究,宋鑫等[10]调研江西省中药饮片质量现状的基础上,通过建立全生命周期管理的中药饮片质量管理模型,以提升江西省中药饮片质量水平,推动江西省的中医药产业发展。郑文科等[11]探讨真实世界用于中药安全性连续性监测,并建立中药全生命周期监管模式的大体框架。本文将结合我国中药全生命周期实际监管中存在的问题,构建一套基于中药全生命周期的监管体系,采用模糊群决策的方法,构建中药全生命周期监管的评价模型。基于算例结果,确定中药的研制、生产、流通、使用4个环节的监管重要程度,重点给出最为重要环节的监管建议,此外,对于其他环节,也提出相应的科学合理的监管建议,真正做到有效监管、有力监管。在保证中药各环节监管取得良好效果的前提下,监管部门可以利用该评价体系合理分配监管力度,使得监管工作多管齐下,做到层次和力度分明,以期响应国家提出的全生命周期监管的要求,加强中药科学监管,从而推动中药高质量发展。
1 针对影响中药监管的因素,建立评价指标体系
1.1 指标体系建立的相关准则
建立有效的评价指标体系是中药监管模型研究中非常重要的一部分。为了达到科学、有效的评价,所建立的指标体系必须系统、规范。研究基于药品全生命周期的中药监管的相关影响因素,可为中药监管工作给予可靠的建议;同时,也顺应药品全生命周期监管之大势,具有显著的现实意义。因此,为了更专业地研究该相关影响因素,构建合理、科学、规范的指标评价体系,须满足如下评价原则:①科学、典型性原则。即所建立的指标体系必须真实、客观地反应各项指标之间的关系,必须具有典型特征和实际意义,以保证数据计算的可靠性。②系统性原则。即所建立的评价指标体系必须连贯,具有逻辑联系,保证系统的完整性。③全面、层次性原则。即指标体系应当涵盖中药监管影响因素的各方面,且体现出规范的层次特征。④客观、公平性原则。即指标体系应当客观、公正,最小化程度地减少主观与偏见。
1.2 建立中药监管影响因素指标体系
基于以上基本原则,全面梳理总结了大量文献,提炼出影响中药全生命周期监管的各种因素,为了达到可靠性这一目标,特地利用咨询专家的方法,使得提出的评价指标最大化地达到全面、实际的原则。在研究过程中,咨询的3位专家均是从事中药学、药品监管科学的学者,长期开展中药监管的研究工作,因此,专家对于中药监管的影响因素有着比较深入的研究,对本研究的开展提供了有力支持,专家还参与了后续的打分环节的工作。综上情况,本文提出了“研制”“生产”“流通”“使用”作为I级指标,由此延伸出了II/III级指标,便于构建评价体系,结果见表1。
中药新药研制的药学研究内容主要包括原料药工艺研究、提取工艺试验、处方筛选、剂型确定、制备工艺研究、检验方法研究、质量标准和稳定性考察等。对于中药制剂,还要考虑原药材的来源、加工及炮制等。药理毒理学研究主要包括药效学实验、一般药理学实验、药动学及毒理学研究等,其中毒理学研究包括急性毒性、长期毒性试验等[12]。中药新药临床研究分为I、II、III期临床试验,I期主要进行初步的临床药理学及人体安全性评价试验,II期进行初步的治疗作用评价,III期进行治疗作用的确证研究。中药新药研制中存在的主要风险因素是组方合理性,组方与传统中医理论相违背或理法方药是否一致,君、臣、佐、使关系是否明确以及功效、性味归经是否符合中医遣方用药的原则。因此,在构建研制指标时纳入了药学研究资料的真实可靠性、临床试验的安全有效性、组方合理性等分指标。

表1 中药监管影响因素指标体系
2020版《药品管理法》规定药品必须按国家药品标准和国务院药品监督管理部门批准的生产工艺进行生产。然而由于长期复杂的多方利益相关方的博弈形势,一些中成药产品实际的生产工艺与批准的工艺不一致,有些品种甚至基本没有实现合规的可能性[13]。此外,中药产业是一个资源型产业。近年来,国家药品监督管理局逐步加强了对中药资源评价的相关要求。例如,在经典方剂复方制剂的相关技术要求中,明确要求参考《中药资源评价技术指导原则》,提供处方中药材资源评价资料。重点阐述野生药材来源的稳定性和资源的可持续利用以及确保野生药材来源稳定和资源可持续利用的措施。药材的道地性是鉴别药材优质与否的专用名词。道地药材的确定,与药材产地、品种、质量等多种因素有关,而临床疗效则是其关键因素。因此,在构建生产指标时纳入了生产合规性、药材道地性及药材资源保障及风险管理能力等分指标。
由于中药材市场信息不对称,在中药材刚性需求较大的市场环境下,中药材上游生产方式薄弱,供需失衡,中药材市场风险凸显,最终可能导致劣质产品恶意低价竞争,扰乱市场,影响消费者对中药质量的信任。此外,据统计,我国每年有200多万人因虚假广告而吃“错”药,其中中药类的广告高达90%以上[14]。我国中药流通环节中,虚假广告泛滥现象已经成为流通环节中不可忽视的重大隐患[7]。因此,在构建流通指标时纳入了信息不对称、广告监管等分指标。
在现代中药安全问题频发的背景下,中药与化学药物相比具有复杂性、人群特殊的易感性、增强疗效、降低毒性的可调性丰富、与药物的风险-效益比较不明确等特点。同时,中药是天然药物,临床上多采用复方制剂,产业链长、质量控制困难、风险环节多,使得中药的上市后安全性监测更具特点也更困难[3]。因此,在构建使用指标时纳入了合理用药、已上市中药品种的安全性监测、不良反应监测效果评价等指标。
2 基于模糊群决策的中药监管影响因素评价模型的构建
本文在构建中药监管影响因素评价模型的过程中,采用的方法为模糊群决策方法、多指标评价分析法。对回收的评价数据进行处理,在对回收的评价数据进行整合处理,针对不同级别的自然语言变量,设立相应的三角模糊数;随后用模糊集理论处理相关数据,利用多指标评价分析法构建相应的评价模型。运用该评价模型进行评价,同时利用统计学方法对收集的数据进行处理,得到中药监管影响因素的综合评价值。
2.1 评价指标体系的表示
设定U(=1,2,…,)为中药监管影响因素评价指标,以便于构建该评价模型,方便后续工作的开展。
2.2 评价指标权重的确定
由于所建立的评价体系要满足规范和科学原则,同时也应最大可能全面化,包络尽可能多的相关指标。在评价指标体系中,对于每一个指标,都会有一个特定的权重与其对应。因此,每个指标的权重也便代表了该指标的重要度。假设有个评价者参与了工作,对于其中的一个评价人员,其对某个指标U持有的重要等级(用权重表示)可以量化为w。由于该评价者需要针对所有指标进行主观的重要度描述,因此引入集。
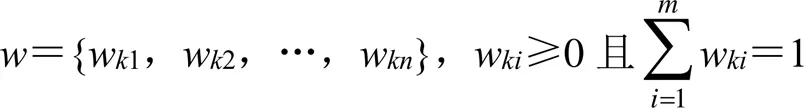
2.3 评价指标的评分等级标准的制定
体系中的指标,应避免或减少主观色彩的定性评价。有时,部分定性评价指标难以用具体数值衡量,不便于参与比较过程,缺乏直观性。因此,有必要数值化这些指标,以此达到量化效果,更好地在模型中发挥作用。第1步是基于参考语言变量,对列出的每一个指标,均赋予一个等级,用于表示评价程度。变量要满足方便性原则,因此,采用“好”“中等”“差”等语言字符反映不同指标的评价情况,表示该指标的等级;第2步则是把这3类字符转换成数字形式(量化),即三角模糊数,赋值原则如表2所示,共分为7类等级。由此,便可以利用量化的优势对指标进行具体的数值赋分,这极大地方便了后续研究。
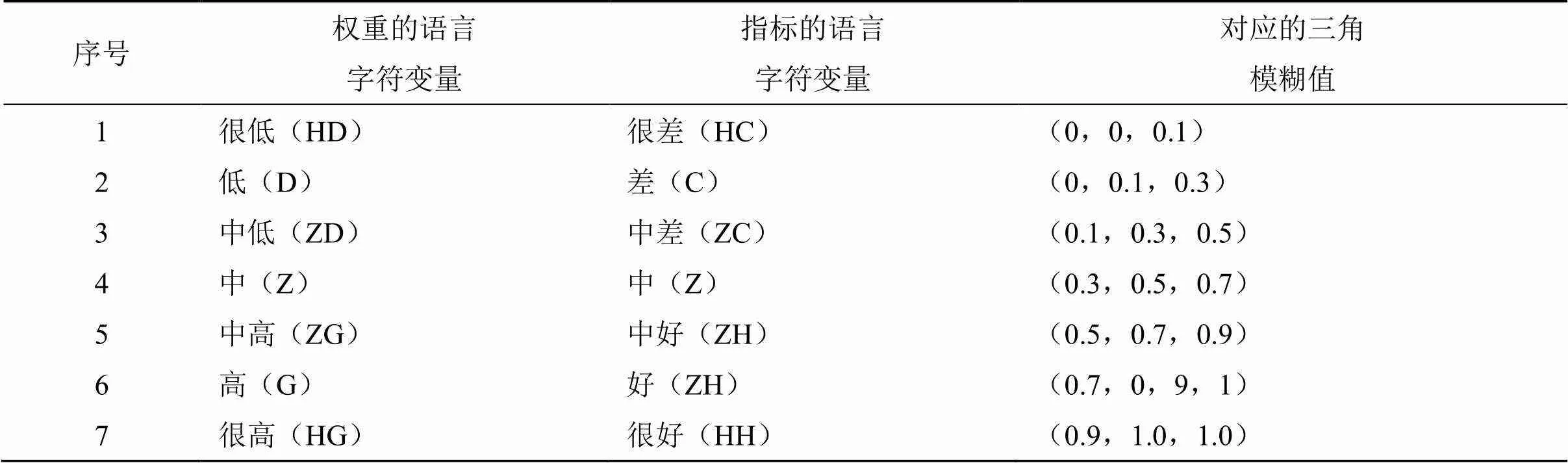
表2 被量化的7类语言字符对应的模糊值
2.4 中药监管影响因素评价样本矩阵的求解
请评价者筛选并组织相关专家。第1步:利用上文量化之后的7类数字化等级,请专家打分(参考表2),要求对表1中的每一个指标U,都要赋予等级值,由此产生了打分表格。第2步:引入评价向量(k),用于排列每个指标被赋予的等级值,这里(k)={1(k),2(k),…,w(k)};引入矩阵(k)= [p(k)]1×m用于评价指标;引入w(k)=(a(k),b(k),c(k))和p(k)=(α(k),β(k),γ(k)),目的是起到转换作用,实现语言字符语模糊值的转换工作。
专家们可参考表2,对每一个指标赋予等级值(打分)。参照上文特定的语言字符,结合关联的模糊值,开始数据转换工作,引入运算符“Ä”用于表征三角模糊值乘运算;引入运算符“⊕”用于表征模糊值的加运算。其中,评价者们(=1,2,…,)做出的指标等级值(权重)向量如(1)式所示;(2)式中表征了评价矩阵。
w=Ä{w(1)⊕w(2)⊕…⊕w(n)}=(a,b,c),=1,2,…,(1)
p=Ä{p(1)⊕p(2)⊕…⊕p(n)}=(α,β,γ),=1,2,…,(2)
上式中的三角模糊数的各个参数,可以由下式计算。






2.5 中药监管影响因素综合评价值的计算
2.5.1 计算中药监管影响因素的模糊综合评价值在(1)~(8)式中,专家们通过利用语言字符和特定的模糊值完成打分,各指标获得评价值。接下来计算模糊综合评价值,见公式(9)。
*=[1,2,…,p]Ä(1,2,…,w)(9)
2.5.2 计算中药监管影响因素的非模糊化综合评价值 经过(9)式的计算,得到模糊综合评价值,关联中药监管的影响因素。然而,三角模糊值不具备可视化功能,换言之,不便于进行数据群之间的比较和判别分析。基于此,继续对模糊值进行转换,并遵循量化、可视化原则。处理方法如下:
假定=(,,,)用于表征一个梯形模糊数,满足=()=(+++)/4。
用(,,)来表征三角模糊值,满足=(,,)。因此,式(10)和式(11)表示出了三角模糊数的非模糊价值量。
(w)=(a+2b+c)/4,=1,2,…,(10)
(p)=p=(α+2β+γ)/4,=1,2,…,(11)
对评价指标的权重进行标准化处理,处理过程如下。

通过三角模糊数的转化和计算,得到可用数值进行直观比较的权重向量=(1,2,…,w)和评价矩阵=[p]1×m,进一步计算,得到中药监管各影响因素的非模糊综合评价值。
=[1,2,…,p]Ä(1,2,…,w)(13)
3 算例与结果
在表1中,已建立完备的指标,完整地构建评价模型,用来评估中药监管的影响因素。接下来是算例过程,需要利用之前所构建的评价模型,基于药品全生命周期,对中药监管的指标进行评价,采用的方法为专家打分。确定评分等级,进行打分工作,赋予各指标特定的等级值(权重),此处用={1,2,3}表示选择的3位专家。表3用于详细描述专家们的打分情况。

表3 各指标对应的语言字符变量值的和有关的三角模糊值
表4是各指标的评价值,用于表征专家们对中药监管影响因素的评价情况。
表5描述了非模糊值,用于表征集结后的指标等级值与评价值。
基于以上考虑构建的评价模型,充分分析专家们对指标的评价值情况,计算出研制、生产、流通、使用4个指标的权重,分别为0.251、0.277、0.256、0.235。分析表5可以发现,专家认为生产环节最重要,其对中药监管的影响最大;其次是流通环节,再次是研制环节,最后是使用环节。
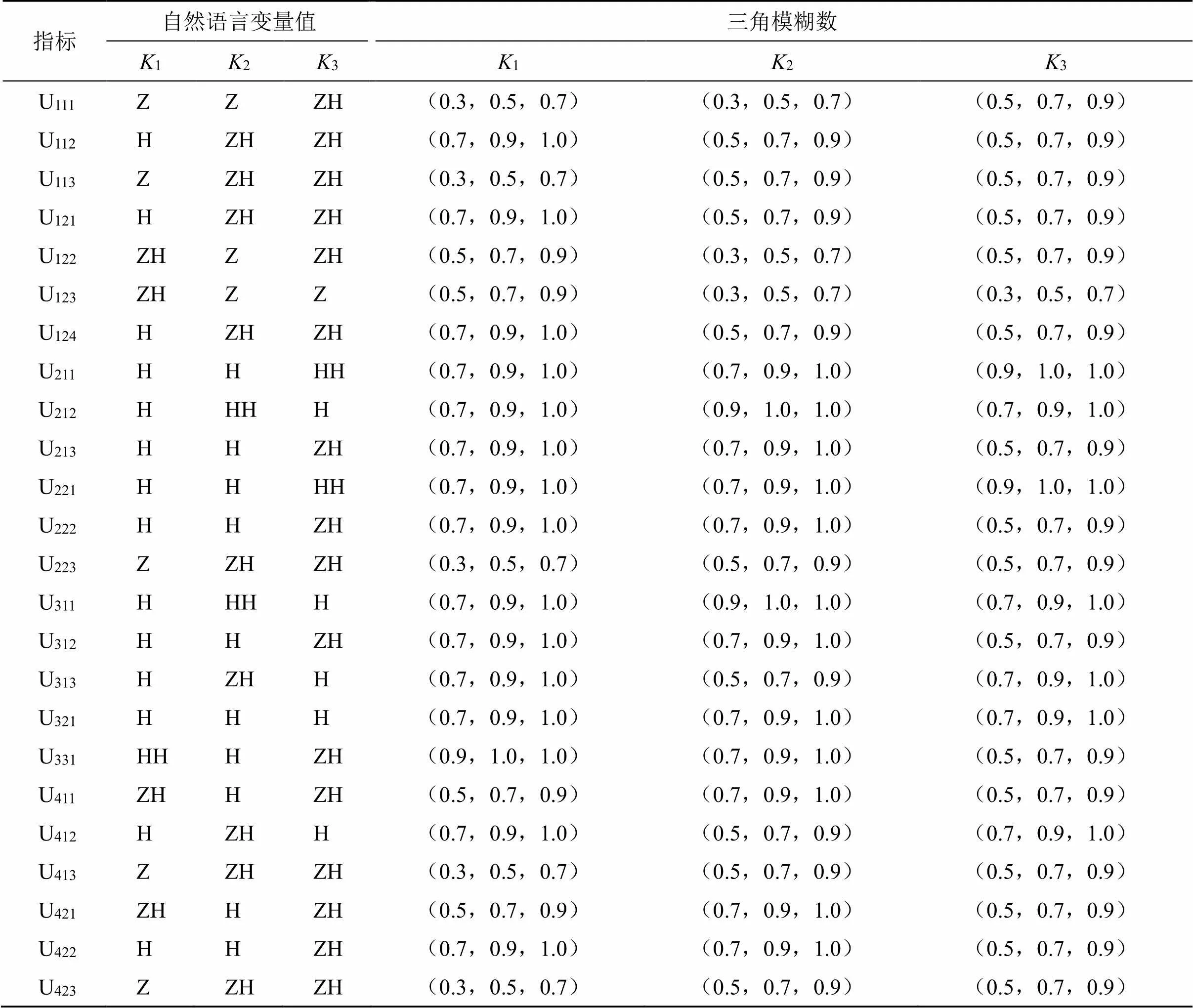
表4 指标因素的语言字符变量值和有关的三角模糊值
4 总结与建议
目前,我国学者对基于药品全生命周期的中药监管研究甚少。因此,今后的研究要在把握好科学性与合理性的前提下更加深入,继续做好中药监管的研究工作。同时,把握好与时俱进的原则,识别更多科学、合理的因素,构建更完备的中药监管指标体系。本文构建的模糊群决策模型,旨在服务于中药监管工作。依据算例综合分析可得:在全生命周期的大环境下,中药监管工作应该着力加强中药生产环节的监管,同时,再依次加强流通环节、研制环节、使用环节的监管。
由此,基于以上指标及模型结果,对中药研制、生产、流通、使用环节提出科学范式建议,监管部门可以针对不同的环节实施更合理地监管,进一步规范中药全生命周期的监管工作。
4.1 全面聚焦中药研制环节,构建科学审评证据体系
4.1.1 科学与实践并举,引领中药传承创新 长期以来,由于政策因素的影响比较大,导致中药研究注册环节的科学评估体系建设有所欠缺。中药药学研究工作需要科学与实践进行有机结合,药监部门必须要明确中药研发注册的基本情况和各地发展差异较大的现实情况,对于中药目前的短板问题和要害环节应该明晰,讲究“活”监管,监管方向与管理导向比具体技术要求更为重要。
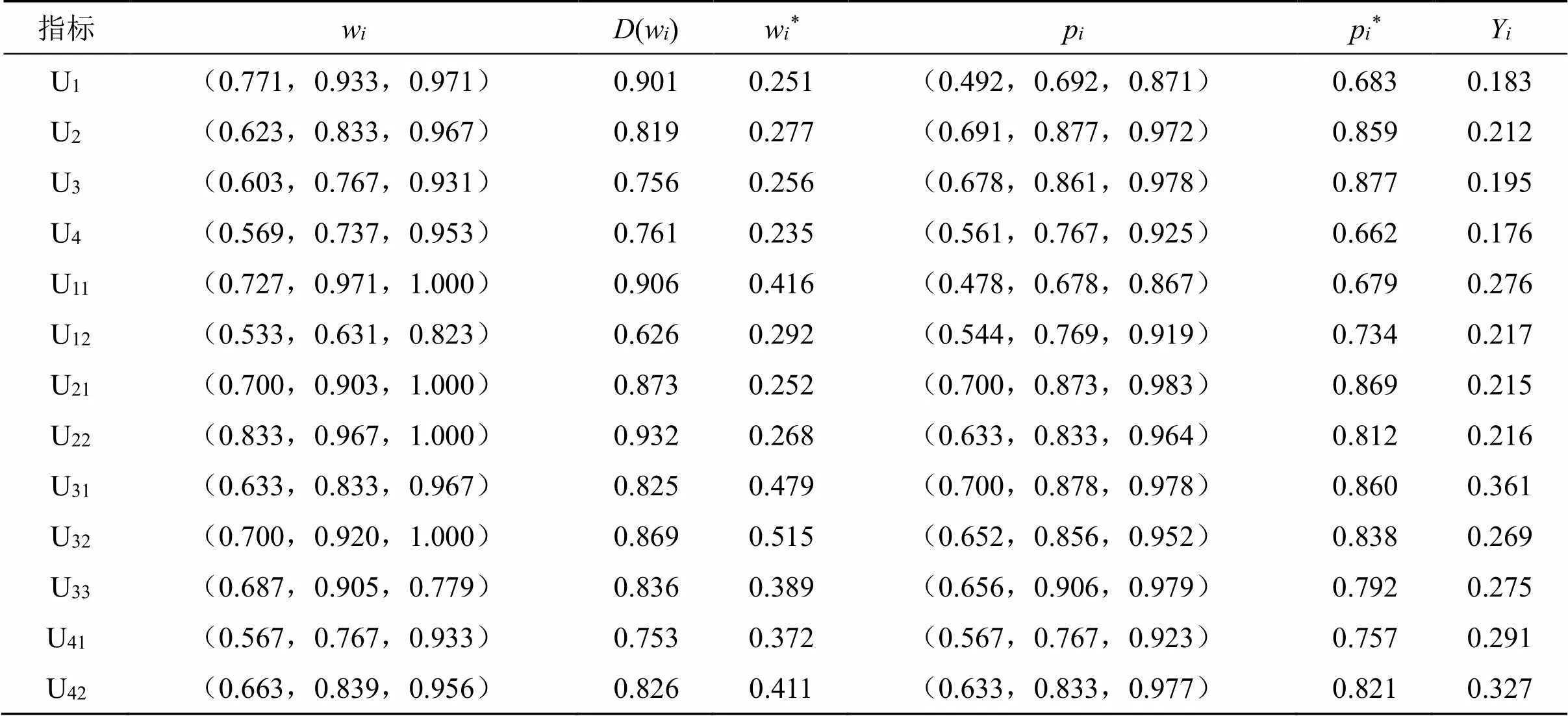
表5 指标权重及非模糊数(集结后)
4.1.2 构建“三结合”审评证据体系,提高中药注册质控水平 国家药品监督管理局于2020年12月正式发布了文件《关于促进中药传承创新发展的实施意见》,明确指出,要构建审评证据体系,即“三结合”:在中药有效性、安全性当中,要充分认识到人用经验的支持作用,要在遵循研发规律的同时,按照中药特点和实际情况,构建一套科学的审评证据体系,从而将临床试验、人用经验,以及中医药理论有机统一。同时,在运用人用经验的同时,也应规范和加强资料的整理工作,对于相关的申报资料,务必要规范填写[15]。
临床技术评价是所有中药审评环节中最为关键的一环,因此,应当着力开拓一套科学的审评证据体系,真正做到“三结合”。按照此体系进行中药注册申报,建议加强中药全生命周期的管理,关注临床试验与人用经验中暴露出来的安全性问题,如不良反应发生率、高风险人群的既往人用经验安全性数据等问题[4],充分贯彻落实“三结合”审评证据体系。
4.2 加快推进中药质量体系建设,赋能中药生产全过程质量监管
4.2.1 强化生产质量管理体系,为中药材质量全面把关 中药生产管理体系关键环节包括中药种子繁殖材料、栽培过程、加工炮制、包装、贮存和运输、人员和设施、产品检测等方面。因此,从中药生产过程质量管理及监督检查管理层面对中药质量进行全面监管,覆盖中药原材料端、中间产品及终端产品全关键环节的质量监管,保障中药质量提升。
与此同时,根据国内实际并参照国际标准对药品安全性的规定,制定出与国内外市场接轨的质量标准,为监管提供依据,以严格规范中药材、中药饮片、中药原料保健品和食品、中成药质量认证和产品溯源,提高中药的生产管理水平及质量。
4.2.2 落实企业主体责任,推动中药产业高质量发展 引导中药企业在药材种植养殖过程、中药饮片、中成药及中药原料保健品和食品生产加工过程中,将全过程质量管理纳入企业管理体系,落实中药生产企业主体责任。强化第3方认证管理,针对原材料及药材、生产工艺、中药产品等方面进行全面认证,在中药全生命周期中,要把控各环节的质量监管,提升品牌竞争力。
同时,应加强从业人员的技术培训,强化科研成果转化应用及新生产工艺的优化及提升。中药质量管理体系应强化生产过程控制管理,相关质量指标检验检测及中药关键生产环节质量标准的制定及发布。通过落实中药企业主体责任,引导企业构建完善的内部质量管理体系,结合第3方质量检测与认证评价、对认证品种进行全程溯源管理,强化政府各部门协同监管机制,完善品质中药全链条监管检查体系,推动中药产业高质量发展。
4.3 多部门协同监管,完善中药流通监管机制
4.3.1 完善多部门协同监管机制,构建全链条监管检查体系 要完善监管机制,便于政府多个部门之间的协同监管工作。建立起完备的追溯体系,服务于中药饮片、中药材、中药原料保健品、中成药等生产、流通、使用全过程。要采用抽检、飞行检查、常规检查等监管方式,构建完备的检查体系,服务于全链条监管,推动我国中医药产业良性生长,不断突破,以实现高质量发展[16]。
同时,可以应用质量源于设计的方法,夯实流通运输全过程的风险控制能力和质量管理水平,实现在中药运输流通管理、第三方电子医药专业物流等各个环节过程中的有效质量监管。要转变质量管理模式理念,对于质量管理,将质量管理模式从“全面”转变到“全产业链”,提高中药运输流通全过程的质量风险控制。
4.3.2 治理虚假广告,营造健康大环境 2017年底的鸿茅药酒案,由于虚假广告的迷惑,公众未意识到其非处方药的性质,误以为是保健食品,因而大肆购买,造成多例不良反应事件,危害公众健康。因此,对于虚假有诱惑性的广告,应撕开其过度宣传的面纱,严惩此类事件。要制定严格、规范性的文件,务必加强对媒体广告的监管幅度和频度,及时制止和严惩虚假行为,营造健康大环境[7]。
4.4 关注合理用药,加强中药上市后监测
4.4.1 提升合理用药能力,高质量满足公众用药需求 中药的使用涉及范围广且环节较多,不合理用药具体表现在配伍禁忌、处方错误、饮片质量不理想、未执行脚注等现象。不合理用药会严重扰乱临床作用效果,危及患者的生命安全。
新规下发,医药行业迎较大利好。2021年7月28日,国家卫健委办公厅正式发布《关于规范开展药品临床综合评价工作的通知》,同时,《药品临床综合评价管理指南(2021年版试行)》作为附件一同下发[17]。该《指南》正式颁布将有利于引导和促进相关主体按照规定严格依据药品临床综合评估,持续促进药品临床综合评估工作的标准化、规范性、科学化、同质性,更好地满足国家对药品的政策需求点,提升药事服务水准,保障医疗机构临床基础用药供给与规范使用,控制不合理药品费用支出,更高质量满足人民群众用药需求。
使用单位应当通过定期考核、培训等方法,促进中药使用质量的提高;建立质量监督、管理小组,由组长负责检查处方,进行相应审核;进一步复查、监督管理相关人员书写的处方,并将具体用量、用法和注意事项等标记清楚,确保用药安全性,提高服务质量[6]。
4.4.2 聚焦中药不良反应监测,构建完备的监测评价体系 目前中药系统性大样本研究数据仍待进一步完善。为加强中药监管,在临床用药中贯彻安全性的思想,应在现有不良反应监测体系下,探索构建中药饮片/中药配方颗粒等监测评价体系,中药生产企业应履行其持有人义务,主动收集不良反应。同时,对于使用中药的医疗机构,应当拓宽不良反应收集渠道并加强与生产企业共享不良反应信息,做到实时监控。促使生产企业更加重视产品的安全性、有效性,不断完善产品的质量以及标准,促进行业高质量发展。
利益冲突 所有作者均声明不存在利益冲突
[1] 国家药品监督管理局. 中华人民共和国药品管理法[EB/OL]. (2019-08-27). https://www.nmpa.gov.cn/xxgk/ fgwj/flxzhfg/20190827083801685.html.
[2] 国家药品监督管理局. 国家药监局国家中医药局国家卫生健康委国家医保局关于结束中药配方颗粒试点工作的公告(2021年第22号) [EB/OL]. (2021-02-10). https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20210210145856159.html.
[3] 崔鑫, 王连心, 刘光宇, 等. 国际药物警戒体系对中药药物警戒体系建立的启示[J/OL]. 中国中药杂志: 1-7 [2021-08-20]. http://kns.cnki.net/kcms/detail/11.2272.R. 20210727.1428.005.html.
[4] 安娜, 韩玲. 中药新药临床试验报告安全性分析方面的常见问题[J/OL]. 中国中药杂志: 1-5 [2021-07-28]. https://doi.org/10.19540/j.cnki.cjcmm.20210407.501.
[5] 魏锋, 马双成. 中药材饮片质量安全概况及监管思考 [J]. 中国食品药品监管, 2019(3): 22-29.
[6] 赖丽萍, 彭连共. 探讨强化中药调剂监管在减少中药房不良事件和差错事件中的临床应用价值 [J]. 当代医学, 2021, 27(8): 80-82.
[7] 赵迪, 郭东辉, 张思文, 等. 我国中药流通中存在的问题及对策研究 [J]. 中国市场, 2019(16): 130.
[8] 李慧, 牟蓉. 我国中药相关政策法规的发展现状与解析 [J]. 中医药管理杂志, 2019, 27(11): 5-8.
[9] 刘晴晴, 冉晔, 王萍, 等. 我国中药追溯法律规制研究 [J]. 中国卫生法制, 2021, 29(2): 38-41.
[10] 宋鑫, 吴剑, 蒋维晏, 等. 基于全生命周期管理的中药饮片质量提升研究 [J]. 光明中医, 2021, 36(7): 1173-1177.
[11] 郑文科, 金鑫瑶, 张俊华, 等. 基于全生命周期理念的中药安全性真实世界研究模式 [J]. 世界中医药, 2019, 14(12): 3111-3114.
[12] 孟锐. 药事管理学[M]. 第4版. 北京: 科学出版社, 2016: 157-158.
[13] 李耿, 李振坤, 杨洪军, 等. 中成药价值与风险多维评价模型构建 [J]. 中国中药杂志, 2021, 46(5): 1284-1292.
[14] 储甜甜. 中药流通环节安全监管问题及对策研究[D]. 济南: 山东中医药大学, 2014.
[15] 国家药品监督管理局. 国家药监局关于促进中药传承创新发展的实施意见(2020年第27号) [EB/OL]. [2020-12-25]. https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/ gzwjy/20201225163906151.html.
[16] 董林林, 段永刚, 汪波, 等. 品质中药的管理体系及发展策略[J/OL]. 中国中药杂志: 1-8 [2021-07-29]. https://doi.org/10.19540/j.cnki.cjcmm.20210713.601.
[17] 国家卫生健康委员会办公厅. 国家卫生健康委办公厅关于规范开展药品临床综合评价工作的通知 (2021年第16号) [EB/OL]. (2021-07-28). http://www.nhc.gov. cn/yaozs/s2908/202107/532e20800a47415d84adf3797b0f4869.shtml.
Research on construction of traditional Chinese medicine supervision model based on drug life cycle
HUANG Zhe1, 2, ZHAO Xiang-qi1, LIN Xue-yi1, XU Feng-xiang2
1. College of Business Administration, Shenyang Pharmaceutical University, Shenyang 110016, China 2. Research Institute of Drug Regulatory Science Shenyang Pharmaceutical University, Shenyang 110016, China
With the official addition of the drug marketing authorization holder (MAH) system, the scientific action plan for drug supervision and the official implementation of the announcement on ending the pilot work of traditional Chinese medicine formula granules in the drug administration law of 2020, it marks that traditional Chinese medicine has officially entered the era of full life cycle supervision. At present, China has not yet established a full life cycle traditional Chinese medicine supervision system in line with the laws and development characteristics of traditional Chinese medicine, the curative effect of traditional Chinese medicine products is unstable, and the safety and use effectiveness of traditional Chinese medicine products in China are difficult to obtain the attention and recognition of the international market. Therefore, it is urgent to establish a full life cycle supervision system of traditional Chinese medicine and strengthen the scientific supervision of traditional Chinese medicine to promote its high-quality development. Combined with the pain points and blocking points of the actual supervision of the whole life cycle of traditional Chinese medicine in China, this paper puts forward the indicators of development, production, circulation and use, constructs a scientific evaluation system of the whole life cycle supervision of traditional Chinese medicine, and uses the evaluation method based on Fuzzy Group decision-making to scientifically evaluate various factors, in order to standardize the whole life cycle supervision of traditional Chinese medicine and promote the quality standard of traditional Chinese medicine in line with international standards.
drug administration law; full life cycle; supervision of traditional Chinese medicine; fuzzy group decision making; evaluating indicator; quality control
R285
A
0253 - 2670(2021)17 - 5465 - 10
10.7501/j.issn.0253-2670.2021.17.038
2021-07-30
2020年辽宁省高等学校创新人才支持计划;沈阳市2020年度科技人才项目(RC200498);辽宁省自然科学基金资助项目(2020- MS-194);沈阳药科大学中青年教师事业发展支持计划(ZQN2018010);沈阳药科大学药品监管科学研究院专项基金资助(2021jgkx005);2020年度辽宁省科学事业公益研究基金(2020JH4/10100018);辽宁省教育厅重点项目(2019WZD02)
黄 哲(1978—),女,教授,博士,博士生导师,主要从事决策理论与方法、药品监管科学的研究。Tel: (024)23986542 E-mail: huangzhe2000@sina.com
徐凤翔(1962—),男,沈阳药科大学党委书记,教授,博士,主要从事高校教育管理、管理学的研究。E-mail: 635687334@qq.com
[责任编辑 郑礼胜]

