多西他赛联合顺铂治疗晚期肺腺癌患者的临床疗效及其对免疫功能的影响
付茂月,雷开键,贾钰铭,陈洁,舒艳玲
肺癌是世界范围内常见的恶性肿瘤之一,病死率位居恶性肿瘤首位[1]。非小细胞肺癌(NSCLC)发病率占所有肺癌患病人数的80%,其中肺腺癌占50%[2]。肺腺癌较易发生远处转移,常见转移部位有淋巴结、肝、骨、脑和肾上腺等[3]。肺腺癌的发生发展与多种细胞基因表达和生物过程相关,而基因的异常表达与多种酶活性、受体或离子通道等功能相关,可参与细胞周期、增殖、黏附及细胞外基质形成、免疫和炎症反应等过程,这也是导致肺腺癌细胞易脱落、易侵袭和免疫逃逸的原因[4]。顺铂化疗是晚期肺腺癌患者的主要治疗方案,其可延长患者的生存时间、提高生活质量[5]。多西他赛是肺腺癌的二线标准化治疗方案,其具有促进微管聚合的作用,并可抑制微管解聚,从而使细胞分裂停留在G2/M期,阻止肿瘤细胞有丝分裂[6-7]。本研究旨在探讨多西他赛联合顺铂治疗晚期肺腺癌患者的临床疗效及其对免疫功能的影响,以期为临床治疗提供参考,现报道如下。
1 资料与方法
1.1 一般资料 选取宜宾市第二人民医院2014年3月—2020年3月收治的晚期肺腺癌患者120例,均经病理组织学和细胞学确诊为肺腺癌,并根据《中国原发性肺癌诊疗规范(2015年版)》[8]确定其TNM分期为Ⅲ~Ⅳ期。纳入标准:(1)无手术指征或不愿意放疗;(2)血常规、肝肾功能和心电图检查正常;(3)预计生存时间>3个月;(4)既往未接受过放化疗;(5)本次化疗时间≥2个周期。排除标准:(1)患有其他恶性肿瘤者;(2)同时接受其他抗肿瘤药物治疗者。采用随机数字表法将所有患者分为观察组和对照组,各60例。观察组中男38例,女22例;年龄32~76岁,平均年龄(56.5±6.3)岁;TNM分期:Ⅲ期36例,Ⅳ期24例。对照组中男36例,女24例;年龄31~78岁,平均年龄(54.5±7.2)岁;TNM分期:Ⅲ期34例,Ⅳ期26例。两组患者性别(χ2=0.141)、年龄(t=1.619)、TNM分期(χ2=0.137)比较,差异无统计学意义(P>0.05)。本研究经宜宾市第二人民医院医学伦理委员会审核批准,患者对本研究知情并签署知情同意书。
1.2 方法 两组患者均给予止吐、抑制胃酸分泌的药物以减轻胃肠道的不良反应,并给予保肝药物,充分水化顺铂以减轻肾毒性。化疗前及每个化疗周期的第8、15天检测患者血常规、肝肾功能及心电图。
对照组患者采用紫杉醇(哈药集团生物工程有限公司生产,国药准字H20059962)联合顺铂(齐鲁制药有限公司生产,国药准字H37021362)治疗,即在患者化疗第1天,静脉滴注紫杉醇135 mg/m2;第1~3天,静脉滴注顺铂25 mg/m2。观察组患者采用多西他赛(浙江海正药业股份有限公司生产,国药准字H20093092)联合顺铂治疗,即在患者化疗第1天,静脉滴注多西他赛75 mg/m2;第1~3天,静脉滴注顺铂25 mg/m2。两组患者均以21 d为1个化疗周期,持续化疗2个周期。
1.3 观察指标
1.3.1 临床疗效 比较两组患者的临床疗效,参照实体瘤治疗疗效标准将临床疗效分为完全缓解(CR):患者治疗后持续4周的影像学检查显示病灶完全消失;部分缓解(PR):患者治疗后病灶减少>50%,且持续4周无新发病灶;稳定(SD):患者治疗后病灶减小<50%或增大<25%,且未出现新发病灶;进展(PD):病灶增大>25%或出现新发病灶[9]。
1.3.2 癌因性疲乏程度 采用癌因性疲乏量表(CFS)评价两组患者治疗前后癌因性疲乏程度,该量表内容包括躯体疲乏、情感疲乏和认知疲乏,总分60分,分数越高表明患者癌因性疲乏程度越高。
1.3.3 肿瘤标志物 将患者血清和辣根过氧化物酶(HRP)加入固相包被有抗体的微孔板中,待测分子与HRP的结合物和固相载体上的抗体特异性结合后,加入鲁米诺Luminol发光底液,通过计算各孔的光子数和数学模型定量分析待测分子。应用全自动电化学发光免疫分析仪检测两组患者治疗前后癌胚抗原(CEA)、神经元特异性烯醇化酶(NSE)和细胞角蛋白19片段(CYFRA21-1)。
1.3.4 免疫功能指标 应用流式细胞分析仪检测两组患者治疗前后CD3+细胞分数、CD4+细胞分数、CD8+细胞分数和自然杀伤(NK)细胞分数。
1.3.5 毒副作用及1年存活率 治疗过程中观察两组患者毒副作用发生情况,毒副作用评价标准参照WHO抗癌药物常见毒副作用分级标准,包括骨髓抑制(中性粒细胞减少、血小板减少)、胃肠道反应(恶心、呕吐)、脱发。随访1年,计算两组患者1年存活率。
1.4 统计学方法 应用SPSS 20.0统计软件进行数据处理。计量资料以(x± s)表示,两组间比较采用两独立样本t检验;计数资料以相对数表示,组间比较采用χ2检验;等级资料比较采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效 观察组患者临床疗效优于对照组,差异有统计学意义(u=3.304,P=0.001),见表1。

表1 两组患者临床疗效〔n(%)〕Table 1 Clinical effect in the two groups
2.2 癌因性疲乏程度 两组患者治疗前躯体疲乏评分、情感疲乏评分、认知疲乏评分、CFS总分及治疗后躯体疲乏、情感疲乏、认知疲乏评分比较,差异无统计学意义(P>0.05);观察组患者治疗后CFS总分低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者治疗前后CFS评分比较(±s,分)Table 2 Comparison of CFS score between the two groups before and after treatment
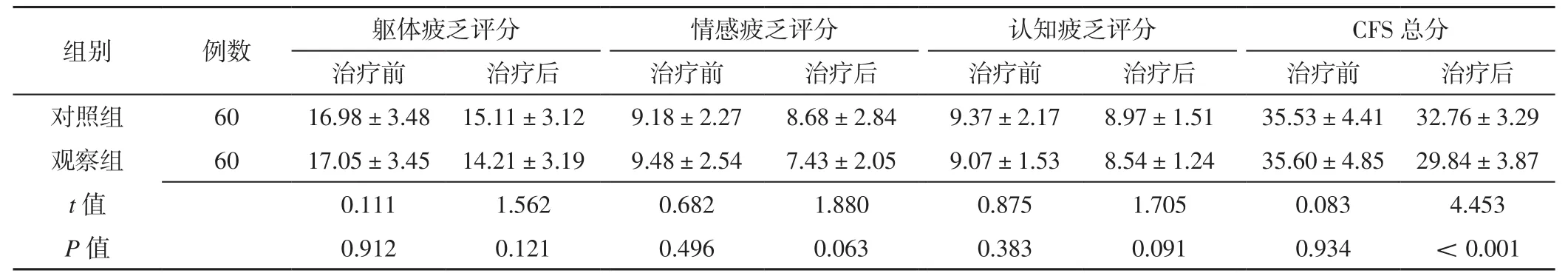
表2 两组患者治疗前后CFS评分比较(±s,分)Table 2 Comparison of CFS score between the two groups before and after treatment
注:CFS=癌因性疲乏量表
组别 例数 躯体疲乏评分 情感疲乏评分 认知疲乏评分 CFS总分治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 60 16.98±3.48 15.11±3.12 9.18±2.27 8.68±2.84 9.37±2.17 8.97±1.51 35.53±4.41 32.76±3.29观察组 60 17.05±3.45 14.21±3.19 9.48±2.54 7.43±2.05 9.07±1.53 8.54±1.24 35.60±4.85 29.84±3.87 t值 0.111 1.562 0.682 1.880 0.875 1.705 0.083 4.453 P值 0.912 0.121 0.496 0.063 0.383 0.091 0.934 <0.001
2.3 肿瘤标志物变化情况 两组患者治疗前CEA、NSE和CYFRA21-1水平比较,差异无统计学意义(P>0.05);观察组患者治疗后CEA、NSE和CYFRA21-1水平低于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者治疗前后CEA、NSE和CYFRA21-1水平比较(±s,ng/L)Table 3 Comparison of CEA,NSE and CYFRA21-1 levels between the two groups before and after treatment
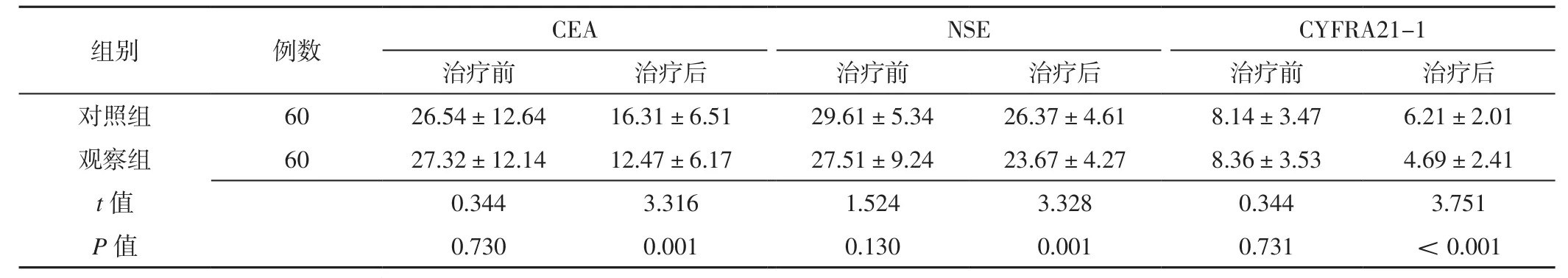
表3 两组患者治疗前后CEA、NSE和CYFRA21-1水平比较(±s,ng/L)Table 3 Comparison of CEA,NSE and CYFRA21-1 levels between the two groups before and after treatment
注:CEA=癌胚抗原,NSE=神经元特异性烯醇化酶,CYFRA21-1=细胞角蛋白19片段
组别 例数 CEA NSE CYFRA21-1治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 60 26.54±12.64 16.31±6.51 29.61±5.34 26.37±4.61 8.14±3.47 6.21±2.01观察组 60 27.32±12.14 12.47±6.17 27.51±9.24 23.67±4.27 8.36±3.53 4.69±2.41 t值 0.344 3.316 1.524 3.328 0.344 3.751 P值 0.730 0.001 0.130 0.001 0.731 <0.001
2.4 免疫功能指标变化情况 两组患者治疗前CD3+、CD4+、CD8+、NK细胞分数比较,差异无统计学意义(P>0.05);观察组患者治疗后CD3+、CD4+、CD8+、NK细胞分数高于对照组,差异有统计学意义(P<0.05),见表4。
表4 两组患者治疗前后免疫功能指标比较(±s,%)Table 4 Comparison of immune function indexes between the two groups before and after treatment

表4 两组患者治疗前后免疫功能指标比较(±s,%)Table 4 Comparison of immune function indexes between the two groups before and after treatment
注:NK=自然杀伤
+细胞分数 NK细胞分数治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 60 62.21±8.44 66.54±4.61 33.27±4.27 35.82±4.71 22.17±5.41 25.87±3.84 15.21±5.34 18.11±4.46观察组 60 63.07±7.24 69.67±4.71 34.78±5.34 38.71±4.27 23.47±6.53 30.64±5.43 15.98±4.07 20.64±4.23 t值 0.599 3.678 1.711 3.521 1.187 5.555 0.888 3.188 P值 0.550 <0.001 0.090 <0.001 0.237 <0.001 0.376 0.001组别 例数 CD3+细胞分数 CD4+细胞分数 CD8
2.5 毒副作用发生情况及1年存活率 观察组患者毒副作用发生率为43.3%(26/60),低于对照组的66.7%(40/60),差异有统计学意义(χ2=6.599,P=0.010),见表5。观察组患者1年存活率为46.7%(28/60),与对照组的33.3%(20/60)比较,差异无统计学意义(χ2=2.222,P=0.136)。
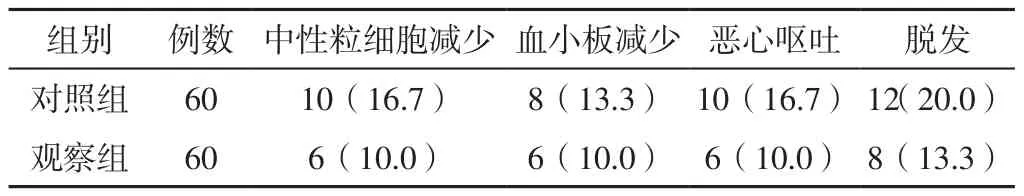
表5 两组患者治疗期间毒副作用发生情况〔n(%)〕Table 5 Incidence of toxic and side effects of the two groups during treatment
3 讨论
晚期肺腺癌患者癌细胞多已发生转移,累及多个脏器或组织,失去了手术治疗的最佳时机,因而患者多考虑采用化疗、放疗或介入治疗[10]。晚期癌症的治疗目的在于减轻患者疾病负担,延长患者寿命,提高生活质量[11]。目前,临床治疗晚期肺腺癌患者多采用以铂类为主的抗癌药物,但较易出现多种毒副作用,达不到预期的治疗效果。
多西他赛是一种广谱抗癌药物,主要通过破坏肿瘤细胞周期而起到抗肿瘤作用,其作用机制类似于紫杉醇,但其在细胞内的作用时间及浓度高于紫杉醇[12]。多西他赛进入细胞后可作用于微管蛋白,可促使微管蛋白聚合,形成无功能性微管,进而影响纺锤体功能,阻碍肿瘤细胞的有丝分裂,进而抑制肿瘤细胞增殖[13]。国外学者ROSZMOWSKI等[14]研究表明,多西他赛能提高NSCLC患者的生活质量,延长其生存时间。JIANG等[15]研究发现,多西他赛联合卡铂治疗NSCLC患者的1、2年存活率分别为46.5%、20.0%,常见毒副作用主要为骨髓抑制,但均在患者耐受范围内。顺铂是第一代铂类络合物,具有广谱抗肿瘤作用,其中的铂原子能交联在DNA链上,抑制肿瘤细胞DNA复制和转录,导致DNA链无法形成,进而破坏细胞的有丝分裂[16]。PUJOL等[17]进行的Meta分析结果显示,采用含铂类药物治疗NSCLC患者可降低1年死亡风险。本研究结果显示,对照组患者1年存活率为33.3%,观察组为46.7%,与既往文献报道相似[14-15],两组患者1年存活率比较差异无统计学意义,可能与本研究纳入样本量较小有关。
晚期肺腺癌患者常表现为身体疲乏、情绪低落、思维模糊等癌因性疲乏,CFS可较准确地反映患者的癌因性疲乏程度。本研究结果显示,观察组患者临床疗效优于对照组,CFS总分低于对照组,表明多西他赛联合顺铂治疗晚期肺腺癌患者的临床疗效确切,且可有效减轻癌因性疲乏程度。
肿瘤标志物多存在于肿瘤体内,脱落后可进入血液,其中CEA与肿瘤分期有关,CEA水平升高表明疾病进展快,患者生存时间短,可间接反映患者的治疗效果[18]。NSE主要存在于人体的神经组织中,是一种糖代谢酶,与神经损伤性疾病相关[19]。有研究表明,NSCLC患者NSE水平较高[20]。CYFRA21-1是晚期肺腺癌患者预后的独立预测标志物,主要存在于肿瘤细胞内,由肿瘤细胞释放入血[21]。本研究结果显示,观察组患者治疗后CEA、NSE和CYFRA21-1水平低于对照组,表明多西他赛联合顺铂治疗可有效抑制晚期肺腺癌患者病情进展,减轻神经损伤。T淋巴细胞亚群具有抵抗病毒、调节机体免疫功能的作用,其中CD3+细胞是总的人体成熟T淋巴细胞;CD4+细胞是一种辅助细胞,可反映机体免疫功能;CD8+细胞是细胞毒性T淋巴细胞,而NK细胞与抗肿瘤作用有关[22]。本研究结果显示,观察组患者治疗后CD3+、CD4+、CD8+、NK细胞分数高于对照组,表明多西他赛联合顺铂可有效增加晚期肺腺癌患者T淋巴细胞亚群,进而提高机体免疫功能。化疗的主要毒副作用包括骨髓抑制、胃肠道反应和脱发等,本研究结果显示,观察组患者毒副作用发生率低于对照组,表明多西他赛联合顺铂治疗晚期肺腺癌患者可减少毒副作用,较易被患者接受。
综上所述,多西他赛联合顺铂治疗晚期肺腺癌患者的临床疗效确切,可有效提高患者免疫功能,抑制病情进展,减少毒副作用。但本研究仍存在一定不足:本研究纳入样本量较小、随访时间短,且为单中心研究,导致结果可能存在偏倚,今后可扩大样本量、延长随访时间联合多中心进一步验证本研究结论。
作者贡献:付茂月、雷开键进行文章的构思与设计;舒艳玲进行研究的实施与可行性分析,论文的修订;雷开键、贾钰铭、陈洁进行数据收集、整理、分析;付茂月进行结果分析与解释,撰写论文;雷开键负责文章的质量控制及审校,并对文章整体负责、监督管理。
本文无利益冲突。

