茶小绿叶蝉成虫唾液细菌蛋白的鉴定
潘 铖, 钮羽群, 夏露霞, 伍春芳, 景凯婷,程墙义, 王梦馨, 韩宝瑜,*
(1. 中国计量大学生命科学学院, 浙江省生物计量及检验检疫技术重点实验室, 杭州 310018;2. 安徽农业大学植物保护学院, 合肥 230000)
在昆虫进化的生命历程中,其体内的共生菌扮演着不可替代的作用,能帮助宿主昆虫更好地进行营养摄取、生长发育、解毒、天敌防御和免疫应答等生命活动(谭周进等, 2005; Engel and Moran, 2013)。刺吸式口器昆虫,因仅能取食木质部、韧皮部的汁液,极易造成取食营养结构不平衡,其生命活动部分营养功能需依靠共生菌分泌纤维素等碳水化合物酶来维持(Anandetal., 2010; Xueetal., 2014; Douglas, 2015)。唾液作为昆虫和植物之间互作的基础性物质,在互作中起着复杂且重要的作用,有研究指出唾液中含有的共生菌来源于与口针相连的唾液管道(唾液腺)和食物管道(肠道)(殷海娣等, 2006; 王雪丽等, 2016; 尚哲明等, 2019; Xuetal., 2019)。烟粉虱Bemisiatabaci唾液腺中被发现存在共生细菌(立克次氏体Rickettsia)(Bruminetal., 2012);张瑛等(2015)以斑透翅蝉Hyalessamaculaticollis唾液腺为对象,利用16S rRNA序列分离鉴定了变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)的7种细菌。直接以唾液为研究对象,唐明等(2014)分离鉴定发现褐飞虱Nilaparvatalugens唾液分泌物中存在4种γ变形菌纲和2种β变形菌纲细菌;苗雨桐等(2017)从褐飞虱成虫水状唾液鉴定出属于变形菌门、放线菌门和厚壁菌门的22种细菌。可见唾液中存在部分昆虫共生菌,并可能参与宿主昆虫与植物的互作机制。
茶小绿叶蝉Empoascaflavescens是我国茶区严重发生的害虫,该害虫种群密度较大,繁殖能力强,极难防治;为害后茶树嫩梢变红、卷曲,严重影响名优茶的色、香、味和形等品质特征,制约茶叶的产量。几十年以来依赖化学防治,已致使茶小绿叶蝉对啶虫脒和联苯菊酯的抗药性达高抗水平,对吡虫啉达中抗水平;同时业内估计每年茶园中40%的施药量被用于防治茶小绿叶蝉(庄家祥等, 2009)。随着高通量测序技术、宏基因组学和蛋白质组学等技术的发展,借助新技术分析成为趋势。刘小改等(2016)和王天召等(2019)分别利用高通量测序分析稻纵卷叶螟Cnaphalocrocismedinalis和褐飞虱肠道细菌,分别得到604和235个分类单元;毛迎新等(2018)利用高通量测序分析了5个地理种群的茶小绿叶蝉成虫体内共生细菌种类,共鉴定41门116纲105种细菌。目前还没有叶蝉唾液细菌蛋白的研究报道。本研究以茶小绿叶蝉成虫唾液的细菌蛋白为切入点,采用液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry, LC-MS/MS)蛋白分析法鉴定唾液中细菌蛋白,为叶蝉细菌蛋白研究和其在昆虫取食、致害和解毒等生命过程的作用提供理论基础。
1 材料与方法
1.1 供试昆虫
实验所用的茶小绿叶蝉来自浙江省湖州市安吉县的露天茶园(安吉白茶品种),饲养于人工气候室(温度26±1℃,相对湿度65%±5%,光周期14L∶10D)内,仍用采集的安吉白茶茶枝饲养。
1.2 唾液收集
茶小绿叶蝉水状唾液的收集方法使用的是Parafilm膜夹营养液法(图1)。首先使用Parafilm膜在玻璃管(玻璃管两头开口,管口内径5.5 cm,高为10.0 cm,管壁均匀分布小孔用于透气)的一端制作叶蝉取食装置,将第1层Parafilm膜均匀拉开到适宜薄度覆盖于玻璃管一端,使用移液枪吸取3 mL 5%无菌蔗糖溶液添加于膜中间,再将薄度一致的第2层膜覆盖其上,排出气泡将液体锁定于两膜之间,最后在最外部添加第3层相对较厚的保护膜。从玻璃管另一端将20头经过1 h饥饿处理的叶蝉成虫放入,以湿润的纱布封口。根据上述方法依次制作相同的唾液收集装置,排列于透气网盒中,确保取食装置位于上端,略微倾斜,转移至人工气候室(温度26±0.5℃,相对湿度65%±5%,光周期14L∶10D)内。待叶蝉取食24 h后,使用无菌注射器穿刺收集被取食过的蔗糖溶液,储存于-80℃的超低温冰箱。共收集6 000头叶蝉取食过的蔗糖溶液。

图1 叶蝉唾液收集装置示意图Fig. 1 Schematic diagram of cicada saliva collection device
1.3 唾液蛋白浓缩与酶解
使用超滤方式进行浓缩。首先加入等体积SDS-Tris(2% SDS, 10 mmol/L Tris-HCl, pH 8.0)裂解液,混匀后沸水浴10 min;用3 kD的超滤离心管浓缩收集的样品,浓缩至终体积200 μL;然后在浓缩样品中加入适量SDT溶液(4% SDS, 100 nmol/L DTT, 150 mmol/L Tris-HCl, pH 8.0),沸水浴15 min后18 000 g室温离心15 min,收集上清液;取20 μL样品上样,聚丙烯酰胺凝胶电泳(SDS-PAGE),染色;最后采用BCA法进行蛋白质定量,分装样品,储存于-80℃的超低温冰箱。
使用膜辅助样品制备技术法(filter-aided sample preparation, FASP)对蛋白进行酶解(Winiewskietal., 2009)。取100 μg蛋白质溶液,加入二硫苏糖醇(DTT)至终浓度为100 mmol/L。沸水浴5 min后冷却至室温。加入200 μL的UA Buffer(0.1 mol/L Tri-HCl含8 mol/L尿素, pH 8.5)混匀,转移至超滤离心管中,14 000 g 离心15 min,弃废液,重复一次。加入100 μL的IAA Buffer(100 mmol/L IAA溶解于UA Buffer),600 r/min振荡1 min,室温避光反应30 min,14 000 g离心15 min。加入100 μL UA Buffer, 14 000 g离心15 min,重复2次。加入100 μL NH4HCO3(25 mmol/L)溶液,14 000 g离心15 min,重复两次。加入40 μL Trypsin Buffer(2 μg Trypsin溶于40 μL 100 mmol/L NH4HCO3溶液中),600 r/min振荡1 min,37℃放置16~18 h。换新收集管,14 000 g离心15 min;再加入40 μL NH4HCO3(25 mmol/L),14 000 g离心15 min,收集滤液。采用C18 Cartridge对肽段进行脱盐,肽段冻干后加入40 μL浓度为0.1%甲酸溶液复溶,最后对肽段定量(测定OD280值)。
1.4 LC-MS/MS蛋白分析
参照定量结果取适量酶解产物进行LC-MS/MS分析,蛋白检测分析由上海中科新生命生物科技有限公司进行。
液相部分:采用纳升级流速HPLC液相系统Easy nLC进行分离。分别配制0.1%甲酸水溶液和0.1%甲酸乙腈水溶液(乙腈为84%)作为缓冲液A液和B液。色谱柱平衡时使用95%的A液进行。C18上样色谱柱规格:Thermo Scientific EASY Column(2 cm×100 μm, 5 μm C18)。C18分析柱规格:Thermo Scientific EASY Column(75 μm×100 mm, 3 μm C18)。样品进上样色谱柱后,再经过分析柱,流速300 nL/min。洗脱程序见表1。

表1 120 min梯度洗脱程序Table 1 120 min gradient elution procedure
1.5 细菌蛋白鉴定
原始文件(raw file) 采用软件Mascot 2.2(Matrix Science)进行查库分析。质谱鉴定结果比对UniProt的细菌蛋白数据库,参数设置参考苗雨桐等(2017),母离子质量差设置为20 mmu,碎片离子误差为15 μg/g,半胱氨酸上的脲甲基修饰以及蛋氨酸上氧化修饰分别被选定为固定修饰和可变修饰。允许失误的剪切位点为1。检索结果以P<0.05为显著。利用KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库的KEGG Pathway 数据库进行信号通路注释分析。
2 结果
2.1 唾液SDS-PAGE蛋白电泳
本研究对浓缩后的茶小绿叶蝉唾液细菌蛋白进行一维电泳(图2),蛋白分子量大多数集中分布在35~110 kD之间。

表2 质谱仪参数设置Table 2 Parameter setting of MS
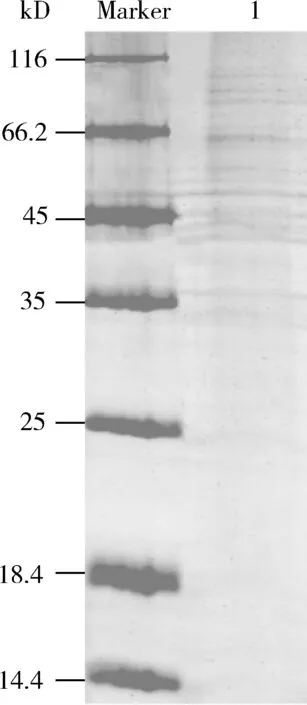
图2 茶小绿叶蝉成虫唾液细菌蛋白的分离电泳Fig. 2 Electrophoresis of bacterial proteins in the salivaof Empoasca flavescens adultsMarker: 蛋白质分子量标准Protein molecular weight marker; 1: 目的蛋白Target protein.
2.2 唾液中细菌蛋白的鉴定
本次实验利用LC-MS/MS蛋白分析法对叶蝉成虫唾液中的细菌蛋白进行鉴定,利用UniProt公共数据库进行比对,共鉴定142种细菌蛋白(表3)。分类结果显示为27个目49种细菌的142种蛋白,隶属于5个门和11个纲分类阶元。以变形菌门(Proteobacteria)细菌蛋白为主,共107个蛋白,占总蛋白数的75%以上,其中又以α-变形菌纲(α-Proteobacteria)51个蛋白和γ-变形菌纲(γ-Proteobacteria)40个蛋白为占比最多的两类。其次为厚壁菌门(Firmicutes)共28个蛋白,分别属于杆菌纲(Bacilli)和梭菌纲(Clostrida)。蛋白种类大于10个的目,包括根瘤菌目(Rhizobiales)、鞘脂单包菌目(Sphingomonadales)、肠杆菌目(Enterobacteriales)、假单胞菌目(Pseudomonadale)、芽孢杆菌目(Bacillales)。
在鉴定的142种细菌蛋白中,发现新陈代谢(metabolism)和遗传信息加工(genetic information processing)是数量最多的两个类群(图3)。在新陈代谢类别中,12个蛋白参与氨基酸代谢(amino acid metabolism)通路,涉及天冬氨酸、精氨酸、丝氨酸、赖氨酸、苯丙氨酸、色氨酸、缬氨酸和亮氨酸等生物合成或代谢途径;11个蛋白参与核苷酸代谢(nucleotide metabolism)通路,包括双功能嘌呤生物合成蛋白、核苷二磷酸激酶、核苷酸转移酶、核苷二磷酸激酶等参与嘌呤或嘧啶代谢的蛋白;10个蛋白参与能量代谢(energy metabolism)通路,包括ATP合酶、NADH醌氧化还原酶、甲基四氢甲烷蝶呤环水解酶、丝氨酸羟甲基转移酶、磷酸烯醇式丙酮酸羧化酶。在遗传信息加工中, 主要涉及翻译(translation)通路, 主要以核糖体、氨基酰tRNA生物合成为主。另外,参与膜的形成和运输、信号传导(signal transduction)、细胞过程(cellular processes)、蛋白折叠等的蛋白也被鉴定发现。
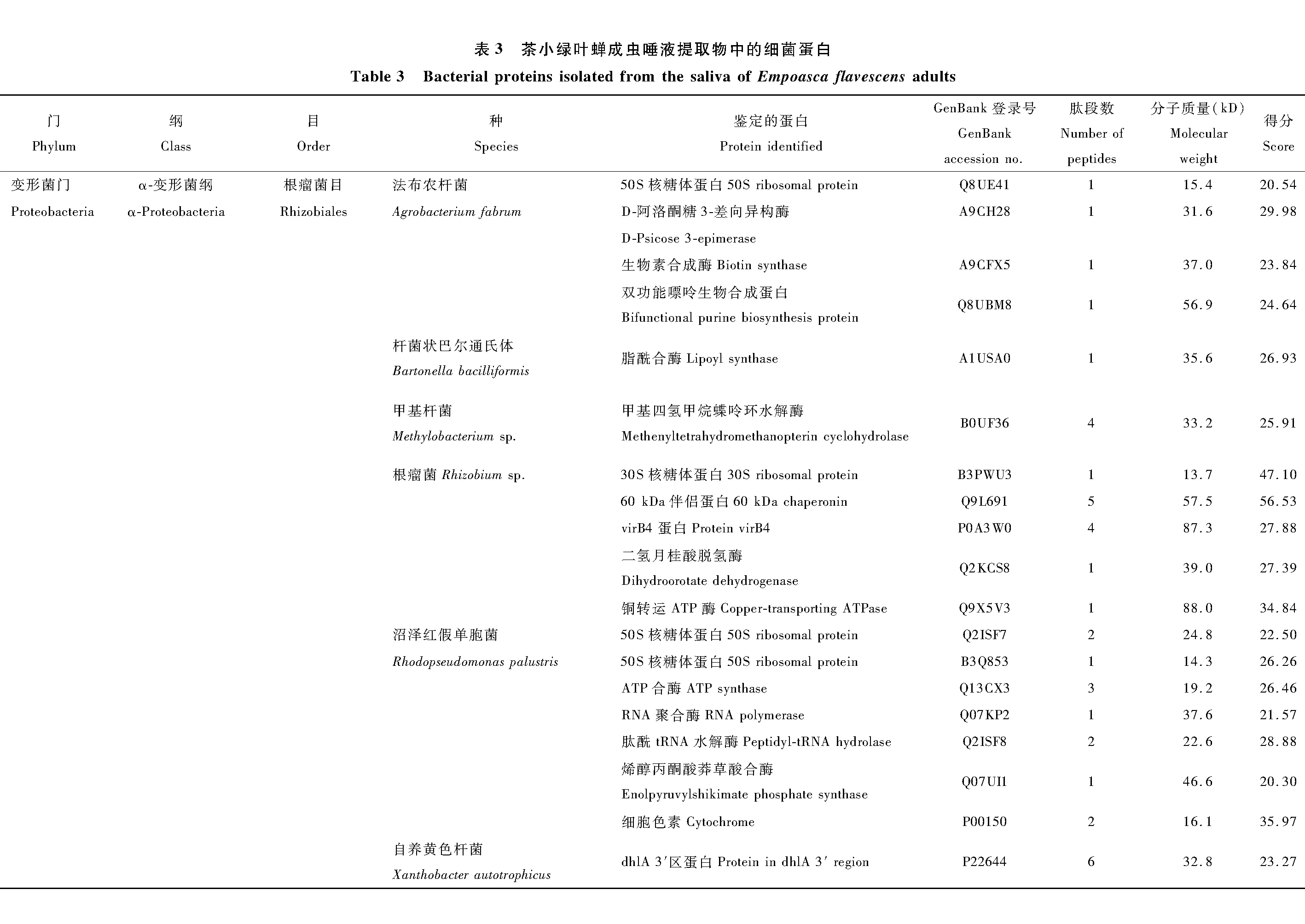

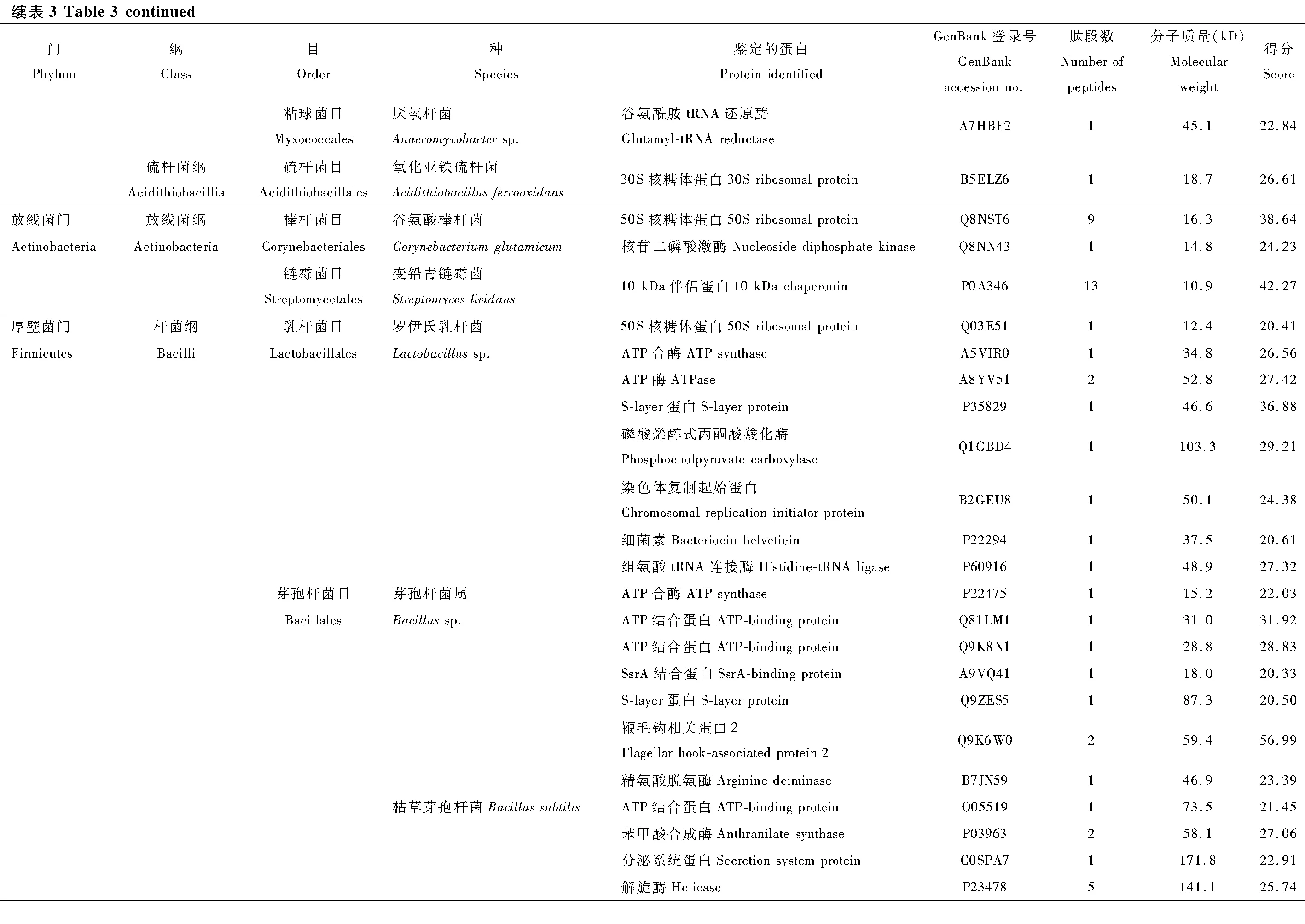
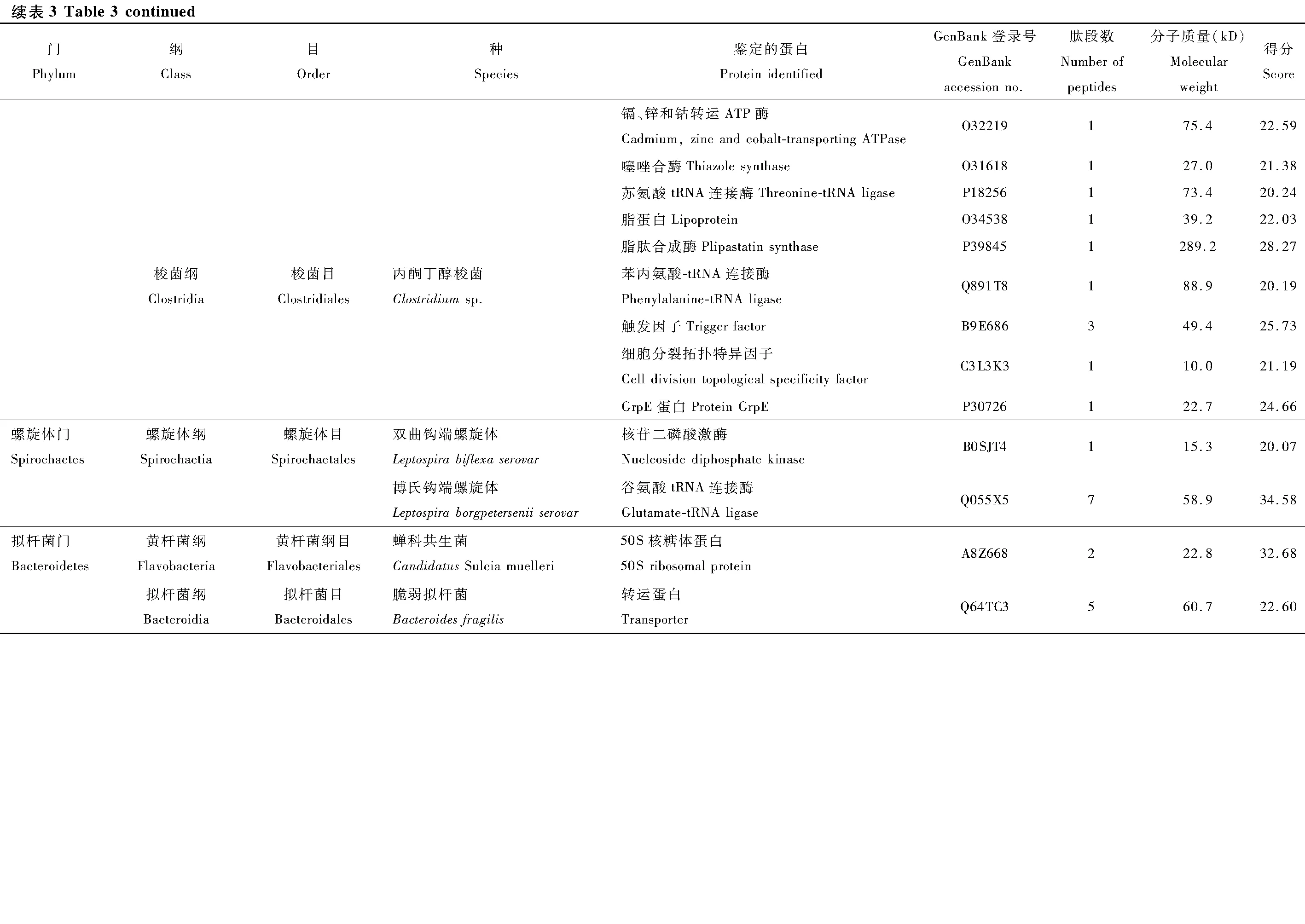

图3 茶小绿叶蝉成虫唾液细菌蛋白的KEGG信号途径分析Fig. 3 KEGG pathway classification of bacterial proteins in the saliva of Empoasca flavescens adults
3 讨论
昆虫共生细菌多样性分析最常用的鉴定方法有:体外培养鉴定和16S rRNA序列分子标记鉴定。但体外培养需要如特殊营养物质、pH、氧化还原电位等复杂特殊的生存环境,使绝大多数共生菌难以人工培养(Engel and Moran, 2013; 梅承等, 2018),同时利用培养基分离的细菌分类单元相对偏少,效率较低;利用16S rRNA结合限制性片段长度多态性(restriction fragment length polymorphism, RFLP)等技术的分子标记,虽然使鉴定难度降低,鉴定的分类单元增加,但文库构建和电泳分析均费时费力(Anandetal., 2010; 李香香, 2011; 黄卫强和张和平, 2014)。本研究为解析茶小绿叶蝉在取食过程中唾液内含有的共生菌,首次利用LC-MS/MS法对水状唾液中的细菌蛋白进行鉴定,并使用细菌UniProt蛋白数据库进行比对注释,共发现5门11纲27目49种细菌的142种蛋白。细菌单元分类数量小于利用高通量测序分析结果(毛迎新等, 2018),但结果与利用蛋白质组技术鉴定褐飞虱成虫唾液发现22种细菌的35种蛋白(苗雨桐等, 2017)类似,唾液细菌数量小于高通量测序分析褐飞虱肠道细菌的结果(王天召等, 2019)。
以韧皮部汁液为食的半翅目昆虫均有共生微生物,共生菌可为宿主提供氨基酸、维生素和脂肪等必需物质弥补其饮食结构中营养不平衡的缺陷(Feldhaar and Gross, 2009; 李香香等, 2011; Douglas, 2015),同时还对免疫反应、抗病性和抵御天敌等都存在作用(Scarboroughetal., 2005; Vorburger, 2014)。本次共鉴定到精氨琥珀酸裂解酶、精氨酸脱氨酶、天冬氨酸解氨酶、丝氨酸羟甲基转移酶、色氨酸合成酶、2,3,4,5-四氢吡啶-2,6-二羧酸N-琥珀酰转移酶、烯醇丙酮酸莽草酸合酶、苯甲酸合成酶、过氧化物酶、吲哚-3-丙酮酸脱羧酶、酮酸还原异构酶涉及8种以上氨基酸的生物合成或代谢途径,可能为叶蝉的生长发育提供氨基酸(Douglas, 2015)。Wu等(2006)发现Baumanniacicadellinicola被发现可为琉璃叶蝉Homalodiscacoagulata提供维生素,本研究中注释为参与辅助因子和维生素代谢的9个蛋白涉及根瘤菌目、海洋螺菌目、伯克霍尔德氏菌目、亚硝化单胞菌目、粘球菌目、芽孢杆菌目和硫发菌目等。参与能量代谢的鉴定到甲基四氢甲烷蝶呤环水解酶、磷酸烯醇式丙酮酸羧化酶、ATP合酶和NADH醌氧化还原酶等多种酶类,参与糖酵解、三羧酸循环和电子传递链等代谢过程可能为宿主提供合成原料和能量。
本次研究所鉴定蛋白均来源于49种细菌,其中假单胞菌目、海洋螺菌目、梭菌目、立克次氏体目、根瘤菌目、伯克霍尔德氏菌和肠杆菌目等均被多次报道在茶小绿叶蝉或头喙亚目昆虫体内存在(苗雨桐等, 2017; 毛迎新等, 2018; 王天召等, 2019)。褐飞虱唾液分泌物的16S rDNA检测发现存在不动杆菌Acinetobactersp.(唐明等, 2014);而唾液细菌蛋白的鉴定发现的22种细菌(苗雨桐等, 2017),其中有17种细菌均在本次的研究中被检测到。本研究还检测到头喙亚目昆虫的多种常见共生菌,例如:蚜虫中报道较多的初级共生菌Buchneraaphidicola和次级共生菌Hamiltonelladefensasubsp.Acyrthosiphonpisum(Charles and Ishikawa, 1999; Moran, 2005);在采采蝇中报道的共生菌Sodalisglossinidius和Wigglesworthiaglossinidiabrevipalpis(Chenetal., 1999; Akman, 2001);当然,也包括蝉科昆虫共生菌CandidatusSulcia muelleri(黄杆菌)、次生共生菌Rickettsia(Nodaetal., 2001; Bruminetal., 2012)。这些结果与毛迎新等(2018)报道的结果一致。有研究指出,H.defensa不但参与2种必需氨基酸和7种非必需氨基酸的合成,还参与大多数必需维生素的合成。也有研究指出,昆虫体内的初级共生菌会相互配合为寄主提供所需营养元素,叶蝉体内的10种氨基酸,其中Sulcia负责8个氨基酸的合成,另一种共生菌合成其余2种,其中某一氨基酸还有由两种共生菌共同参与的(McCutcheon and Moran, 2007, 2010; Bennett and Moran, 2013, 2015)。但是本次检测未发现叶蝉中分布最多的次级共生菌沃尔巴克氏菌Wolbachia(杜慧民等, 2020),与毛迎新等(2018)基于16S rDNA在其所有地理种群均检测到该菌且为优势种群的结果存在差异,猜测可能是由于沃尔巴克氏菌与生殖和发育相关且只能进行垂直传播,在唾液中可能不分布该菌,与苗雨桐等(2017)在褐飞虱唾液中未发现内共生菌Wolbachia和杀雄菌属Arsenophonus的细菌蛋白的结果一致。本次检测还发现许多次级共生菌的分布,但是不同种类的叶蝉其体内的次级共生菌需进一步研究。
本研究首次获得了茶小绿叶蝉唾液共生菌的详细信息,鉴定多种已报道的叶蝉共生细菌及其他昆虫的共生菌蛋白,这些蛋白虽然不一定均源于叶蝉唾液细菌群落或肠道细菌代谢,但在叶蝉的生活史中必然发挥着重要的作用,为进一步研究共生菌、茶小绿叶蝉和茶树之间的关系提供基础信息。

