吡非尼酮通过抑制NLRP3-ASC-IL-1β通路改善大鼠肾缺血再灌注引起的急性肾损伤
冯志鹏,许 俊,姜先洋,王荫琪,张 勇,马 燕,龙晓娜,王 露,吴灵培,彭红英
急性肾损伤(acute kidney injury, AKI)是一种以肾损害为特征,肾功能迅速下降的内科疾病,具有较高的发病率和病死率[1];缺血、脓毒症和碘化造影剂的使用等众多因素均有可能导致AKI[2]。目前仍无明确的干预措施被证明能有效地阻断或延缓AKI[3]。因此,迫切需要开发新的治疗方法来改善AKI患者的生存质量。吡非尼酮(PFD)是口服的吡啶酮类似物[4]。研究表明,PFD具有抑制炎症的功能,可显著降低糖尿病肾病小鼠模型肾脏中巨噬细胞的浸润,抑制肾小球系膜基质扩张,修复肾功能[5]。已有研究表明,炎症相关指标单核细胞趋化蛋白-1(MCP-1)和白细胞介素-1β(IL-1β)与肾损伤密切相关[6-7]。MCP-1介导的急性缺血和中毒性肾脏损伤,是炎症反应的敏感指标[8]。IL-1β是一种多效促炎因子,可由核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎性小体激活后调控。具体机制为NLRP3炎性小体可激活促进Caspase-1与凋亡相关斑点样蛋白(ASC)相互作用,启动炎性小体的形成,进而将IL-1β前体剪切成具有活性的IL-1β[9]。最新研究发现,PFD抗炎机制与炎性小体途径密切相关,PFD通过抑制NLRP3炎性小体,阻止高血压诱发的心肌纤维化[10]。因此,本研究拟在大鼠肾缺血再灌注-AKI模型中,探究PFD是否能抑制NLRP3炎症相关通路,降低炎症反应对肾脏产生保护作用。
1 材料与方法
1.1实验动物及分组 清洁级健康成年SD大鼠36只,体质量250~280 g,分笼饲养于室温24℃、相对湿度为(35~65)%,光照周期为12 h/12 h的房间,适应性饲养1周。
1.2实验试剂 PFD(Pirfenex,西普拉)、MCP-1酶联免疫吸附试验(ELISA)试剂盒(BMS631INST,ThermoFisher)、IL-1β ELISA试剂盒(ab241144)、小鼠抗β-actin(ab6276,Abcam)、兔抗NLRP3(ab263899,Abcam)、小鼠抗ASC(sc-514414,Santa Cruz)、兔抗IL-1β(ab205924,Abcam),大鼠尿素、肌酐ELISA检测试剂盒(JL21202-96T,江莱生物),苏木素、伊红染色液(4960111、4960211,达科为)。
1.3方法
1.3.1分组及AKI模型制备:按照随机数字表法将大鼠分为对照组、模型组、治疗组,每组12只。参考文献[11]的方法制备模型:腹腔注射戊巴比妥(50 mg/kg)麻醉大鼠,打开腹腔,暴露右侧肾脏,钝性分离肾包膜,游离右侧肾动、静脉、肾上腺、输尿管及肾上腺动脉,结扎后切除右侧肾脏。游离左侧肾脏;以同样方法暴露左侧肾脏并游离左侧肾动、静脉,用无创血管夹夹闭左侧肾动脉60 min,观察肾脏颜色变化,60 min后移去动脉血管夹,恢复左侧肾动脉血供。观察左侧肾脏,如果立即出现花斑状,从暗黑色或紫黑色转为鲜红色则说明肾缺血再灌注造模成功,记录再灌注时间。按每100 g腹腔注射青霉素4万单位和布比卡因2.5 g/L麻醉和镇痛。对照组只行麻醉、开腹、切除右侧肾脏,但不阻断左侧肾脏血流。治疗组大鼠造模前给予PFD 200 mg/kg灌胃,1/d,持续1周,随后制备肾缺血再灌注-AKI模型,并于造模后24 h取材检测。模型组与对照组给予等量生理盐水灌胃,1/d。剔除造模失败大鼠,每组取8只。
1.3.2大鼠肾脏病理形态:处死小鼠并获得肾脏组织,将其立即放入10%甲醛缓冲液中固定24 h,并包埋在石蜡中。将组织切成5 μm切片,行苏木素伊红(HE)染色。肾脏病理评分参照Paller评分标准[12]:0分为形态正常;1分为肾小管扩张;2分为细胞管型;细胞脱落或坏死,1分;上皮细胞核固缩、空泡状或颗粒状,1分。
1.3.3肾功能及炎性因子:收集大鼠血清,采用ELISA检测试剂盒检测尿素、肌酐、MCP-1和IL-1β含量,步骤参照说明书实施。
1.3.4qRT-PCR测定肾组织IL-1β和MCP-1 mRNA:采用Trizol试剂提取肾脏组织中RNA。逆转录为cDNA,反向转录参数如下:95℃预变性20 s,60℃退火20 s,72℃延伸20 s,40个循环。以β-actin作为内参基因,MCP-1和IL-1β 转录水平采用2-ΔΔCt计算。实验重复3次,取平均值。引物序列见表1。

表1 MCP-1和IL-1β引物序列
1.3.5蛋白免疫印迹:使用RIPA从肾脏中提取总蛋白。经变性处理后,将等量的蛋白质(25 μg)加载到SDS-PAGE上,并转移到PVDF膜上,然后将膜用5%脱脂奶粉封闭,加入一抗(稀释比例为抗β-actin 1∶3000,抗NLRP3 1∶1000,抗ASC 1∶500,抗IL-1β 1∶1000)4℃孵育过夜,TBST清洗3次;二抗孵育1 h,TBST清洗3次;显色后成像系统显影,采集图片。

2 结果
2.1PFD对肾组织病理形态学的影响 对照组大鼠肾脏组织结构完整,肾小球、皮髓交界处的肾小管以及髓质处的肾小管都清晰可见。模型组大鼠肾脏可见肾髓质高度充血,细胞核固缩、溶解、消失,肾外髓质大部分肾小管上皮细胞坏死脱落,远端肾小管及集合管内可见细胞管型。治疗组大鼠肾脏损伤较模型组减轻。见图1。与对照组比较,模型组大鼠肾脏损伤评分显著升高(P<0.01);与模型组比较,治疗组肾脏损伤评分显著下降(P<0.05)。见图2。
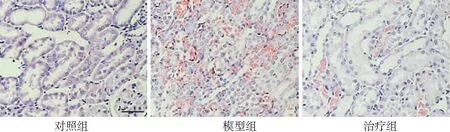
图1 3组大鼠肾脏病理结构图(HE,标尺为50 μm)

图2 3组大鼠肾损伤病理评分情况
2.2PFD对肾功能的保护作用 与对照组比较,模型组大鼠血清中尿素和肌酐显著升高(P<0.01)。与模型组比较,治疗组大鼠血清中尿素和肌酐含量下降(P<0.05,P<0.01)。见图3。
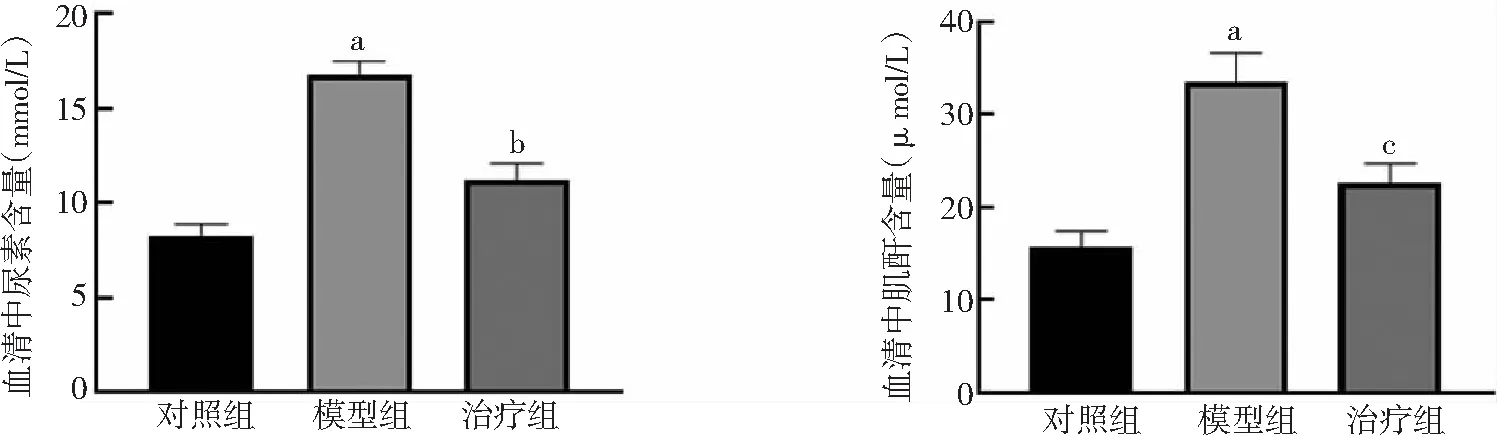
图3 3组大鼠血清中尿素和肌酐含量比较
2.3PFD对血清MCP-1和IL-1β含量的影响 与对照组比较,模型组大鼠血清中MCP-1和IL-1β含量显著增高(P<0.01);与模型组比较,治疗组大鼠血清MCP-1和IL-1β含量显著下降(P<0.01)。见图4。

图4 3组大鼠血清中MCP-1和IL-1β含量比较
2.4PFD对肾组织MCP-1和IL-1β mRNA转录的影响 与对照组比较,模型组大鼠肾脏MCP-1和IL-1β mRNA相对表达量显著升高(P<0.01);与模型组比较,治疗组大鼠肾脏MCP-1和IL-1β mRNA相对表达量显著下降(P<0.01)。见图5。

图5 3组大鼠肾脏MCP-1和IL-1β mRNA相对表达量比较
2.5PFD对肾脏NLRP3、ASC和IL-1β表达量的影响 与对照组比较,模型组大鼠肾脏NLRP3、ASC和IL-1β蛋白相对表达量显著升高(P<0.01);与模型组比较,治疗组大鼠肾脏NLRP3、ASC和IL-1β蛋白相对表达量显著下降(P<0.05,P<0.01)。见图6。

图6 3组大鼠肾脏NLRP3、ASC和IL-1β蛋白表达量比较
3 讨论
AKI临床特征是肾功能突然下降,表现为废物排泄减少、电解质紊乱和体液内环境平衡紊乱,诊断特征为代谢废物尿素和(或)血肌酐含量升高[13-14]。AKI目前尚无明确的治疗方法,因此早期发现和及时治疗尤为重要[15]。缺血再灌注损伤、毒素直接作用、炎性介质、免疫反应和细胞凋亡等因素都参与了AKI的发病过程[16]。研究表明,缺血再灌注时,缺血缺氧促进了肿瘤坏死因子-α、IL-6等炎性介质及细胞因子的释放[17]。在脓毒症诱导的AKI中,模型组小鼠肾脏组织中Caspase-1的表达和活性增加,血清C反应蛋白(CRP)和肾脏中IL-1β、IL-18含量升高[18]。此外,在顺铂引起的AKI模型中,血清尿素、肌酐、尿白蛋白/肌酐增加,肾脏中IL-1β、IL-6蛋白表达量升高,MCP-1 mRNA转录水平升高[19]。

本研究结果显示,与对照组比较,模型组大鼠血清尿素和肌酐、MCP-1和IL-1β含量、肾损伤病理评分显著增加;与模型组比较,治疗组大鼠血清尿素和肌酐、MCP-1和IL-1β含量、肾损伤病理评分显著减低。与既往文献报道一致[20]。
NLRP3激活后可促进Caspase-1与ASC相互作用,启动炎性小体的形成,ASC通过招募和激活 Caspase-1前体来生成具有活性的 Caspase-1。Caspase-1是IL-1β的转化酶,将IL-1β前体剪切成具有活性的IL-1β[9]。因此,IL-1β是一种由NLRP3炎性小体激活后调控的多效促炎因子。MCP-1是单核细胞/巨噬细胞的特异趋化因子,能趋化和激活单核细胞至炎症部位;同时可参与炎症反应和调节免疫;还可调节单核细胞表面黏附分子的表达,促进细胞因子如IL-1和IL-12的分泌[20]。PFD目前已被美国食品药品管理局批准用于治疗特发性肺纤维化和减缓肺功能下降[4]。最新研究发现,PFD可通过抑制氧化应激、巨噬细胞浸润和炎症依赖的NLRP3途径诱导的炎症反应,有效地减轻庆大霉素诱导的AKI[21]。本研究结果显示,与对照组比较,模型组大鼠血清MCP-1和IL-1β mRNA表达量,NLRP3、ASC和IL-1β蛋白相对表达量均增加;与模型组比较,治疗组大鼠血清MCP-1、IL-1β mRNA表达量,NLRP3、ASC和IL-1β蛋白相对表达量均降低。说明肾脏缺血再灌注可促进炎性介质如IL-1β的大量释放;此外,肾组织中MCP-1含量升高,可进一步趋化和激活单核细胞至炎症部位加重肾损伤;而PFD可通过抑制NLRP3-ASC-IL-1β信号通路,降低NLRP3、ACS和IL-1β 蛋白表达量,降低MCP-1和IL-1β的转录和翻译;从而降低血清中MCP-1和IL-1β的含量,对肾脏产生保护作用,最终可降低尿素和肌酐含量。
综上所述,PFD可有效缓解肾缺血再灌注引起的肾损伤,其保护机制与抑制NLRP3-ASC-IL-1β炎症信号通路有关。AKI发病机制复杂,并非是单一因素导致的疾病,本研究仅以缺血再灌注模型模拟AKI存在一定的局限性。此外,PFD对NLRP3-ASC-IL-1β信号通路的影响仍需在AKI的其他模型中进一步深入研究。

