四川太和毛霉豆豉中优势发酵菌株的分离鉴定与酶活分析
何维 安天星 余玲 廖柯 陈超 刘迎涛 胡洁 邓婷 尹鑫 苏波 赵志峰

摘要 [目的]从传统的四川太和毛霉豆豉中分离产蛋白酶较高的优势菌株,并通过形态学与分子生物学技术进行鉴定,研究菌株酶活。[方法]以四川太和毛霉豆豉为研究对象,通过分离、纯化技术分离其中优势菌,并结合形态学与分子生物学技术进行特征菌落鉴定,最后对2株霉菌的蛋白酶和纤维素酶活性进行检测。[结果]四川太和毛霉豆豉中2 株产蛋白酶较高的优势菌株分别为M-THF-01与M-THF-02;经形态学与分子生物学鉴定技术发现,M-THF-01为雅致放射毛霉( Actinomucor elegans) ,M-THF-02为总状毛霉 (Mucor racemosa) 。M-THF-01与M-THF-02 中性蛋白酶酶活分别为(83.00±4.25) U/mL 和 (277.35±6.09)U/mL,酸性蛋白酶分别为 (156.36±3.68) U/mL和(405.69±4.18) U/mL,碱性蛋白酶分别为(19.30±2.56) U/mL和(25.37±3.88)U/mL,产纤维素总体酶活分别为(2.51±0.85) U/mL 和(3.64±1.31) U/mL。总体来说,M-THF-02产酶活力明显高于M-THF-01。[结论]该研究可为毛霉豆豉纯复合发酵剂的研发提供理论基础,并为毛霉豆豉的工业化与规模化生产提供科学依据。
关键词 豆豉;分离;鉴定;雅致放射毛霉;总状毛霉;酶活
中图分类号 TS 201.3 文献标识码 A
文章编号 0517-6611(2021)14-0157-05
Abstract [Objective]To isolate the dominant strain with high protease production from the traditional Sichuan Taihe Mucor Douchi, and identify the strains by morphology and molecular biology technology and study the enzyme activity of the strains. [Method]In this study, Mucor Taihe Douchi was used as the research object. The dominant bacteria were isolated by separation and purification technology, and the characteristic colonies were identified by morphological and molecular biological techniques. Finally, the protease and cellulase activities of the two strains were detected. [Result]The results showed that M-THF-01 and M-THF-02 were the two dominant protease producing strains in Sichuan Taihe Mucor Douchi, and M-THF-01 was Actinomucor elegans and THF-02 was Mucor racemosus. The neutral protease activities of M-THF-01 and M-THF-02 were (83.0±4.25) U/mL and (277.35±6.09) U/mL, respectively;acid protease were (156.36±3.68) U/mL and (405.69±4.18) U/mL;alkaline protease were (19.3±2.56) U/mL and (25.37±3.88) U/mL;the total cellulase activity of M-THF-01 and M-THF-02 were (2.51±0.85)U/mL and (3.64±1.31)U/mL respectively;in general, the enzyme activity of M-THF-02 was significantly higher than that of M-THF-01. This study provides a theoretical basis for the development of Mucor Douchi pure compound starter, and provides the scientific basis for the industrialization and largescale production of Mucor Douchi.
Key words Douchi;Separation;Identification; Actinomucor elegans;Mucor racemosa; Enzyme activity
基金项目 四川省省级财政科技计划重点研发项目(2018GZ0022)。
作者简介 何维(1995—),男,四川遂宁人,硕士研究生,研究方向:食品微生物与发酵工程。*通信作者,副教授,博士,从事农产品及食品深加工研究。
收稿日期 2020-12-08
豆豉起源于我国,古代称为“幽寂”,豆豉是一种以大豆或黑豆为原料,经选杂、浸泡、蒸煮、制曲、拌料、后发酵等工序制成的传统发酵类调味品,因其具有极高的营养价值、较高的食用、药用价值以及独特的风味,而深受大众喜爱[1-2] 。豆豉独特的风味形成主要是利用接种的微生物分泌产生的蛋白酶[3] 、糖化酶[4] 、脂肪酶[5] 等来分解大豆蛋白、脂肪、淀粉等大分子物质,产生多肽、氨基酸、寡糖、單糖等物质,这些风味前体物质在后期的发酵过程中发生一系列生化反应来丰富味型,或者通过加入一些调味品来形成具有一定色香味且营养丰富的豆豉。豆豉不仅含有丰富的蛋白质、脂肪、碳水化合物,还含有多种生物活性物质如大豆异黄酮[6] 、大豆多肽[7] 、豆豉纤溶酶[8] 等,对延缓衰老、预防疾病、降血压及抗氧化活性有一定的积极作用[9-10] 。根据豆豉产生时参与发酵微生物种类的不同,可以分为毛霉型豆豉[11] 、曲霉型豆豉[12] 、细菌型豆豉[13] 、根酶型豆豉[14] 四大类,其中以毛霉型豆豉最富有特色。目前,毛霉型豆豉的发酵沿用传统的自然发酵,而传统自然发酵豆豉中自然菌株发酵的能力差异较大[14] 。为了获得高产蛋白酶的菌株,国内外学者在微生物分离方面做了大量研究,如陈怡等[15] 从浏阳豆豉中分离出3株溜曲霉菌000、5132、621,结果表明,菌株621蛋白酶活性最强,为(207.98±3.20) U/mL;菌株5132的纤维素酶活性最强,为(3.40±1.40) U/mL;菌株000的脂肪酶活性最高,其酶活为(90.7±0.64) U/mL。邓维琴等[16] 从郫县豆瓣酱中筛选出2株高产蛋白酶的菌株PCSM01与PCSM02,在麦麸培养基培养3 d后,其蛋白酶活分别是1 450.25、1 703.25 U/g;Chancharoonpong等[17] 以米曲( Aspergillus oryzae) 发酵含量为60%大豆的曲司并对其酶活进行了研究,结果表明,48 h时蛋白酶活性达到最高,为84.38 U/g。
笔者从传统的四川太和毛霉豆豉中分离得到产蛋白酶较高的优势菌株,并通过形态学与分子生物学技术进行鉴定,分别研究鉴定菌株的中性蛋白酶、酸性蛋白酶、碱性蛋白酶、纤维素总体酶的酶活,旨在为今后毛霉豆豉纯复合发酵剂的研发及毛霉豆豉的工业化与规模化生产提供理论依据。
1 材料与方法
1.1 样品采集 四川太和毛霉豆豉采自成都太和坊酿造有限公司。
1.2 试剂与仪器 主要试剂:蔗糖、氢氧化钠、无水磷酸氢二钠、磷酸二氢钠、干酪素、无水碳酸钠、三氯乙酸、硼砂、乳酸、乳酸钠等试剂均为分析纯,成都鸿盛达科技有限公司;马铃薯葡萄糖琼脂培养基(PDA)、麦麸培养基,成都鸿盛达科技有限公司。
主要仪器:HH-S4 数显恒温水浴锅,江苏金怡仪器有限公司;C1000 Thermal Cycler PCR仪,美国Bio-Rad公司;SUB-CELL GT水平电泳槽,美国Bio-Rad公司;SW-CG-1G超凈工作台,苏州博莱尔净化设备有限公司;Gel Doc XR+凝胶成像系统,美国Bio-Rad公司;YXQ-100S11蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂;DA2204B电子天平,上海天美天平仪器有限公司;CX40P电子显微镜,宁波舜宁仪器有限公司;DHG-9245A电热恒温鼓风干燥箱,上海一恒科技有限公司;BCD-218STPS冰箱,青岛海尔股份有限公司。
1.3 试验方法
1.3.1 毛霉分离纯化。
将 10 g 豆豉样品放入三角瓶中,加入90 mL无菌生理盐水,摇匀制成菌悬浮液,稀释到 10-6;选取稀释梯度为 10-3、10-4、10-5 的样品稀释液涂布于 PDA 平板,28 ℃培养 48~72 h。挑取生长旺盛的菌落,用平板划线法接种到 PDA 培养基上;并将培养基放入培养箱继续培养,待菌落长出较多时,继续划线纯化,直至纯化出单一菌落。
1.3.2 目标菌株的形态特征观察。
利用传统形态学鉴定的方法,对经过复筛分离、纯化得到的菌株进行观察。通过电子显微镜观察菌落的形态特征、孢子囊及孢子生长速度等,初步确定菌种类型。
1.3.3 目标菌株的分子生物学鉴定。
1.3.3.1 DNA 的提取。将悬浮在纯化水中的真菌细胞50~100 mg(WW)加入裂解管中,再向裂解管中加入750 μL裂解液,再加入500 μL裂解液和150 μL KAC,50 μL异丙醇反复离心15 min;收集上清液,加入等体积的70%乙醇,离心10 min 后待水分散失后加入0.1×TE30 μL,收集上清液,提取目标菌株的DNA。
1.3.3.2 PCR 的扩增。
18Sr DNA 序列分析:使用真菌18Sr DNA 的通用引物进行 PCR 扩增,引物的序列如下:ITS1(5-TCCGTAGGTGAACCTGCGGAGTT3) ITS4(5-TCCTCCGCTTATTGATATGC-3);PCR 的反应体系25 μL,包括
DNA(20 ng/μL)2.0 μL,Forward Primer (100 μmol/L) 2.5 μL,Reverse Primer (10 μmol/L) 2.5 μL,H2O 18 μL,扩增反应条件为预变性:95 ℃ 5 min,变性:94 ℃ 45 s,复性:55 ℃ 45 s,延伸:72 ℃ 45 s 30 个循环,补充循环:72 ℃ 1 min。扩增产物经 1.0%琼脂糖凝胶电泳检测,再将其产物送交成都罗宁生物有限公司进行测序。利用 NCBI中 BLAST 分析工具将所分离菌株的测序结果在 GenBank 数据库中进行比对。
1.3.4 菌株酶活测定。
1.3.4.1 待测酶液的制备。
将纯化的雅致放射毛霉与总状毛霉接种到大豆中,培养48 h后,称取长满毛霉的豆粒(不碾碎)10 g,加水至100 mL,在40 ℃水浴中间断搅拌1 h,过滤,滤液分别用pH 7.2磷酸缓冲液、pH 2.5乳酸-乳酸钠缓冲液、pH 10硼砂-氢氧化钠缓冲液稀释到一定倍数,待测。
1.3.4.2 蛋白酶活的测定。
参照SB/T 10317—1999[18] 的方法测定:空白试管组和酶样试管组,在不同接种条件下,分别加入1 mL粗酶液,在40 ℃水浴中预热2 min,加入0.4 mol三氯乙酸2 mL,加入1 mL酪蛋白溶液,加入2 mL三氯乙酸加入试管组(酶样),10 min后过滤。取滤液1 mL,加入0.4 mol碳酸氢钠5 mL,福尔林试剂1 mL,40 ℃显色20 min,紫外分光光度计在680 nm处测定吸光度。
将在40 ℃下1 min水解酪蛋白产生1 μg酪氨酸,定义为1个蛋白酶活力单位。
样品蛋白酶活力单位(干基)= A10×4×N×11-W
式中,A 为由样品测得OD值× K ,4为4 mL反应液取出1 mL测定(即4倍),
N 为酶液稀释倍数,10为反应10 min, W 为样品水分百分量。
1.3.4.3 纤维素总体酶活的测定(FPA活力单位的测定)。参照文献[19]中的方法测定。1 mL酶液在 50 ℃pH为4.8的条件下,每1 min水解1 cm×6 cm 的滤纸产生1 μg还原糖,以葡萄糖计的酶量定义为1个纤维素总体酶活力单位。
2 结果与分析
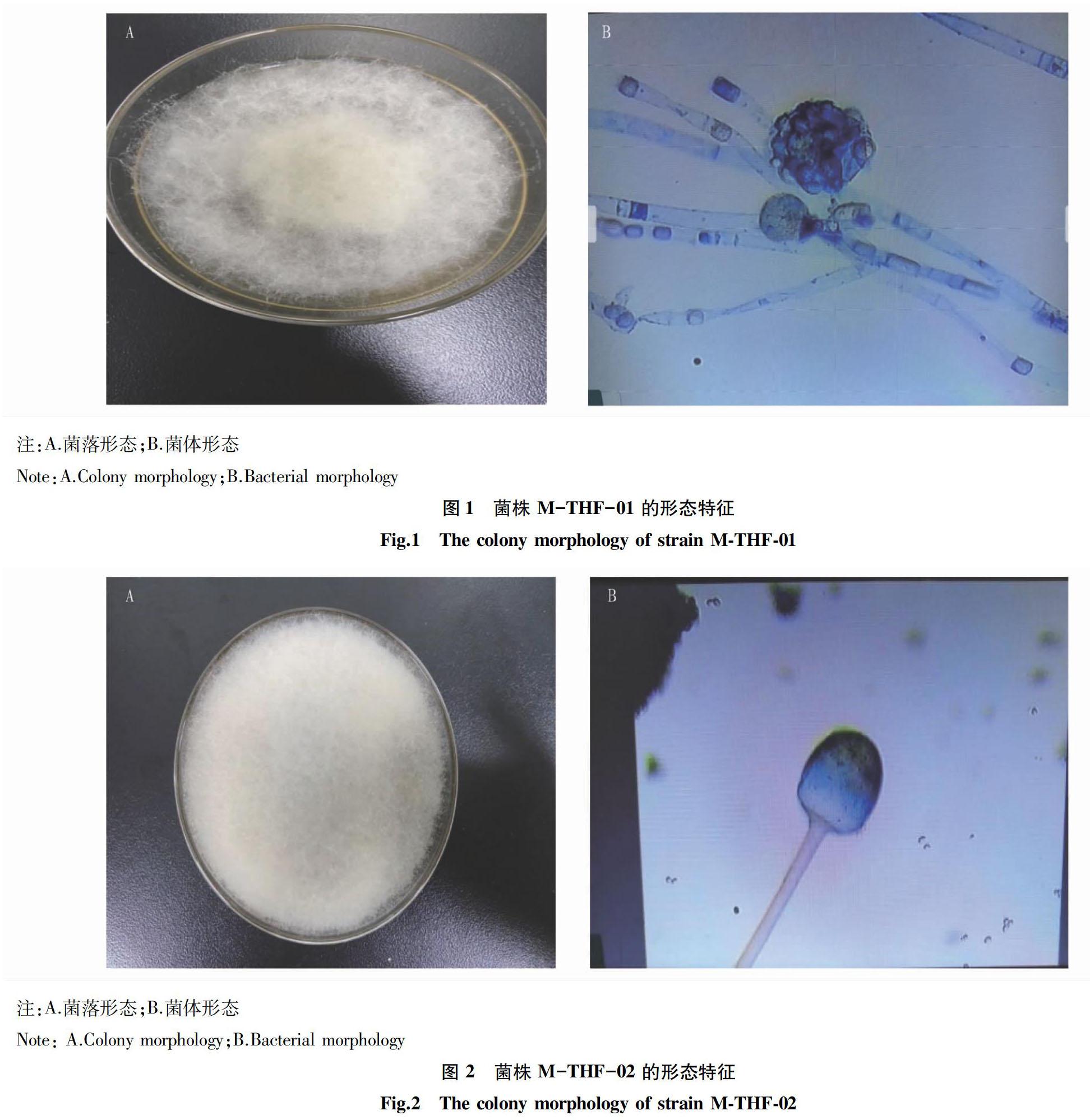
2.1 菌株形态特征分析 将菌株M-THF-01、M-THF-02活化后,采用点值法在 PDA 琼脂平板上接种,于28 ℃培养48 h 后,观察其菌落形态,结果见图 1、2。由图1可知,菌株M-THF-01菌落直径约35 mm,初期颜色为白色,中后期为浅橙黄色;通过显微镜观察到菌株 M-THF-01孢囊梗直立分枝多集中于顶端,孢子囊成球形,有不发达的假根。从图2可知,菌株 M-THF-02 菌落直径约 50 mm,初期颜色为白色,中后期变为褐灰色,菌丝生长有褐色孢子;通过显微镜观察到菌株 M-THF-02 顶端孢子囊为椭球型,孢囊梗与囊轴连接,接连处无囊托、无假根。
2.2 目标菌株的分子生物学鉴定
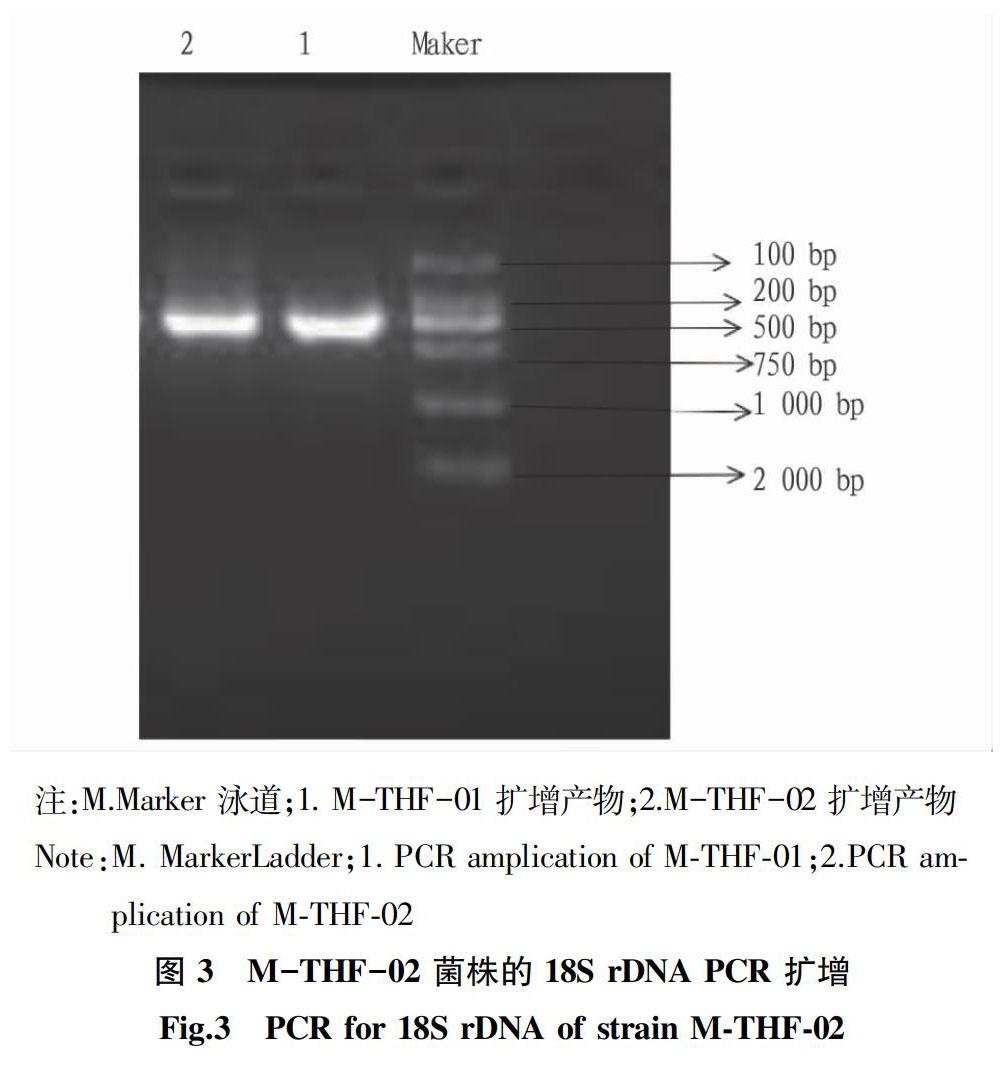
以菌株M-THF-01、M-THF-02基因组为模板,利用真菌通用引物PCR扩增其18Sr DNA 序列,PCR 产物经琼脂糖电泳验证,电泳结果如图3所示,发现仅有1条单一目标条带,条带为 629~648 bp,与预期长度一致。
将 PCR 扩增产物送交成都罗宁生物有限公司进行序列测定,获得的 PCR 产物测序结果与 Genback 中的 18Sr DNA 序列进行比对,结果如图4、5所示。根据 Genback 中的 18Sr DNA 序列进行比对显示,M-THF-01 18Sr DNA 序列与雅致放射毛霉 ( Actinomucor elegans MN626448.1)同源性达到 100%,再结合形态学特征,确定菌株 M-THF-01 为雅致放射毛霉 (Actinomucor elegans), 并將其保存在武汉的中国典型培养物保藏中心(保藏号: CCTCC M -THF 01 No.2020493)。M-THF-02 18Sr DNA 序列与总状毛霉 (Mucor racemosus HM641690 )同源性达到 99%,再结合形态学特征,确定菌株M-THF-02 为总状毛霉 (Mucor racemosus), 并将其保存在武汉的中国典型培养物保藏中心(保藏号: CCTCC M -THF 02 No.2020552)。
2.3 菌株的酶活比较 标准曲线见图6,根据标准曲线可以得出线性回归方程 y=0.500 2x-0.001 0,R2=0.999 6 。
由表1可知,雅致放射毛霉与总状毛霉的酸性蛋白酶的酶活分别为(83.00±4.25) U/mL和 (277.35±6.09) U/mL;雅致放射毛霉与总状毛霉的中性蛋白酶的酶活分别为(156.36±3.68) U/mL和(405.69±4.18) U/mL;碱性蛋白酶的酶活分别为(19.30±2.56) U/mL和(25.37±3.88) U/mL。其中酸性蛋白酶与中性蛋白酶的酶活在雅致放射毛霉与总状毛霉豆豉曲样中较高,而碱性蛋白酶的活力较弱,这说明毛霉在豆豉的制曲过程中主要是以酸性蛋白酶与中性蛋白酶起着重要作用,这与房翠兰[20] 的结果基本一致。Fu等[21] 研究发现,雅致放射毛霉所产生的酸性蛋白酶与中性蛋白酶对豆豉脱苦的效果较为明显。潘进权[22] 研究发现,毛霉纯化所产生的氨肽酶在酸性条件下催化活性最大,且脱苦效果最为明显。这些研究表明,酸性蛋白酶和中性蛋白酶在后发酵过程中对苦味的脱出起着重要作用。
毛霉豆豉发酵过程中纤维素活性的高低决定了大豆中纤维素分解程度的高低,大豆纤维素的降解会对豆豉的硬度、咀嚼、质构有一定影响。由表1可知,M-THE-01、M-THF-02的纤维素酶活分别是(2.51±0.85)、(3.64±1.31) U/mL,陈怡等[15] 研究发现,在浏阳豆豉分离得到的纤维素活力最高,达(3.40±1.40) U/mL。
3 结论
该研究以四川太和毛霉豆豉为研究对象,分离出2株优势霉菌,对其进行菌落形态观察与ITSrDNA基因序列分析,基因序列提交到GenBank数据库利用BLAST工具进行序列对比,结果表明,菌株M-THF-01为雅致放射毛霉,菌株M-THF-02为总状毛霉。2株菌株具有不同的产酸性蛋白酶、中性蛋白酶、碱性蛋白酶、纤维素酶。总体来说,M-THF-02产酶活力明显高于M-THF-01。该研究筛选的总状毛霉与雅致放射毛霉具有较高的产蛋白酶能力,这为解决单一菌株蛋白酶活力较低,发酵时间长,复合发酵剂优良菌种选育资源单一等问题提供了理论支撑,并为毛霉豆豉发酵最终能够脱离地域环境限制,实现规模化、工业化发展提供可能。
参考文献
[1] 方雅洁,和七一,陈治霖,等.豆豉生产中高大毛霉和纳豆芽孢杆菌 HT8 共发酵条件研究[J].重庆师范大学学报(自然科学版),2015,32(4):131-135.
[2] 胡会萍, 李秀娟, 黄贤刚. 传统豆豉微生物学研究综述[J].中国调味品, 2012,37(6):4-7,13.
[3] 张雪梅, 张玲, 高飞虎,等.豆豉的营养研究现状及发展前景[J].南方农业, 2015,9(4):51-53.
[4] CHEN K I,ERH M H,SU N W,et al. Soyfoods and soybean products:From traditional use to modern applications[J].Applied microbiology & biotechnology, 2012, 96(1):9-22.
[5] 蔡曼儿, 孙翰, 薄芯. 中国传统发酵大豆制品的营养[J].中国酿造, 2010, 29(2):11-16.
[6] 郭瑞华, 霍文, 刘正猛,等.豆豉中大豆异黄酮及苷元降血糖活性及其机理的研究[J].时珍国医国药,2007,18(7):1606-1607.
[7] 黄欣. 浏阳豆豉自然发酵菌相分析及人工接种发酵条件的研究[D].长沙:湖南农业大学, 2007.
[8] 关晨晨, 赵敏. 豆豉纤溶酶的研究进展[J].黑龙江医药, 2010, 23(1):64-66.
[9] 黄文宇. 云南省传统发酵豆豉中微生物所分泌蛋白酶的研究[D].昆明:昆明理工大学,2009.
[10] 彭勇,张义正.豆豉溶栓酶产生菌的筛选及其酶学性质的初步研究[J].高技术通讯,2002,12(2):30-34.
[11] 陈留记, 金明凤. 分析毛霉型豆豉现状研究其发展方向[J].中国酿造, 1998(5):8-10.
[12] 张建华, 李里特. 曲霉型豆豉发酵过程中的成分变化[J].中国调味品, 2004,29(3):12-16.
[13] 张炳文, 庞庆芳, 孙超. 对中国传统细菌型豆豉溶栓酶酶学性质的研究[J].中国调味品,2008, 33(12):45-49.
[14] 卢露, 郑晓莹. 豆豉发酵中微生物及其功能研究进展[J].粮食与食品工业,2011,18(1):42-45.
[15] 陈怡, 刘洋, 蒋立文,等. 浏阳豆豉发酵中高产酶活菌株的分离鉴定及酶活性分析[J].中国酿造, 2020,39(8):37-41.
[16] 邓维琴, 陈功, 张其圣,等. 传统郫县豆瓣酱中高产蛋白酶曲霉的筛选及应用[J].微生物学通报, 2019, 46(9):2272-2281.
[17] CHANCHAROONPONG C,HSIEH P C,SHEU S C.Effect of different combinations of soybean and wheat bran on enzyme production from Aspergillus oryzae S.[J].APCBEE Procedia, 2012,2:68-72.
[18] 上海市釀造科学研究所.蛋白酶活力测定法:SB/T 10317—1999[S].北京:中国标准出版社,1999.
[19] 任璐, 刘思雨, 钟燕. 毛霉型豆豉发酵菌株分离鉴定与酶活分析[J].中国调味品, 2018,43(1):30-34.
[20] 房翠兰. 豆豉加工过程中蛋白质和膳食纤维生物学变化的研究[D].重庆:西南大学,2007.
[21] FU J,LI L,YANG X Q. Specificity of carboxypeptidases from Actinomucor elegans and their debittering effect on soybean protein hydrolysates[J].Applied biochemistry & biotechnology, 2011, 165(5/6):1201-1210.
[22] 潘进权. 毛霉AS3.2778脯氨酸氨肽酶的部分纯化及性质研究[J].食品与发酵工业,2011,37(4):26-31.

