头颈部恶性肿瘤类器官研究现状及应用
奉佳连,文忠
(南方医科大学珠江医院 耳鼻咽喉头颈外科,广东 广州 510282)
类器官是体外三维培养构建出的多细胞团块,具有自我更新和自我组织能力, 并且维持了其来源组织的生理结构和功能的特点[1-3]。近来众学者将类器官技术应用于恶性肿瘤的治疗,已建立多种组织的类器官如头颈部肿瘤[4-6]、内耳[7]、甲状腺[8]、视网膜[9]、脑[10]、新型冠状病毒感染模型[11]等。类器官培养技术在肿瘤研究上具有独特的优势:①维持肿瘤细胞的高度异质性;②维持肿瘤细胞与微环境基质的接触极性, 更好地模拟体内的肿瘤微环境;③来源于临床组织的类器官培养效率高、耗时少;④肿瘤类器官同时拥有肿瘤细胞系和小鼠PDX模型的优点,可进行遗传操作且具备三维复杂系统特性。结合类器官技术,直接针对患者肿瘤组织进行个体化研究和药物筛选,建立临床前模型,用于头颈恶性肿瘤的精准治疗。现就头颈恶性肿瘤个体化类器官在精准医学时代背景下的研究现状及其潜在的临床应用前景进行综述。
1 头颈部恶性肿瘤与精准医疗
头颈恶性肿瘤被列为全球第六大常见的癌症,占全身恶性肿瘤的21.2%,占男性恶性肿瘤的47%,占女性恶性肿瘤的2.5%,鳞状细胞癌是最常见的组织学类型(97%)[12]。吸烟和饮酒是头颈恶性肿瘤发展的主要危险因素[13],而EB病毒和人乳头瘤病毒分别与鼻咽癌和口咽癌有关[14-15]。头颈部恶性肿瘤的治疗方案选择根据肿瘤所在的解剖位置、肿瘤分期、患者年龄、健康状况及合并疾病而有所不同。开放和微创手术在内的手术被认为是大多数口咽癌和早期喉癌的标准治疗方法,而其他头颈部癌症则采用放射治疗或同步放化疗。据统计,即便采取积极治疗,头颈恶性肿瘤的复发率也达40%~50%。
2015年美国启动了“全美计划”,这是一项由政府资助的精准医疗计划,招募超过100万人参与该计划。精准医疗的核心在于能够指导医疗保健决策为患者提供最有效的治疗,从而提高治疗质量,同时减少对不必要的诊断和疗法探索[16]。肿瘤精准治疗的实现极大程度上依赖于药物敏感性的检测,但目前尚缺乏有效检测肿瘤药物敏感性的可靠方法,传统的药物筛选系统筛选出的药物临床应用价值低[17]。头颈恶性肿瘤个体化药物敏感性筛查的复杂性及艰巨性,反映了对于抗癌药物耐药、化疗药物筛选系统、靶向药物筛选系统认识不足的客观现实,亟需更全面、多角度的研究来进行揭示。类器官培养技术,给头颈恶性肿瘤的精准医疗进一步发展带来希望。
2 头颈肿瘤类器官模型
2.1 头颈肿瘤类器官的研究简史
为了更好地研究癌症,研究人员已建立各种疾病模型,包括癌细胞系、动物模型以及新兴的类器官模型,这些疾病模型各有其优缺点(表1)。癌细胞系可快速建立,用于药物开发和高通量筛选,由于其缺乏对肿瘤结构和微环境的解释,限制其作为临床前模型的应用潜力。肿瘤异种移植可以维持特定的肿瘤异质性以及肿瘤细胞与其周围基质细胞之间的相互作用,已经被用于临床前药物评估、生物标记物鉴定及放疗敏感性[18]。异种移植也存在缺点,需要大的小鼠群体,耗费大量资金和人力,阻碍了它们在精准医学中的实际应用[19]。
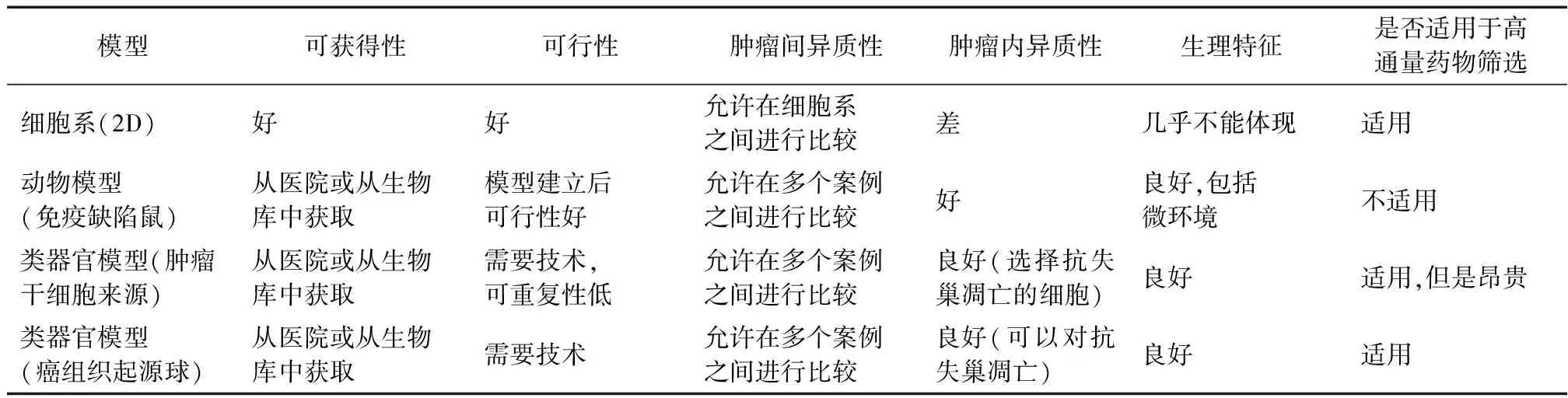
表1 疾病模型优劣势对比分析表
头颈肿瘤三维培养已有较长时间,早在1989年,Sacks 等[20]从单层细胞培养扩展到具有三维细胞组织的体外模型多细胞肿瘤球体。Köpf-Maier 等[21]在1991年利用类器官技术培养了患者组织来源的下咽表皮样癌类器官以及口咽鳞状细胞癌类器官。Saito 等[22]建立功能性甲状腺类器官,能合成甲状腺球蛋白、碘摄取以及甲状腺激素的产生和释放。Driehuis等[23]首次详细描述了来自健康黏膜上皮细胞以及头颈部鳞状细胞癌细胞类器官的培养条件,建立头颈肿瘤类器官活组织生物库。快速有效地建立活组织生物库,有望在更广泛的人群中有针对性地研究个体化药物。已有研究证明肿瘤类器官概括了相应来源的器官特异性基因表达特征、特定的组织空间结构和原始组织的功能,能够在体外保留患者组织本身对新型药剂的敏感性,可用于发现和验证新型药物,以及模拟和研究靶向药物的抗性[24-25]。类器官培养技术使得我们能够建立新型头颈恶性肿瘤模型来研究和筛选药物以用于精准治疗。
2.2 头颈肿瘤类器官培养
类器官由两种主要类型的干细胞培养而成:①多能胚胎干细胞及诱导多能干细胞;②成体干细胞或肿瘤干细胞。目前有多种类器官培养方法,大部分需要干细胞、基质胶和富含细胞因子的培养基。小鼠类器官维持培养需要加入N-乙酰-1-半胱氨酸、烟酰胺、表皮细胞生长因子(epidermal growth factor,EGF)、成纤维细胞生长因子(fibroblast growth factor,FGF)10、R-spondin蛋白,人头颈肿瘤类器官维持培养需要加入的细胞因子与小鼠类器官相似,但需额外加入B27细胞培养添加剂、转化生长因子-βI型受体抑制剂、前列腺素E2、FGF2、骨形态遗传蛋白。使用肿瘤干细胞培养头颈肿瘤类器官,平均而言,可以在10~14 d内建立,石蜡包埋肿瘤类器官的免疫组化结果显示基底细胞标记物肿瘤蛋白P63(tumor protein 63,TP63)和细胞增殖相关抗原(marker of proliferation,MKI67或Ki-67),提示肿瘤类器官培养成功。在肿瘤类器官外层可见增殖性标记MKI67+/TP63+基底细胞;在类器官内层细胞中可见分化标记角蛋白13(keratin 13,KRT13);另外使用透射电子显微镜观察到角质形成细胞的特征,例如大量的张力丝和桥粒;以上提示肿瘤类器官能够概括起源组织的特性[27]。以往研究人员将肿瘤组织分解成单个细胞后在含有基质胶的培养基中制备类器官,容易出现失巢凋亡,为了提高类器官培养率,可加入Ras同源基因-Rho相关螺旋卷曲蛋白激酶抑制剂抑制失巢凋亡[28]。最近,Tanaka 团队[5]提出癌组织起源球方法,即将手术切除或活检获得的肿瘤组织简单分解成肿瘤组织碎片而不是单个细胞,细胞簇在24 h内迅速形成球形,进而快速有效建立头颈肿瘤类器官模型,能够有效避免失巢凋亡的发生。王显文等[29]使用鼻咽癌患者来源肿瘤组织,通过肿瘤形态学、组织病理学鉴定(KI67、CD133免疫组化)、EB病毒编码RNA原位杂交技术等鉴定方法,成功培养鼻咽癌肿瘤类器官,并用于药物筛选,然而,笔者在文中亦提到研究的局限性。肿瘤微环境复杂,包含血管、神经、免疫细胞、肿瘤相关成纤维细胞等,在体外重建肿瘤微环境是类器官技术的难点,为了体外重建肿瘤免疫微环境,Neal 等[30]将肿瘤组织培养成肿瘤类器官后,使用气液界面方法将类器官与具有天然免疫细胞(T、B、NK、巨噬细胞)的肿瘤上皮细胞在同基因免疫活性宿主中共培养;Nakamura等[31]提出类器官与肿瘤成纤维细胞共培养方案;此外,血管类器官的成功培养,有望解决体外肿瘤类器官血管化难题[32-33]。
3 头颈部肿瘤类器官的应用
3.1筛选基因突变
Tanaka等[5]进行全基因组测序和磷酸化定量蛋白质组学分析,以鉴定和探索对头颈恶性肿瘤患者有用的生物标记物。Driehuis等[23]成功培养了31例头颈恶性肿瘤类器官,对其他的16例进行基因组测序,发现69%存在P53突变,43%存在磷脂酰肌醇- 4,5-双磷酸3-激酶催化亚基α突变,25%存在KRAS原癌基因突变,在58个差异最大的表达基因中(P<0.01),发现激肽释放酶相关肽酶6、溶质载体有机阴离子转运蛋白家族成员1B3、同源盒C13基因、钙结合蛋白1、ETS同源因子和丁酰胆碱酯酶发生了突变。研究人员对肿瘤类器官和肿瘤组织进行对比测试,发现肿瘤类器官出现变异等位基因频率富集,这可能是由于肿瘤类器官缺乏免疫、血管、神经等肿瘤微环境所致。此外,还对比检测了肿瘤类器官以及正常组织类器官,仅发现肿瘤类器官存在单核苷酸变异、染色体的缺失和插入。
3.2 测试抗癌药物敏感性及耐药性
肿瘤类器官模型已用于药物筛选研究和生物标志物分析[2, 34-35]。Shah等[6]将细胞代谢的光学成像技术与类器官技术结合,对类器官细胞异质性和标准化治疗的反应,包括细胞增殖、细胞死亡和体内肿瘤体积以及在平行研究中验证每个治疗组的治疗功效进行了定量和定性分析。结果表明光学代谢成像在治疗1 d后对类器官中的治疗反应敏感(P<0.05),具有不同代谢表型的细胞亚群可提供灵敏的高通量测定,以简化头颈恶性肿瘤药物开发的过程。Tanaka[5]团队分别测试相应类器官对顺铂及多西他赛的药物敏感性以及耐药范围,类器官药物敏感性及耐药性存在个体差异。Driehuis等[23]使用了突变和转录作用、染色体稳定性、异种移植、新药和常规化疗/放疗测试。此外,Driehuis 团队还使用头颈鳞状细胞癌类器官模型通过抗体-纳米体光敏剂结合物来评估表皮生长因子受体(epithelial growth factor receptor,EGFR)靶向光动力疗法的潜力,发现来自不同患者的肿瘤类器官的EGFR表达水平不同,EGFR表达水平与EGFR靶向光动力疗法的疗效相关,从周围正常组织培养的类器官显示出比其肿瘤对应类器官更低的EGFR表达水平,提示纳米体靶向光动力疗法比抗体靶向光动力疗法更有效[4]。体外建立头颈恶性肿瘤类器官模型,保留了原代肿瘤的许多特性,这些类器官可以预测体内的药物敏感性,且有望成为头颈恶性肿瘤精确治疗的有用工具。
3.3 头颈恶性肿瘤免疫治疗
细胞程序性死亡受体/配体(programmed cell death protein 1/programmed cell death 1 ligand 1,PD-1/PD-L1)免疫疗法是当前备受瞩目的新一类抗癌疗法, 抗PD-1抗体和PD-L1抗体在头部肿瘤尤其是在头颈鳞状细胞癌的治疗上已经取得了重要的进展[36-37]。目前至少有5种抗PD-1和抗PD-L1抗体正处于临床研究阶段:pembrolizumab和nivolumab作用于PD-1靶点,德瓦鲁单抗(durvalumab,又称MEDI4736)、阿维单抗(avelumab)和阿特珠单抗(atezolizumab,又称MPDL3280A)作用于PD-L1靶点,但头颈恶性肿瘤的免疫疗法相对滞后,类器官技术的应用有助于免疫治疗的发展。Neal等[30]利用肿瘤类器官成功地模拟了具有抗PD-1和/或抗PD-L1扩增和激活肿瘤抗原特异性浸润性淋巴细胞并引发肿瘤细胞毒性的免疫检查点封锁,该研究提示具有内源性免疫基质的肿瘤类器官能进行免疫肿瘤学研究,并促进个性化免疫疗法检测,有利于癌症患者的个体化精准治疗。
3.4 再生医学
头颈部恶性肿瘤的放射治疗会导致唾液腺的损伤,出现口腔干燥等症状。Bücheler 等[38]在微载体中培养唾液腺类器官,提出了重构唾液腺功能的新概念。Ozdemir 等[39]利用从正常唾液腺组织分离的原代人涎腺肌上皮细胞(human salivary gland myoepithelial cells,hSMECs)和干/祖细胞来生成唾液腺微组织,在多代培养过程中,肌上皮细胞的表型与其他外分泌组织的表型一致。此外,hSMECs分泌基底膜蛋白,表达肾上腺素能和胆碱能神经递质受体,并在副交感神经激动剂的作用下释放细胞内钙。功能性腮腺类器官成功培养,有望重构唾液腺功能,帮助癌症患者解决口干问题。
4 展望
为了建立更好的药物筛选模型,研究人员应用并发展了头颈部肿瘤类器官培养技术,利用类器官拥有的能够长期传代、维持遗传异质性、可冻存及复苏等优点,有望建立头颈肿瘤类器官生物库。头颈肿瘤类器官生物库一旦建立, 我们可以使用各种类型的头颈部类器官肿瘤模型,对其进行基因组测和表达谱分析,可以用于筛选突变基因,作为药物筛选“替身”,测试抗癌药物的敏感性以及耐药性,开发免疫治疗新药等。放射治疗所致唾液腺损伤有望使用腮腺类器官重构唾液腺功能,帮助癌症患者解决口干问题。类器官模型有许多优点,但也存在缺点。类器官培养的难点在于如何在体外重建肿瘤微环境,现有研究人员将肿瘤相关成纤维细胞与肿瘤细胞共同培养,作为评价肿瘤微环境的有用工具[31],也有使用干/祖细胞、支架和特定的调节因子来提供模拟器官发生的微环境的方法[40]。类器官模型可用于研究肿瘤细胞与包括基质细胞在内的微环境之间的互作关系。未来的肿瘤类器官研究也会更加注重培养体系的完善, 如加入巨噬细胞或者淋巴细胞、血管类器官、神经元等,使得类器官的培养体系更加接近于活体的肿瘤微环境, 进而为研究微环境与肿瘤之间的关系提供一个理想的模型,为精准医学的发展提供更多支持。

