不同饮食习惯下镉摄入对肠道菌群结构的影响
覃一书,保欣晨,汪 洁,于 淼,田 稳,张梦研,向 萍 (西南林业大学生态与环境学院/环境修复与健康研究院,云南昆明 650224)
近年来,环境污染带来的食品安全问题广受关注[1-2],重金属超标食品(如镉大米等)潜在的健康风险成为了研究热点之一[3].我国镉(Cd)污染以 7%的点位污染率居重金属污染首位[4].Cd分布广泛、毒性持久,其污染及危害已成为严重的环境医学问题.食物的生产、运输过程存在重金属污染的风险[5].大量研究发现,重金属污染区域食物(肉类[6]、水产品类[7-8]、谷物蔬菜类[9-10]等)中重金属Cd含量普遍较高,可见人体摄入Cd的频率不容忽视.
食物摄取是人体重金属暴露的主要途径之一.被污染的食物经口摄入,通过胃肠道的消化吸收,经过血液循环,积聚在人体器官、组织内会导致器官功能和代谢的异常,进而对人体产生毒性效应.Cd的摄入不仅会对肝、肾、胃等器官造成危害,也会对肠道造成影响[11].肠道菌群是肠道屏障的重要组成部分,也可能是环境污染物生物有效性和毒性的重要中介,它们以不同的吸收方式与肠道内的金属相互作用.不被吸收的Cd残留物不仅会影响肠道菌群结构,还会影响肠道屏障功能,进而影响机体功能[12].已有研究表明,低剂量Cd暴露会导致小鼠肠道菌群改变,增加肠道的通透性来影响肝脏基因的表达,造成雄性小鼠肝脏脂质代谢紊乱和脂肪堆积[13-14].此外,重金属暴露时间长短会对肠道菌群变化产生显著差异[15].
肠道菌群可通过多种方式(吸收、代谢、隔离和排泄)对重金属进行解毒,其中饮食是此过程的主要因素.不同饮食因其不同的营养结构,会对肠道微生物结构产生巨大差异性.有研究表明,高脂饮食影响肠道菌群导致肥胖发生的机制是通过降低厚壁菌门比例,提高拟杆菌门比例,从而降低对胰岛素和瘦素等的敏感度[16-17].肥胖也可以反过来影响肠道菌群的组成,进一步加剧肥胖,甚至导致其他疾病的发生.
随着人们生活水平的提高,高脂食物摄入量显著增加[18].因此,Cd和高脂一起进入人体消化系统的概率成为高频事件,其健康危害研究十分迫切.此外,Cd或者高脂均可诱发肥胖[19-20].然而,高脂食物和Cd污染食物一起被人体摄入后会对肠道菌群结构产生什么样的影响,它与正常饮食Cd暴露之间又存在哪些差异仍然未知.本研究通过探究高脂饮食和正常饮食下Cd摄入对肠道微生物菌群结构的差异,为人们健康饮食和有效防控提供参考.
1 材料与方法
1.1 试验材料及设计
正常饲料(江苏省协同医药生物工程有限责任公司)、高脂饲料(TP23101,脂含量45%)及对照饲料(TP23103,脂含量10%)(南通特洛菲饲料科技有限公司)、CdCl2·2.5H2O(AR)[21-22],玉米芯垫料(江苏省协同医药生物工程有限责任公司).
将7周龄雄性C57BL/6小鼠(购自湖南斯莱克景达实验动物有限公司)置于控制温度和光照的房间里((23±2)℃,12h光照-暗交替),经过 1周的驯化,随机分成4组,每组4只(表1).试验期间,每3d更换饲料、饮水及垫料等,并及时进行鼠笼的清洁.喂食20周后,称取各小鼠体重,并收集各组实验小鼠的粪便样品,进行16S rRNA高通量测序.

表1 各处理组的饮食情况Table 1 Diet of each treatment group
1.2 16S rRNA高通量测序及生物信息处理
对小鼠粪便进行总DNA提取,利用琼脂糖凝胶电泳对总DNA进行定性检测后,进行浓度和纯度的测定.选择 16S V3-V4可变区,使用引物 338F(5′-ACTCCTACGGGAGGCAGCAG-3′)/806R(5′-GGA-CTACHVGGGTWTCTAAT-3′)进行 PCR 扩增;得到的扩增产物经 2%的琼脂糖凝胶检测,切胶回收,进行定量分析.构建MiSeq文库,利用Illumina MiSeq平台进行高通量测序.本研究测序工作交由上海伯豪生物技术有限公司完成.
测序得到的原始数据存在干扰项,在进行拼接、过滤后,进行 OUTs聚类[23]和物种分类的分析,序列相似度达 97%则为一个 OUT.将 OTUs与物种注释相结合,以便于后续基于OTUs聚类进行物种丰度、多样性分析以及各分类水平(界、门、纲、目、科、属、种)微生物群落结构组成分析.
1.3 数据处理与统计
采用 Excel、R语言等软件对实验数据进行处理和绘图,并对数据进行差异显著性检验(One-way ANOVA, Mean±SEM),若 P<0.05,则有统计学意义.
2 结果与分析
2.1 不同饮食习惯下Cd摄入对小鼠体重的影响
体重作为小鼠生长发育的一种基本生理指标,可直观地表现出不同的处理方式对小鼠产生的影响.如图1所示,对雄性C57BL/6小鼠进行长达20周的不同饮食饲养以及 10mg/L CdCl2溶液暴露后,发现与饲喂正常饲料(ND、ND+Cd)的小鼠相比,高脂饲料(HFD、HFD+Cd)的摄入使小鼠体重明显增加,表现出肥胖;而无论是在正常饮食,还是高脂饮食下,Cd摄入(ND+Cd、HFD+Cd)对小鼠体重的增长均无明显作用.

图1 不同处理后小鼠体重的变化Fig.1 Weight changes of mice after different treatments
2.2 不同饮食习惯下Cd摄入对肠道微生物群落结构的影响
2.2.1 OTUs聚类分析 4组样品共获得有效序列736522条,其中 ND组样品包含 169146条,ND+Cd组样品包含 214270条,HFD组样品包含 201706条,HFD+Cd组样品包含192022条;分属10门,18纲,27目,50科,87属.
通过分类操作单元(OTUs)韦恩图(图 2),研究不同处理组间 OTU组成的相似性和重叠性.全部样品总共获得为6620个OTU,4组(ND、ND+Cd、HFD、HFD+Cd)样品的OTU总数分别为2128、2388、3282、3107,独有的OTU数分别为607、772、1408和1346;两两处理组(ND/ND+Cd、ND+Cd/HFD、HFD/HFD+Cd、HFD+Cd/ND)之间共有的OTU数分别为986、1163、1305、1013与ND组OTU数相比,ND+Cd、HFD和HFD+Cd组的OTU数分别增长了12.22%、54.23%、46.01%.数据表明,高脂饮食或/和Cd摄入均可提高小鼠肠道的微生物多样性.高脂饮食下摄入Cd降低了高脂饮食下的微生物多样性.
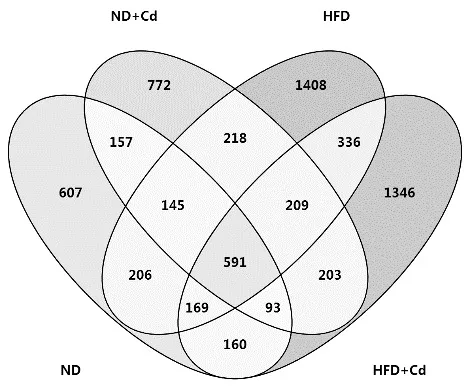
图2 韦恩图Fig.2 Venn diagram
2.2.2 肠道微生物 Alpha多样性分析 微生物群落物种多样性的常用评价指标是多样性指数和丰富度指数.本研究采用Shannon指数和Simpson指数来评价小鼠肠道菌群的多样性;微生物菌群丰富度则由Chao1指数和ACE指数来表示.Alpha多样性分析见表 2,各组中的 Coverge都在 0.977以上,说明数据代表了样品中 97.7%以上的细菌类型,测序的深度、广度都符合要求.ND+Cd、HFD、HFD+Cd组的 ACE、Chao1和Shannon指数均比ND 组高(P>0.05), Simpson指数比 ND 组低(P>0.05).表明,高脂饮食或/和Cd摄入在一定程度上提高了小鼠肠道菌群多样性(P>0.05),高脂饮食下摄入Cd,肠道菌群无明显变化(P>0.05).此结果与上述OTUs聚类分析基本吻合.

表2 不同处理后肠道菌群的Alpha多样性变化Table 2 Changes of Alpha diversity of gut microbiota after different treatments
2.2.3 基于Unifrac的主坐标分析(PCoA) PCA分析(图3 (a))可以直观地看出不同组之间并未出现明显的分离.本文采用加权 Unifrac距离来分析微生物群落.PC1和PC2是两个主坐标成分,PC1表示尽可能最大解释数据变化的主坐标成分,PC2为解释余下的变化度中占比例最大的主坐标成分,以此类推.PCoA图中,样品距离越近,物种组成结构就越相似.因而,群落结构越相似,样品聚集程度越高;相反,样品离散程度越大,则表示群落差异越大.如图3(b)所示,PC1贡献率为43.50%,PC2贡献率为16.64%,总贡献率为60.14%.第一主轴使得 ND组和 HFD、HFD+Cd组相互分离(P<0.05);第二主轴分离了HFD+Cd组和ND、ND+Cd组,且HFD+Cd组和ND+Cd组存在显著差异(P<0.05).根据肠道微生物组的个体差异,ND组、HFD组被分为了2个亚组; HFD+Cd组样品基本集中在1个区域,结构分布较为紧凑,相似度较高;ND+Cd组离散程度较高,组内差距较大.表明,高脂饲料或/和Cd摄入都会干扰小鼠肠道菌群原有的结构.
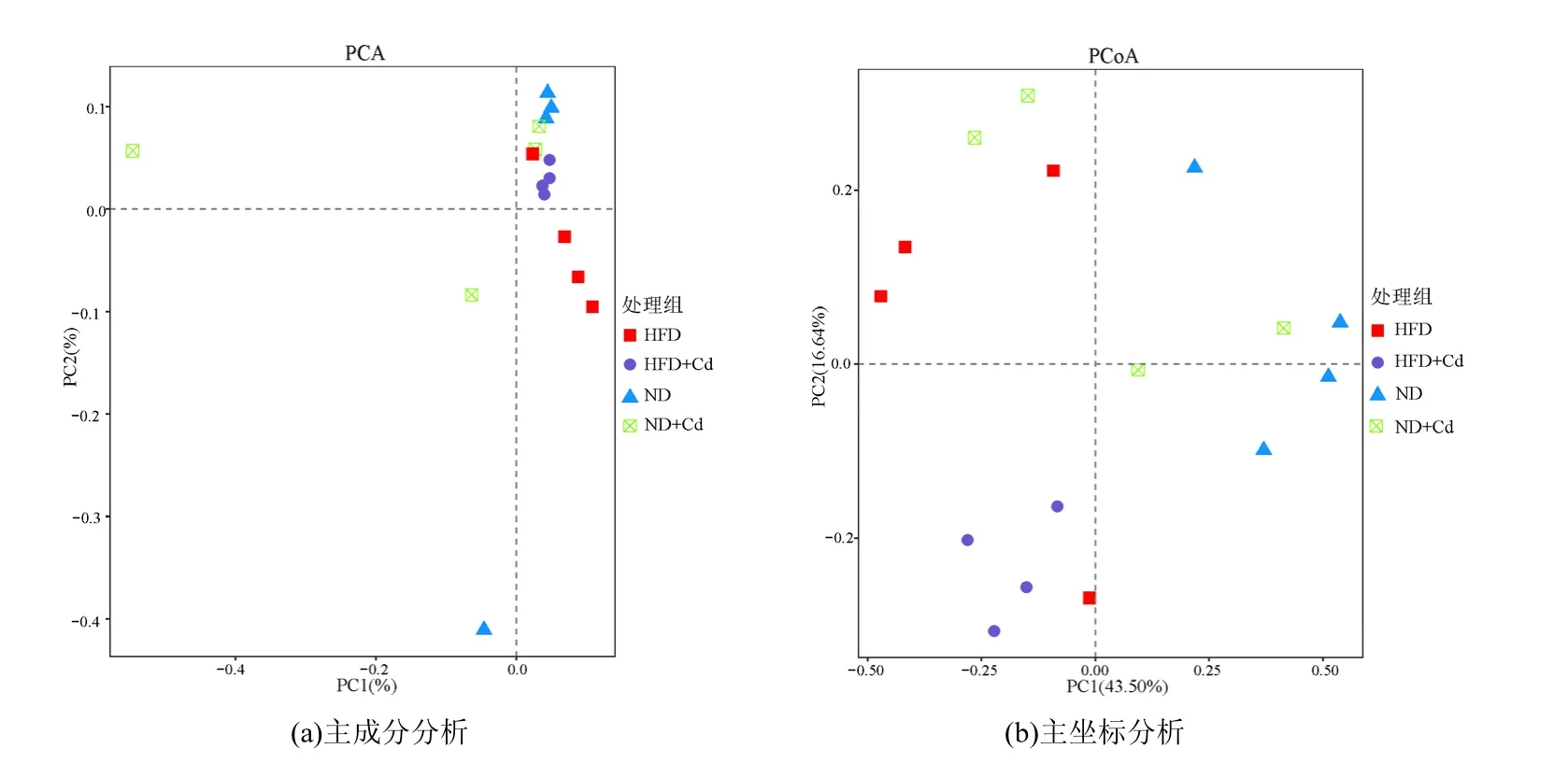
图3 不同处理后肠道菌群的Beta多样性分析Fig.3 The Beta diversity of the gut microbiota after different treatments
2.2.4 Lefse分析 Lefse分析是一种用于发现和解释高维度数据生物标识的分析工具,可以实现多个分组之间的比较,强调统计意义和生物相关性,能够在组间找到在丰度上有显著差异的物种.结果显示(图4),群落结构在各分类水平都发生了变化,共1个门、3个纲、4个目、6个科和10个属上的物种在各处理组中存在着显著差异.ND组差异物种富集于拟杆菌(Bacteroidia、Bacteroidales、Bacteroidales_S24_7_group);ND+Cd组中疣微菌(Verrucomicrobiae、Verrucomicrobiales、Verrucomicrobiaceae)、阿克曼菌(Akkermansia)和 Erysipelatoclostridium存在差异;HFD组中的差异物种集中在了丹毒丝菌(Erysipelotrichia、Erysipelotrichales、Erysipelotrichaceae);而 HFD+Cd组中毛螺旋菌(Lachnospiraceae、Lachnospiraceae_NK4A136_group)、梭菌(Clostridia、Clostridiales)、 理 研 菌 (Rikenellaceae、Rikenellaceae_RC9_gut_group)、瘤胃球菌(Ruminococcaceae、Ruminococcaceae_UCG_014)、另枝菌(Alistipes)、链球菌(Streptococcus)、粪球菌(Coprococcus_3)、罗斯氏菌(Roseburia)和凸腹真杆菌([Eubacterium]_ventriosum_group)与其他组存在显著差异,它们绝大多数归属于厚壁菌门.

图4 不同处理后的Lefes分析Fig.4 LDA Effect Size analysis after different treatments
2.2.5 小鼠肠道菌群结构的变化 (1)门水平小鼠 肠道菌群结构的变化 在门分类水平上共获得10个门.如图5 (a)所示,在各处理组共有的小鼠肠道菌群中处于前 5位的菌群分别是拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、变形杆菌门(Proteobacteria)、软壁菌门(Tenericutes),其中拟杆菌门和厚壁菌门均为各处理组的优势菌群.然而,拟杆菌门和厚壁杆菌门的数量在各组中是有差异的.

图5 不同处理后的门水平物种分布Fig.5 Species distribution in different treatments on phylum .level
通过图 5(b)发现,在 ND 组中,拟杆菌门和厚壁菌门的相对丰度之和约为所有样本细菌总数的(92.82±4.19)%.与正常饮食相比,高脂饮食小鼠的肠道内拟杆菌门[HFD 组(34.69± 10.23)%、ND 组(79.14±4.57)%]丰度下降了 2.28 倍(P<0.05),放线杆菌门[HFD 组(37.13±5.68)%、ND 组(3.60±3.78)%]丰度增加了 10.31倍(P<0.05),厚壁菌门丰度也有一定水平的上升(P>0.05).在不同饮食下摄入 Cd,肠道菌群结构会表现出不一样的反应.正常饮食下Cd摄入使拟杆菌门[ND+Cd组(48.66± 16.89)%,ND 组(79.14±4.57)%]的丰度有所下降(P>0.05);高脂饮食下摄入 Cd使放线菌门[HFD+Cd组(8.13+2.60)%,HFD 组(37.13±5.68)%]的丰度降低了4.57倍(P<0.05).值得一提的是,与ND组相比,在饮食不同的情况下(ND+Cd、HFD+Cd)摄入Cd并不影响厚壁菌门水平;但是 HFD+Cd组[(31.86±7.56)%]相对于 ND+Cd组[(11.37±7.51)%],大大增加了厚壁菌门的丰度(P<0.05).另外,ND+Cd组疣微菌门(Verrucomicrobia)数量显著升高,其丰度约占总菌群的4.67%.
通常Firmicutes/Bacteroidetes (F/B)比值被认为是肠道菌群整体状态的重要参数[24].经计算, ND、ND+Cd、HFD、HFD+Cd组的 F/B比值分别为:(0.18±0.09)、(0.23±0.15)、(1.00±0.40)、(1.36±0.32).ND、ND+Cd、HFD、HFD+Cd组肠道微生物对应的小鼠粪便F/B比值逐渐升高,其中ND与HFD、HFD+Cd ,ND +Cd与HFD、HFD+Cd组之间存在显著差异(P<0.05).根据菌群的正负面作用,把前五的菌门分为“好菌”和“坏菌”两大类.经计算, ND、ND+Cd、HFD、HFD+Cd组小鼠粪便中的“好菌(拟杆菌和疣微菌)”和“坏菌(厚壁菌、放线菌、变形菌)”比例分别为(4.16±0.96)、(3.07±2.23)、(0.59±0.27)、(0.59±0.10),且 ND 组和 HFD、HFD+Cd组存在显著差异(P<0.05).高脂饮食和Cd单一/复合暴露均可改变小鼠原有的肠道菌群结构.
(2) 属水平小鼠肠道菌群结构的变化 选取丰度大于 1%的菌群,按其在样本中的丰度,在物种和样本两个层次上进行聚类,形成热图(图6).实验结果表明,各处理组肠道菌群在属上存在差异,且高表达的菌群不存在重叠,表明肠道菌群发生了紊乱.ND组小鼠粪便中含有大量的拟杆菌(Bacteroides)、拟普雷沃菌(Alloprevotella)、副拟杆菌(Parabacteroides),还有丰度小于1%的其他菌群.相对ND组,摄入高脂饮食后(HFD组),小鼠肠道菌群的组成发生了变化,拟杆菌、拟普雷沃菌、副拟杆菌的表达量下降,使得双歧杆菌(Bifidobacterium)、杆菌(Turicibacter)、乳杆菌(Lactocacillus)大量表达成为了优势种;其中双歧杆菌((36.56±5.63)%)的丰度大幅度上升,相当于ND 组(2.55±3.40)%)的 14.34倍.与 ND 组相比,Cd的摄入(ND+Cd组)使拟杆菌、拟普雷沃菌、副拟杆菌减少,出现了更多的未培养的拟杆菌(uncultured Bacteroidales bacterium)、阿克曼氏菌(Akkermansia)、肠杆菌(Enterorhabdus)、螺杆菌(Hlicobacter).HFD+Cd组较之ND +Cd组降低了双歧杆菌、杆菌、乳杆菌的丰度,瘤胃球菌 UCG-014(RuminococcaceaeUCG-014)、另枝菌属(Alistipes)、毛螺菌 NK4A136group (LachnospiraceaeNK4A136 group)、布劳特氏菌(Blautia)、脱硫弧菌(Desulfovibrio)成为了优势种群.摄入 Cd后,正常饮食和高脂饮食中出现的菌群表达各不相同.副拟杆菌的表达在ND、ND+Cd、HFD+Cd、HFD组中逐渐降低.

图6 不同处理后属水平物种丰度聚类热图Fig.6 Cluster thermal images of species abundence at the genus level of the microbial community after different treatments
3 讨论
3.1 高脂饮食导致肥胖,影响肠道菌群组成
生活水平的提高使人们的饮食水平发生了巨大的变化,饮食健康问题逐渐成为社会焦点.高脂食物大频率地出现在人们的生活中,而高脂饮食的摄取能够导致肥胖的发生.肥胖增加肝病、糖尿病、肠炎等疾病的患病风险,已被世界卫生组织定义为慢性病[25-26].在本文研究中,高脂饮食促进了小鼠体重的增长,并较正常饮食组存在明显差异(图1).高脂饮食导致的肠道菌群结构改变可能与肥胖相关[27].肠道微生物维持机体功能的正常,其稳态的破坏,可能会导致宿主肠道功能的丧失,引发各种疾病[28-30].Ley等[31]首先报导了肥胖与肠道微生物存在关系,同窝生的肥胖小鼠相较于瘦小鼠有着更少的拟杆菌门和更多的厚壁菌门[27].
人体第一次接触到复杂的微生物群始于出生时通过产道[32].肠道菌群并不是一成不变的,它会因人、物、境的不同会发生相应的改变.肠道的影响因素有很多,其中饮食被认为是影响肠道微生物菌群结构最重要的决定因素.越来越多的研究表明,饮食的成分直接影响到肠道菌群的组成[33-34].高脂饮食作为一种典型的生物体肠道破坏性因素,会破坏肠道环境,降低肠道微生物群落多样性[35].而在本文研究中,高脂饮食的摄入却增加了小鼠粪便内的 OTU数, alpha多样性也有一定程度的提高(P>0.05).实验结果的不同可能源于研究方法上的差异和个体间的差异.正常的肠道微生物在门水平上,丰度最高的是拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和变形杆菌门(Proteobacteria),其约 90%的肠道菌群由厚壁菌门和拟杆菌门组成[36-37].在本文研究中,ND组的四大优势门为拟杆菌门、厚壁菌门、放线菌门和变形杆菌门,且拟杆菌门和厚壁菌门约占总菌群的92.82%(图5a),与前人研究基本一致.有研究者认为,肠道紊乱与肠道微生物的 F/B比值有关.拟杆菌门的数目会随着饮食的改变(低糖、低脂向高糖、高脂饮食转变)而急速下降.高脂的摄入和肥胖都会导致肠道内F/B比值明显提高[31,38-43].与之相似,在本文中,ND 组小鼠的肠道微生物差异物种富集于拟杆菌;长期摄入高脂饲料后,小鼠的肠道微生物差异物种发生了改变,富集在了厚壁菌门的丹毒丝菌上(图4).高脂食物的摄取,导致了拟杆菌门(P<0.05)的下降和厚壁菌门(P>0.05)、放线菌门(P<0.05)的增加,使得 F/B 值显著升高(图 5b).也有人认为,F/B 比值与胖瘦无关,甚至可能是相反的.Hekmatdoost等发现,高脂饲料喂养的小鼠粪便中拥有着更多的拟杆菌数目,益生菌数目会减少[44].这些矛盾的结果使得 F/B比值与肥胖的关系尚无定论. 赵立平团队认为,要深入挖掘肠道微生物与肥胖的机制,不能忽略菌株水平的差异[45].厚壁菌门中也存不少的有益菌,如乳酸菌,这或许就是 F/B比值尚无定论的原因.近年来的研究表明,除了拟杆菌门和厚壁菌门以外,诸如,放线菌门(负面菌群)、变形菌门(负面菌群)、疣微菌门(正面菌群)等也与肥胖的发生有着重要作用.在本文中,ND组的 “好菌”/“坏菌”比例是(4.16±0.96),HFD组的“好菌”/“坏菌”比例仅为(0.59±0.27),高脂的摄入使肠道内有害菌大量增长(P<0.05).ND组内的拟杆菌属、拟普雷沃菌属、副拟杆菌属数目较多;摄入高脂食物后,这三个属的丰度均大幅度下降了(图 6).高脂食物的摄入会导致乳酸菌和双歧杆菌的降低,其与肝脏脂肪的积累成密切负相关[46].但在本文中,这两种菌属的丰度在高脂饮食下反而增加了;尤其是放线菌门下的双歧杆菌,其表达量更是达到了ND组双歧杆菌10倍以上.值得注意的是,放线菌的增多容易引起内源性感染.细菌多样性低和乳酸菌丰度减少与肠道炎症的发生有关,被认为是结肠癌的诱因.有学者发现,在炎症小鼠体内添加双歧杆菌使其在体内高表达,能够抑制炎症细胞 NF-κB的激活,有效抑制肠道炎症细胞因子的活化及肠粘膜反应,减轻肠道炎症程度[47].高脂饮食小鼠肠道内的双歧杆菌数量的大量增长,有可能是其自身内稳态调控的结果,其机理尚需进一步的研究.
3.2 Cd影响肠道菌群结构
Cd是一种对环境有重大影响的有毒金属.普通人体内的 Cd主要来源于食物和水(除了吸烟以外).食物中的 Cd经口摄入,在肠道内被吸收或者积累.肠道内的微生物是宿主不可或缺的组成部分,在宿主体内维持肠道平衡以及对金属等污染物的降解中扮演着一个中介的角色[48].肠道暴露于有毒重金属可能对常驻菌群产生不同的影响.基于动物模型的研究使重金属和肠道菌群之间的联系有了长足的进展[49-50].
重金属暴露引起肠道微生物群的变化,但在各分类水平的研究上并无一致的结果.研究者们用 Cd暴露小鼠,均发现了肠道菌群的显著改变,有研究发现Cd增加小鼠肠道内拟杆菌门,降低厚壁菌门,也有研究表明Cd降低了小鼠肠道内乳酸杆菌和双歧杆菌的丰度[51-53].Cd摄入使脂多糖增加,改变肠道微生物的代谢活性,并通过引起肠道炎症和细胞损伤来增加肠道通透性[13].Breton等人发现,Cd暴露会降低毛螺旋杆科的丰度,也会引起Clostridia、Clostridiales和短式脂肪酸(SCFA)产生菌丰度的降低,如Lachnospiraceae和Ruminoccaceae呈剂量依赖性降低[54].这与本文结果有所不同.在本研究中,Cd摄入改变了肠道微生物的组成,显著降低拟杆菌门、拟杆菌属、拟普雷沃菌属、副拟杆菌的丰度,使得以阿克曼氏菌属为主的疣微菌门的数量大幅度增加,并出现了更多未培养的拟杆菌属、肠杆菌属和螺杆菌属(图6).与此相似的是,口服Ni、As或Cd等重金属会显著改变正常大鼠肠道微生物的组成,Cd使得肠道内的疣微菌门数量大幅增加[50].Akk菌目前是Akkermansia菌属的唯一菌种,阿克曼氏菌可降解黏蛋白,其丰度与超重、肥胖和高血压等疾病呈负相关[55-58].事物普遍具有两面性,Akk菌也不例外.另有研究证明,Akk 菌的增长似乎也与Ⅱ型糖尿病风险正相关;且在特定的条件下,Akk菌参与促进代谢综合征[59-60].Akkermansia菌的增长提示着 Cd暴露不会引起小鼠肥胖,这与小鼠的暴露后的体重变化(图1)相吻合;但是否会引起其他方面的变化却未可知,有待进一步的研究.
3.3 高脂饮食Cd摄入造成肠道菌群紊乱
肠道菌群可能通过吸收、代谢、隔离和排泄的方式对重金属进行解毒,其中饮食是这个过程的主要因素.食物重金属对宿主肠道的有害影响可能受到膳食成分的调节.在Liu等[61]的研究中,Cd暴露下,高脂饮食对肠道菌群的影响比普通饮食更大,高脂饮食降低了小鼠肠道菌群的丰度(基于 OTU数量)和多样性(基于 Chao1指数).本研究发现,高脂饮食下摄入Cd,增加了肠道菌群丰度和微生物多样性(图2、表2).与ND+Cd组相比,HFD+Cd组具有更多的厚壁菌门,属上的优势菌群发生了显著的改变.HFD+Cd组相对于HFD组,显著降低了放线菌门、双歧杆菌属的丰度,瘤胃菌属、另枝菌属、毛螺菌属、布劳特氏菌、脱硫弧菌属大幅度增加(图 6).双歧杆菌可抑制有害菌的生长繁殖,其丰度的降低会使得有害菌大量滋生.瘤胃球菌属与肠易激综合症(IBS)相关,且疼痛发作的频率与另枝菌属的丰度相关,瘤胃球菌属和另枝菌属丰度的升高或许意味着IBS的发生[62].另外,布劳特氏菌属在血脂调节和抗炎方面有着特殊的功效,其丰度的减少,可能会导致抗炎作用的丧失[63].HFD+Cd组小鼠体内布劳特氏菌属丰度的增高可能是机体应对自身健康危害的调节方式.高脂食物联合Cd暴露可能会增加患肠道疾病的风险.
总的来说,高脂食物和Cd摄入均可改变肠道微生物群落结构,但具体菌群的变化不具有一致性.动物种源、菌群起始差异、饲料成分、污染物的暴露形式(方式、剂量、时间)、样本的收集处理,以及测序技术和分析方法等不同,都可能造成实验结果的差异.本试验采用的自由饮水暴露,相对于灌胃、注射等能更好地模拟正常的摄食方式,但是,自由饮水可能导致每个小鼠的摄水量不一样,也就是摄入的重金属含量产生了差异.这或许是导致了组间差异较大的原因之一.
经口摄入被重金属Cd污染的高脂食物,在肠道中首先被肠道菌群接触.无论是Cd或高脂食物的摄入,亦或是高脂食物和Cd联合摄入,都会直接或间接破坏小鼠肠道菌群结构原有的平衡状态,造成肠道紊乱,使得“坏菌”的数量得到了增加.“坏菌”的增加会给生命体带来了肥胖等疾病.反过来,肥胖的发生也会反过来加剧肠道菌群的失衡,进而影响消化效率,造成一个恶性循环.在重金属污染频繁出现的今天,研究饮食中重金属对肠道微生物结构的影响对人体健康具有重大意义.肠道菌群的改变与人体疾病息息相关,了解不同食物及重金属的摄入对肠道菌群的影响,利于人们提升环境保护意识、食品安全意识,更为人们培养更加良好的饮食习惯,选择更为健康舒适的生活方式提供帮助.
4 结论
4.1 高脂饮食促进了小鼠的肥胖,提高了F/B比值,使“好菌”/“坏菌”的比例较ND组降低了7倍,并且使得放线菌门的丰度增长达10.31倍,双歧杆菌的丰度增长达14.34倍.
4.2 10mg/L Cd暴露增加了以阿克曼氏菌属为主的疣微菌门的数量,使疣微菌门细菌的丰度上升到了肠道总菌群的4.67%.
4.3 在高脂饮食的基础上,10mg/L Cd摄入减少了4.57倍的放线菌门细菌的丰度,使得瘤胃菌属、另枝菌属、毛螺菌属、布劳特氏菌、脱硫弧菌属成为优势菌群.

