铜-腐植酸催化剂制备及催化苯甲醇氧化
王 蒙,沙宇飞,王晓璐,刘全生,周华从
(内蒙古工业大学 化工学院,内蒙古 呼和浩特 010051)
0 引 言
醇氧化成相应的醛是一种在有机合成中应用广泛的反应[1],也是目前研究重点。苯甲醛是一种不可或缺的化工原料,在医药、染料、香料等行业应用广泛[2-4]。目前我国工业生产的苯甲醛通常含有氯化物,导致其在医药、食品等行业应用受限[2]。环保问题已成为我国经济发展中关注的重要问题之一,因此学者们也开发了一些无氯的苯甲醛合成工艺路线,其中由苯甲醇直接氧化生成苯甲醛既经济又环保[5-6]。因此,寻找优良的催化剂催化苯甲醇氧化为苯甲醛成为苯甲醛生产中的关键环节。
通常采用相应的化学计量氧化剂进行苯甲醇氧化,但生成的醛有毒副作用,因此学者采用过渡金属与特定配合物形成的体系做催化剂[7],并在以O2、空气等氧化剂的温和条件下进行催化,效果良好,获得较高的选择性。已有学者构建了以不同金属(如钌、铱、钯等)盐或配合物为催化剂,以氧气或过氧化氢为氧源将醇催化氧化为醛或酮的催化体系[7-11],这些催化剂对醇类的催化氧化有良好的催化效果,但钌、铱、钯等属于贵金属,价格昂贵,不宜大规模使用。相对于这些贵金属,铜成本较低且广泛存在,学者开始研究以铜盐或其配合物为构建催化剂催化醇类的氧化反应[12],构建新的催化体系,实现温和条件下该体系催化醇的高效氧化也是催化氧化领域中的热门研究课题[13-15]。自1984年Semmelhack研究了以氯化铜和TEMPO(2,2,6,6-四甲基哌啶基-1-氧)催化醇类化合物的有氧氧化制得相应的醛和酮以来[16-17],各种铜基催化剂用于氧化反应的报道较多,如Cu3(BTC)2[18]、(bpy)Cu[19]、Cu(I)/NMI[20]等,但这些铜基催化剂的制备都需要昂贵的配体,且催化剂制备方法复杂,因此寻找廉价易得的原料,对铜基催化剂制备及催化醇类氧化具有一定的实际意义与应用前景。
我国褐煤资源丰富,其富含的腐植酸(Humic acids,HAs)在环保、农业、工业、医药等领域应用广泛。腐植酸分子结构复杂,含有羧基、酚羟基、醌基、醇羟基和醚键等多种活性含氧官能团,能与许多有机物和重金属离子作用[21-22],利用腐植酸与金属离子结合制备催化剂是腐植酸的新型利用途径[23-24]。
本研究利用铜离子与褐煤中提取的腐植酸结合制备铜-腐植酸催化剂并用于苯甲醇选择性氧化反应,考察了制备条件和反应条件对催化剂性能的影响,并对催化剂结构进行了表征。构建的铜-腐植酸催化剂具有原料廉价易得、制备方法简单、催化活性和循环使用性优异等优点,能为苯甲醇选择性氧化为苯甲醛提供催化剂参考和基础数据。
1 试 验
1.1 主要试剂与仪器
试剂:一水醋酸铜、无水乙醇、苯甲醇、苯甲醛、TEMPO、N,N-二甲基甲酰胺、碳酸钠、癸烷、萘甲醇、萘甲醛、对氯苯甲醇、对氯苯甲醛、肉桂醇、肉桂醛、糠醛、糠醇,以上试剂均为分析纯,试验过程中无需进一步纯化直接使用。
仪器:DF-101S型集热式恒温加热磁力搅拌器、98-Ⅱ-B型磁力搅拌电热套、TG16-WS型高速离心机、DZF-38型真空干燥箱、GC7900型气相色谱仪,汽化室和检测器温度为230 ℃,柱箱初始温度50 ℃,终温230 ℃,升温速率10 ℃/min,恒温2 min;NEXUS670型傅里叶红外光谱仪,图谱采集范围为400~4 000 cm-1;ESCALAB 250Xi型X射线光电子能谱仪,X射线源为Al Kα靶,功率为200 W,以C 1s(284.6 eV)为标准进行校正;SU8220型扫描电子显微镜,加速电压和激发电压为20 KV;XD8 Advance型X射线衍射仪,采用Cu靶,Ni滤波,Si-Li探测器,测试电压为40 kV×40 mA,测试扫描范围为0~90°,扫描速度为10(°)/min。
1.2 Cu-HAs催化剂制备
利用碱溶酸析法从褐煤中提取腐植酸,萃取过程在间歇反应器中进行,称取2.0 g褐煤粉末分散在350 mL 1 mol/L NaOH溶液中,密封反应器,将混合液在100 ℃下搅拌2 h,过滤,滤液用盐酸调至pH<1,将所得沉淀过滤,80 ℃真空干燥得到腐植酸[23]。铜-腐植酸催化剂制备典型过程如下:在电子天平上精准称取1.0 g一水醋酸铜(Cu(OAc)2·H2O)溶于25 mL蒸馏水中,放在磁力搅拌电热套上常温搅拌10 min,称取1.0 g腐植酸溶于25 mL蒸馏水中,将溶解均匀的一水醋酸铜溶液倒入装有腐植酸溶液的烧杯中,继续搅拌,混匀后的溶液移至聚四氟乙烯内衬的反应釜中,30 ℃老化3 h;反应完成后将反应液离心10 min,蒸馏水洗4次,无水乙醇洗2次,真空干燥箱80 ℃干燥12 h,制得铜-腐植酸催化剂,所构建催化剂记为Cu-HAs。
1.3 Cu-HAs催化剂制备条件优化
腐植酸是结构复杂的混合物,制备催化剂时难以确定一水醋酸铜与腐植酸用量的较优比例,所以首先对一水醋酸铜和腐植酸用量比例进行优化,在此基础上优化催化剂老化温度和老化时间。
1.3.1铜和腐植酸用量优化
按照1.2节催化剂制备方法,固定腐植酸用量1.0 g,称取0.4、0.7、1.0、1.3 g Cu(OAc)2·H2O与1.0 g HAs在30 ℃、3 h条件下制备催化剂。
1.3.2催化剂老化温度优化
根据Cu-HAs催化剂制备方法,称取1.0 g Cu(OAc)2·H2O和1.0 g HAs,老化时间3 h,分别在老化温度30、50、70 ℃下制备Cu-HAs催化剂。
1.3.3催化剂老化时间优化
其他条件不变,称取1.0 g Cu(OAc)2·H2O和1.0 g HAs,制备温度为30 ℃,研究老化时间分别为1、3、5、7 h时对催化剂催化性能的影响。
1.4 苯甲醇的催化氧化
制备不同催化剂催化苯甲醇氧化典型反应过程如下:在聚四氟乙烯内衬中加入苯甲醇1 mmol、Cu-HAs催化剂100 mg、TEMPO 0.5 mmol、Na2CO31 mmol、DMF 5.0 g,充氧气0.1 MPa,在集热式恒温加热磁力搅拌器110 ℃反应3 h,反应完成后,用离心管称取0.3 mmol癸烷作为内标物,将反应釜内胆中的反应物用DMF洗出到离心管刻度9~10 mL,放入高速离心机离心10 min,离心后取少量上清液进行气相色谱分析。
1.5 苯甲醇氧化反应条件优化
1.5.1催化剂用量优化
选取优化条件下制备的催化剂进行反应条件的考察。反应釜内胆中加入1 mmol苯甲醇、0.5 mmol TEMPO、1 mmol Na2CO3、5.0 g DMF,反应条件为90 ℃、3 h,考察催化剂用量分别为50、100、150以及200 mg时的催化反应性能。
1.5.2反应温度优化
温度是影响催化剂性能的重要因素,在底物用量1 mmol、催化剂用量100 mg、反应时间3 h条件下,研究反应温度分别为50、70、90、110和130 ℃时催化剂的催化反应性能。
1.5.3反应时间优化
在催化剂用量100 mg、反应温度110 ℃,研究反应时间分别为1、2、3、4、5 h时的催化反应性能。
1.6 Cu-HAs催化剂的循环使用性
催化剂的稳定性是评价催化剂性能的重要指标。选取循环反应条件为100 ℃、2 h,称取1 mmol苯甲醇,在最优条件下制备的催化剂100 mg,将0.5 mmol TEMPO、1 mmol Na2CO3、5.0 g DMF放入反应釜内胆中。在100 ℃、2 h条件下反应,反应后称取0.3 mmol癸烷,将内胆中的反应物用DMF洗到装有癸烷的离心管中,离心10 min,离心后取少量上清液进行气相色谱分析,则完成第1次循环。将离心后的上清液全部倒掉,用DMF将残留的固体洗3次,每次3~4 mL,进行第2次循环时,在反应釜内胆中加入1 mmol苯甲醇和0.5 mmol TEMPO,然后用DMF将离心管中催化剂和Na2CO3的混合物转移到内胆中,继续在100 ℃、2 h条件下反应。反应结束后,称取癸烷并离心分离,取上清液进行气相色谱分析,后续循环反应操作与第2次循环步骤相同。苯甲醇转化率、苯甲醛产率和选择性计算公式为
式中,XA为苯甲醇转化率,%;NA为剩余苯甲醇物质的量,mol;NA0为初始苯甲醇物质的量,mol;YB为苯甲醛产率,%;NB为苯甲醛的物质的量,mol;NTB为苯甲醛的理论物质的量,mol;SB为苯甲醛选择性,%。
2 结果与讨论
2.1 Cu-HAs催化剂制备条件优化
Cu-HAs催化剂制备条件优化结果如图1所示。由图1(a)可知,随着Cu(OAc)2·H2O与HAs比例的增加,苯甲醇转化率和苯甲醛的产率快速升高,当Cu(OAc)2·H2O与HAs质量比为1.0 时,产率、转化率和选择性均达到最高点,继续增加二者比例,产率、转化率和选择性均下降,因此选择Cu(OAc)2·H2O 与HAs质量比为1∶1时进行催化剂制备。由图1(b)可知,升高老化温度,产率、转化率、选择性均下降,30 ℃时产率、转化率、选择性最高,最优制备温度为30 ℃。由图1(c)可知,随着老化时间延长(1~5 h),转化率和产率逐渐升高,继续延长老化时间产率基本不变,转化率略下降,反应选择性变化不大。老化时间为3 h时,制备催化剂选择性最高,且转化率和产率均达到较高水平,继续延长催化剂老化时间对提升催化剂性能影响不大,本文选择3 h作为催化剂的最优老化时间。

图1 一水醋酸铜与腐植酸质量比、老化温度、老化时间对催化性能的影响Fig.1 Effect of the mass ratio of Cu(OAc)2·H2O and HAs,aging temperature and aging time on the catalytic performance
2.2 HAs和Cu-HAs催化剂结构表征
使用日立SU8220扫描电子显微镜对HAs和Cu-HAs催化剂进行表面形貌分析。HAs的SEM分析如图2(a)所示,HAs形貌为不规则的颗粒状;Cu-HAs催化剂的SEM图如图2(b)所示,其形貌同样是不规则颗粒状。

图2 HAs和Cu-HAs催化剂SEM表征Fig.2 SEM characterization of HAs and Cu-HAs catalysts
用氮气吸附-解吸等温线分析了Cu-HAs催化剂的比表面积和孔结构,结果如图3(a)所示。可知Cu-HAs催化剂主要为介孔结构;图3(b)为HAs和制备的Cu-HAs催化剂的红外表征谱图,HAs及Cu-HAs催化剂在1 593及1 385 cm-1处吸收峰归属于腐植酸中羧基的对称和不对称伸缩振动[25-26],1 039 cm-1处吸收峰归属于C—O的伸缩振动,Cu-HAs催化剂在875 cm-1处新峰的出现可能归属于Cu—O的伸缩振动,表明铜元素与腐植酸成功结合[26-27]。
HAs和Cu-HAs催化剂的XRD表征结果如图3(c)所示。可知19°和26°左右出现了SiO2衍射峰,这可能是腐植酸从褐煤中提取得到,而褐煤中含有SiO2,因此腐植酸中有SiO2存在,铜与腐植酸结合后,SiO2峰仍存在而未见其他新的特征衍射峰,表明所制备的Cu-HAs催化剂为无定形结构,没有固定的晶型;使用XPS对所制备催化剂中铜元素的价态进行表征,测试结果如图3(d)所示。Cu-HAs催化剂中Cu元素的2p3/2信号由2部分组成,分别为932.5和934.5 eV两个结合能峰,932.5 eV归属于Cu0/1+,934.5 eV归属于Cu2+的结合能峰[28],0价铜和1价铜在XPS谱图中难以区分的原因是两者的结合能峰差值接近(0.2 eV以内),938~945 eV卫星峰的出现也表明催化剂中2价铜的存在[29],因此XPS结果表明,所制备的Cu-HAs催化剂中铜元素的存在价态为0/1+与2+共存的形式。

图3 Cu-HAs催化剂表征Fig.3 Characterization of Cu-HAs catalyst
2.3 苯甲醇氧化反应条件优化
2.3.1催化剂用量优化
苯甲醇氧化反应中催化剂用量优化结果如图4所示。可知产率和转化率变化趋势相同,催化剂用量从50 mg增加到100 mg时,产率和转化率快速上升,催化剂用量为150 mg时产率和转化率稍高于100 mg,继续增加催化剂用量,产率和转化率变化不大,维持在70%左右,选择性基本在97%左右。试验中发现反应体系呈浆态,催化剂用量越大,颗粒分散性越差,影响反应过程中的传质,当催化剂用量较大时,由于催化剂体积较大,反应后样品处理过程中产物在催化剂上的吸附也会使苯甲醛产率略下降,因此选择100 mg作为最优催化剂用量。
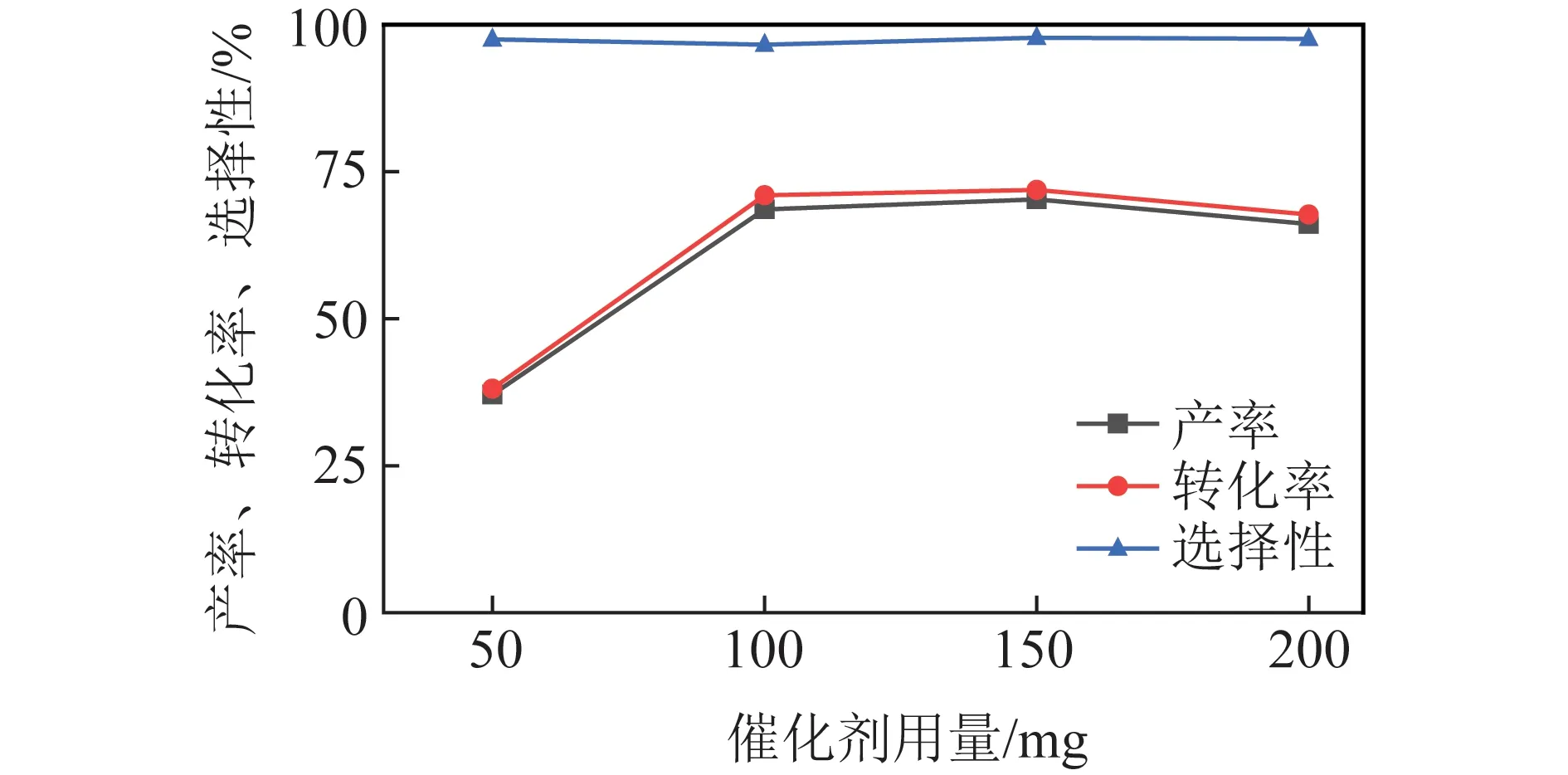
图4 催化剂用量对催化性能的影响Fig.4 Effect of catalyst amount on catalytic performance
2.3.2反应温度优化
苯甲醇氧化反应中反应温度优化结果如图5所示。可知产率和转化率变化趋势基本相同。50~110 ℃,产率和转化率上升幅度较大,当反应温度上升到110 ℃时,产率和转化率达到最高,约90%;温度高于110 ℃,产率下降且在气相色谱中观察到未知副产物,转化率基本不变,而选择性在90 ℃时高达98%,温度超过90 ℃略下降,对产率没有明显影响。综上所述,选择110 ℃作为较优反应温度。
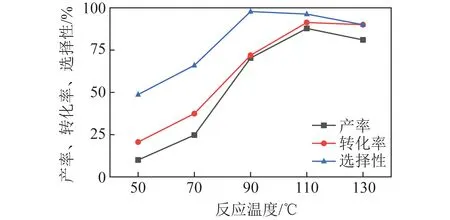
图5 反应温度对催化性能的影响Fig.5 Effect of reaction temperature on catalytic performance
2.3.3反应时间优化
苯甲醇氧化反应中,反应时间对催化性能的影响如图6所示。可知产率和转化率在1~3 h上升幅度较大,从40%上升到90%左右,反应时间为3 h时,产率、选择性均最高,4 h时产率、选择性略下降,转化率略升高,选择性无明显变化规律,产率下降的原因可能是随着反应时间的延长,反应过度氧化生成相应的酸或其他副产物,因此选择3 h作为较优反应时间。

图6 反应时间对催化性能的影响Fig.6 Effect of reaction time on catalytic performance
2.4 Cu-HAs催化剂循环使用性
Cu-HAs催化剂循环使用性考察试验结果如图7所示。可知第1次循环后,产率为70%左右,而经第2次循环,产率上升了10%,这可能是由于第1次反应后催化剂被活化,催化剂经6次循环后,产率、转化率、选择性基本不变,维持在80%左右,说明Cu-HAs催化剂有良好的稳定性。

图7 Cu-HAs催化剂循环使用性Fig.7 Recycling ability of Cu-HAs catalysts
2.5 Cu-HAs催化剂循环使用后表征
使用SEM对循环前后催化剂进行形貌分析,循环前催化剂形貌如图8(a)所示,可知Cu-HAs催化剂为不规则颗粒状。循环后SEM图如图8(b)所示,可知循环后催化剂仍为不规则颗粒状,催化剂粒径分布表明循环后粒径变小,这可能是由于溶剂对催化剂有分散作用,经多次循环反应后大颗粒变小。循环前后EDS能谱如图8(c)、(d)所示,Cu含量在循环前后无明显变化,说明Cu没有明显浸出。

图8 Cu-HAs催化剂循环前后SEM-EDS表征及粒径分布Fig.8 SEM-EDS characterization and particle size distribution of Cu-HAs catalyst before and after cycle

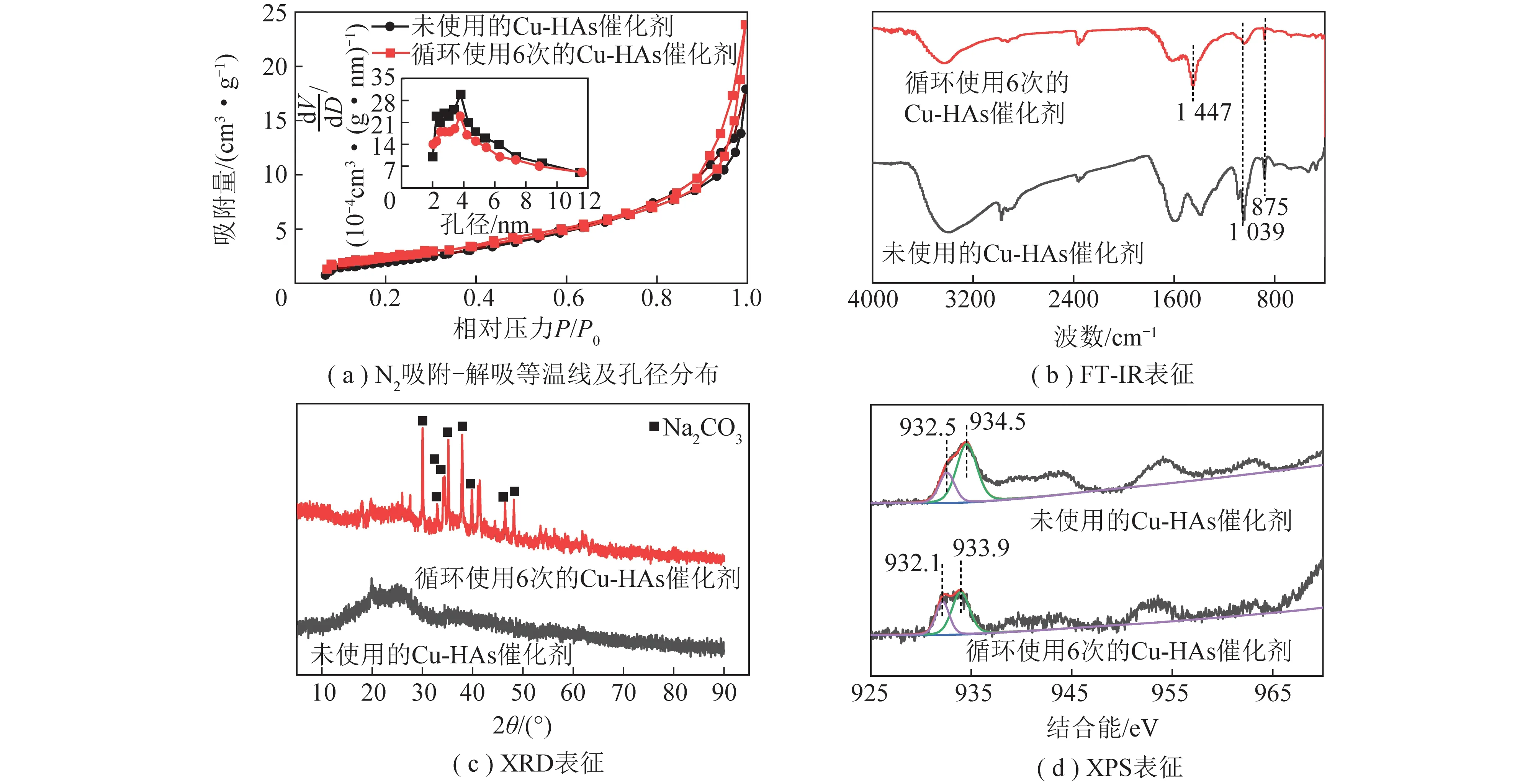
图9 Cu-HAs催化剂循环使用前后表征Fig.9 Characterization of Cu-HAs catalyst before and after recycling
综上所述,通过SEM、氮气吸附-解吸等温线、FT-IR、XRD、XPS等表征方法对循环使用前后Cu-HAs催化剂进行结构表征,结果表明循环使用后的Cu-HAs催化剂形貌结构和性质与循环使用前基本一致,说明所制备催化剂具有良好的稳定性。
2.6 底物拓展
由于Cu-HAs催化剂用来催化苯甲醇氧化能够达到较高的产率,为了考察催化剂对不同结构底物的催化性能,采用Cu-HAs催化剂对不同结构的醇类化合物进行催化氧化,结果见表1。
由表1可知,Cu-HAs催化剂具有较好的底物普适性,对多种不同结构的醇都能达到较好的催化氧化效果,在100~110 ℃、10 h条件下,多种醇类化合物经Cu-HAs催化剂催化氧化,反应产率均达到90%左右。表明所构建Cu-HAs催化剂对不同结构的醇类化合物均具有良好的氧化性能。

表1 Cu-HAs催化剂催化多种醇类化合物氧化
3 结 论
1)提出了以低阶煤基腐植酸为原料制备含铜催化剂的新策略,从褐煤中提取的HAs可直接用于催化剂制备,无需进一步处理和分离,催化剂制备原料廉价易得。
2)对制备的Cu-HAs催化剂进行结构表征,可知铜离子与腐植酸中的酸性官能团结合,催化剂形貌为不规则颗粒状且无固定晶型,主要是介孔结构。该催化剂具有较好的催化氧化活性及循环使用性,具有一定的底物普适性,能催化多种不同结构的醇类化合物选择性氧化得到相应的醛。

