家蚕A型咽侧体抑制激素对白僵菌感染的抑制作用
苏 韵 吴万明 林 苏 赵 泽 王 新 陈润浈 ,2 李木旺,2 孙 霞,2 张振东,2 郭锡杰,2(江苏科技大学生物技术学院,江苏镇江 2200; 2中国农业科学院蚕业研究所,江苏镇江 2200)
家蚕(Bombyxmori)是重要的经济昆虫之一,是探索昆虫免疫防御机制和宿主与病原互作机制的重要模式生物。球孢白僵菌(Beauveriabassiana)是蚕业生产上对家蚕危害最严重的病原真菌之一,但也被广泛应用于农林害虫的生物防治。在我们的前期研究中,发现家蚕感染球孢白僵菌后A型咽侧体抑制激素(A type allatostatin,AST-A)基因的表达水平明显上调,咽侧体抑制激素前激素原(allatostatin preprohormone,AST-P)基因的表达水平相应下调(未发表数据)。咽侧体抑制激素是一类具有多种功能的昆虫神经肽,其主要的功能是抑制保幼激素(juvenile hormone,JH)的生物合成,同时从昆虫的发育过程到摄食、免疫行为,都有咽侧体抑制激素参与细胞、组织间的相互调节而使机体达到内环境的稳态[1]。神经肽被认为是早于神经系统进化的第1个细胞间递质,也被认为是无脊椎动物最早的神经递质之一,在所有动物的激素分泌中起着重要调节作用[2]。根据结构特征,咽侧体抑制激素被细分为3个完全不同的肽组:AST-A,最早在太平洋硕蠊(Diplopterapunctata)中发现[3],有共同的末端序列Y/FXFGL-NH2;B型咽侧体抑制激素(AST-B),最早在双斑蟋蟀(Gryllusbimaculatus)中发现,它们都有C末端基序WX6W-NH2[4];C型咽侧体抑制激素(AST-C),首次在烟草天蛾(Manducasexta)中发现,有和A型、B型无关的C末端[5]。结构-活性研究表明,C-末端Y/FXFGL-NH2是AST-A的活性核心区,这些共同的保守C末端序列Tyr/Phe-Xaa-Phe-Gly-Leu-NH2(Xaa=Ala,Asn,Gly,Ser)是抑制JH生物合成的关键氨基酸残基[6]。因为咽侧体抑制激素能强烈抑制咽侧体对保幼激素的生物合成,因此被认为是开发新型昆虫生长调节剂的潜在候选对象[7]。
咽侧体抑制激素除了诸如控制觅食行为,减少进食和促进睡眠,甚至肌肉活性等方面的功能之外,对昆虫的免疫也具有调控功能。早在1993年,就发现了神经分泌样细胞群和神经肽免疫反应细胞的存在[8]。有研究发现,AST-B可以与螃蟹体内的神经内分泌免疫(neuroendocrine immune,NEI)网络受体结合,并触发下游信号通路,诱导肝胰腺的免疫应答[9]。昆虫的促咽侧体素(allatropin)和咽侧体抑制激素等神经肽均对昆虫的免疫系统和心脏收缩率有调节作用[10]。在肠分泌细胞中,dimm基因控制靶细胞AST-A等的水平,可以防止昆虫假单胞菌(Pseudomonasentomophila)感染并调控抗菌肽的表达[11]。
本研究克隆获得家蚕A型咽侧体抑制激素(BmAST-A)基因,利用原核表达系统表达了BmAST-A蛋白,采用体腔注射试验和RNA干涉方法,揭示BmAST-A蛋白在家蚕抵御球孢白僵菌感染过程中的作用,为探明家蚕抵御球孢白僵菌感染的分子机制和研发家蚕白僵病的防控措施提供一定的试验依据。
1 材料与方法
1.1 试验材料
1.1.1 供试蚕品种 本研究使用的家蚕品系为p50,由中国农业科学院蚕业研究所保存提供。在温度25 ℃和相对湿度90%的条件下,以新鲜桑叶饲养至5龄起蚕进行试验。
1.1.2 供试白僵菌 试验用球孢白僵菌HN6菌株,由中国农业科学院蚕业研究所家蚕病理研究室从白僵病蚕分离保存。
1.1.3 主要试剂 酵母提取物、蛋白胨、氯化钠(分析纯)、琼脂粉、PBS缓冲液、Trizol、TaKaRa Ex Taq酶、限制性内切酶、RNA反转录试剂盒、T4 DNA连接酶、荧光定量试剂盒等试剂,均为宝生物TaKaRa(大连)生物有限公司产品;RNApure超纯总RNA提取试剂盒、质粒DNA小量抽提试剂盒、His标签蛋白纯化试剂盒、异丙基-β-D-硫代半乳糖苷(IPTG)、蛋白透析袋(8 kD,宽度50 mm,容积8.0 mL/cm)、盐酸胍、一抗(His-Tag 鼠 mAb)、二抗(羊抗鼠IgG HRP)等试剂,均为生工生物工程(上海)有限公司产品;氨苄青霉素、卡那霉素钠,均为Amresco公司产品;BCA蛋白质浓度检测试剂盒,为上海碧云天生物技术有限公司产品;琼脂糖凝胶回收试剂盒,为爱思进生物技术有限公司产品。
1.1.4 主要仪器设备 PTC-100TC PCR仪,为MJ Research公司产品;台式离心机、台式低温离心机、Biophotometer分光光度计,均为Eppendorf公司产品;7300荧光定量PCR仪,为ABI公司产品。
1.2 试验方法
1.2.1 LB培养基配制 称量5 g酵母提取物、10 g蛋白胨、10 g氯化钠,用800 mL去离子水搅拌溶解后定容至1 L,高温高压灭菌后即为LB液体培养基。在上述LB液体培养基中加入15~20 g琼脂粉,用去离子水搅拌均匀后定容至1 L,灭菌后冷却至适宜温度加入氨苄青霉素或卡那霉素至终浓度50 μg/mL,混匀立即倒平板,即为含有相应抗生素的LB固体平板培养基。
1.2.2 表达载体构建 采用RNApure超纯总RNA快速提取试剂盒提取5龄家蚕头部组织的总RNA,并采用两步法反转录试剂盒反转录合成cDNA。根据家蚕BmAST-A基因核苷酸序列(GenBank登录号:NM_001043571.1),采用Primer premier 6.0软件设计PCR引物(上游引物为5′-CTAGCTAGCATGCTGTCGGCTTGTCTCCCATTG-3′,下游引物为5′-ATAAGAATGCGGCCGCTTAAGCGTCGATGTAGTTCT
CAC-3′,其中下划线部分为BamH I和NotI 酶切位点及其保护碱基),并由生工生物工程(上海)股份有限公司合成。使用Ex Taq酶在20 μL反应体系进行PCR扩增。扩增条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共35次循环后,再72 ℃延伸10 min。PCR产物进行1%琼脂糖凝胶电泳分离,采用琼脂糖凝胶回收试剂盒纯化回收PCR产物,连接至pMD 19-T载体中,转化大肠埃希菌Top10感受态细胞并用含有氨苄青霉素的LB固体平板培养基筛选阳性克隆。测序验证正确的BmAST-A核苷酸序列连接入表达载体pET-28a(+),转化大肠埃希菌Arctic Express(DE3)表达菌株感受态细胞,并用含卡那霉素的LB固体平板培养基筛选阳性克隆。通过BamH I和NotI双酶切及测序对重组表达质粒pET-28a(+)-AST-A进行验证。
1.2.3 BmAST-A蛋白的表达与纯化 将成功构建的表达菌株接种至含有卡那霉素的LB液体培养基中,于180 r/min、37 ℃培养到OD600≈0.6至0.8时加入IPTG至终浓度为0.5 mmol/L,然后进行诱导表达6 h。收集菌体,冰上进行超声破碎3次,每次50个循环(超声强度250 W,超声破碎5 s,间隔5 s),4 ℃、12 000 r/min离心20 min,分别收集上清和沉淀,沉淀用8 mol/L尿素溶解。用质量百分比浓度为12%的预制胶进行SDS-PAGE和western-blot(一抗:His-Tag 鼠 mAb;二抗:羊抗鼠IgG HRP)检测重组蛋白。
使用His标签蛋白纯化试剂盒纯化重组蛋白,收集咪唑洗脱液进行SDS-PAGE和western-blot检测纯化效果。将目的蛋白洗脱液,依次以尿素浓度为6 mol/L、4 mol/L、2 mol/L、1 mol/L和0 mol/L 的PBS(0.01 mol/L,pH 7.4)溶液进行透析,对蛋白进行复性,复性后的目的蛋白离心超滤浓缩后,采用BCA蛋白质浓度检测试剂盒检测重组BmAST-A蛋白的浓度。
1.2.4 重组BmAST-A蛋白家蚕体腔注射试验 将p50品系5龄起蚕浸泡于107孢子/mL的球孢白僵菌孢子悬浮液中接种感染。感染后分为2组,每组10头,设3个重复,试验组在感染6 h后体腔注射0.5 mg/mL 的BmAST-A蛋白5 μL,阴性对照组在感染6 h后注射PBS缓冲液(0.01 mol/L,pH 7.4)5 μL,另设空白对照组不做任何处理。3组家蚕幼虫在正常条件下饲养,每隔2 h观察记录发病及死亡情况,至所有幼虫全部死亡。所得数据用IBM SPSS Statistic 25.0软件进行回归分析,计算存活率和半数致死时间(LT50)。
1.2.5BmAST-A基因表达的RNA干涉 由苏州吉玛基因股份有限公司合成BmAST-A基因的干涉RNA(siRNA,正义链5′-GGUCUCGCCCGUACUUGUUTT-3′,反义链5′-AACAAGUACGGGCGAGACC
TT-3′)和阴性对照(NC,正义链5′-UUCUCCGAACGUGUCACGUTT-3′,反义链5′-ACGUGACACGUUCGGAGAATT-3′)。将5龄起蚕浸泡于球孢白僵菌分生孢子悬浮液中接种感染,分为2组,每组30头,设3个重复。感染6 h后,试验组体腔注射浓度为90 ng/μL 的siRNA 5 μL,阴性对照组体腔注射相同浓度的NC 5 μL,另设空白对照组不进行任何处理。3组家蚕幼虫在正常条件下饲养,每隔2 h观察记录发病及死亡情况,至所有幼虫全部死亡。同时,qRT-PCR 检测BmAST-A基因的转录水平。发病及死亡头数的数据进行统计学分析,计算存活率和半数致死时间。
1.2.6 qRT-PCR 解剖收集家蚕的脂肪组织,提取总RNA并反转录为cDNA,采用荧光定量试剂盒按照操作步骤在ABI 7300实时荧光定量PCR仪上进行扩增检测BmAST-A基因的表达,以BmGAPDH基因作为内参基因,所有样品进行3个重复。使用2-△△Ct方法[12]计算相对表达水平。
2 结果与分析
2.1 BmAST-A基因的克隆及表达载体构建
BmAST-A基因(GenBank登录号:NM_001043571.1)开放阅读框为615 bp,编码204个氨基酸的蛋白质,信号肽预测(http://www.cbs.dtu.dk/services/SignalP/)结果显示该蛋白的第1~17氨基酸为信号肽。因此,以家蚕5龄幼虫头部组织cDNA为模板,通过PCR扩增去除信号肽并加上起始密码子 ATG的567 bp序列,经琼脂糖凝胶电泳分析表明,反应产物显示条带位于600 bp附近(图1),与预测结果相符。
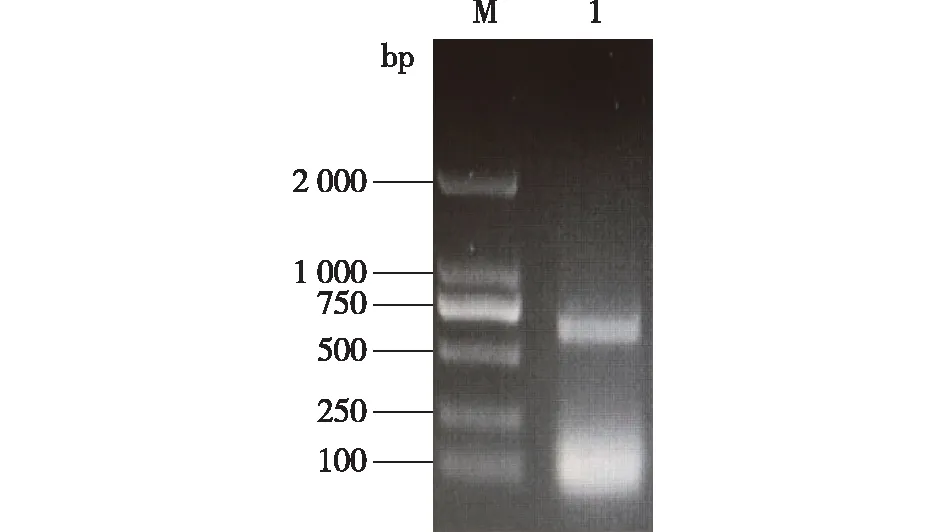
M—DNA Marker,1—BmAST-A 基因编码序列PCR产物。图1 BmAST-A ORF的PCR扩增
回收PCR扩增产物,连接到pMD19-T载体,经测序表明扩增获得的BmAST-A基因核苷酸序列正确。然后通过BamH I和NotI酶切位点将扩增片段连接到表达载体pET-28a(+)质粒上,构建表达载体pET-28a(+)-BmAST-A,酶切后琼脂糖凝胶电泳结果显示5 369 bp的pET-28a质粒条带和567 bp 的目的基因条带(图2),同时,测序结果与原序列一致,说明原核表达载体pET-28a(+)-BmAST-A构建成功。
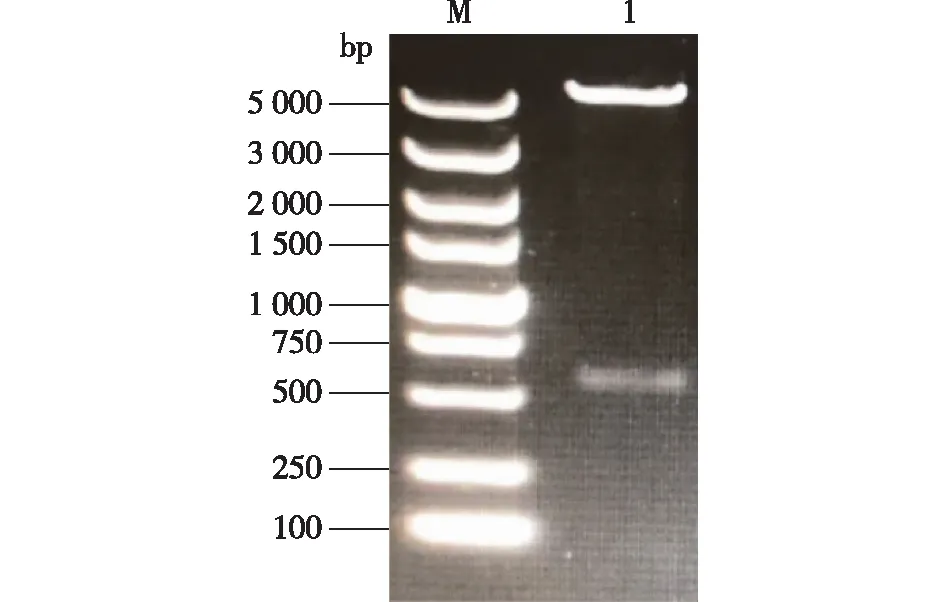
M—DNA Marker,1—pET-28a(+)-BmAST-A。图2 pET-28a(+)-BmAST-A双酶切鉴定
2.2 重组蛋白的原核表达与纯化
将成功构建的pET-28a(+)-BmAST-A重组质粒转化至大肠埃希菌DE3表达菌株中,在终浓度为0.5 mmol/L的IPTG诱导下表达BmAST-A蛋白,经SDS-PAGE和western blot检测显示,出现约25 kD的蛋白条带(图3),与预测结果22 kD大致相符。同时,表达产物主要以包涵体的形式存于培养物沉淀中。而转化pET-28a(+)质粒的空白对照组无相应蛋白条带出现。试验结果表明BmAST-A蛋白得到成功表达。
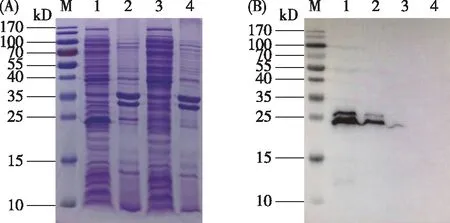
A.表达产物SDS-PAGE鉴定,B.表达产物western blot鉴定。M:蛋白质分子量,1:pET-28a(+)-BmAST-A转化菌裂解后的沉淀,2:pET-28a(+)-BmAST-A转化菌裂解后的上清,3:pET-28a(+)空白质粒转化菌裂解后的沉淀,4:pET-28a(+)空白质粒转化菌裂解后的上清。图3 BmAST-A的表达鉴定
从BmAST-A的纯化鉴定电冰图(图4)可以看出,表达产物经过镍柱纯化和梯度复性后,得到的蛋白条带和预测蛋白大小符合,表明通过原核表达系统成功表达出重组目的蛋白。以BCA蛋白浓度试剂盒制作的标准曲线,测定表达产物蛋白浓度为0.5 mg/mL。
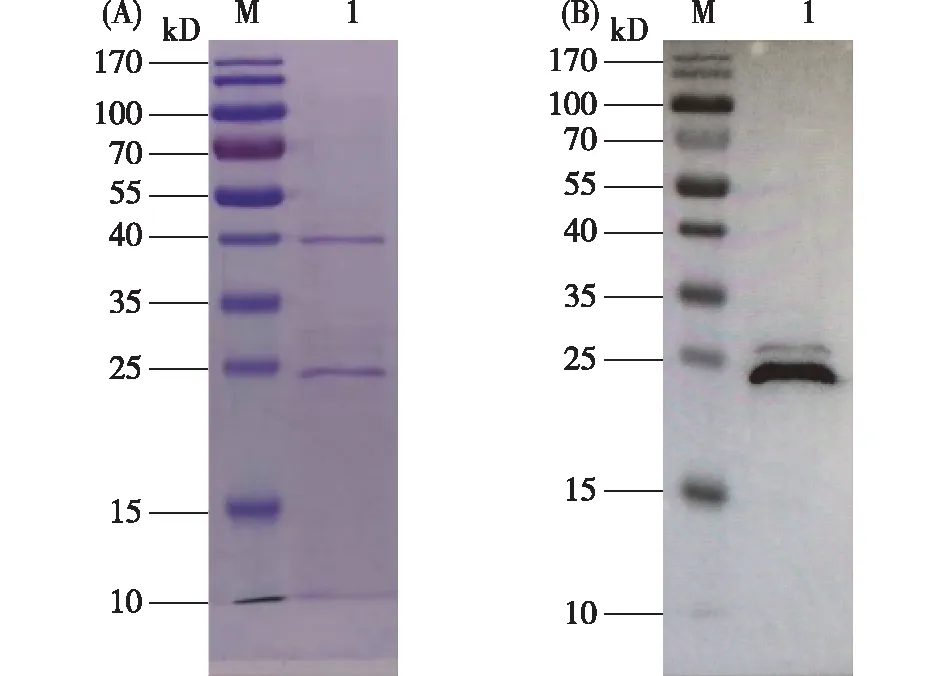
A.纯化蛋白SDS-PAGE鉴定,B.纯化蛋白western blot鉴定。 M:蛋白质分子量,1:纯化后的重组BmAST-A蛋白。图4 BmAST-A的纯化鉴定
2.3 BmAST-A蛋白对球孢白僵菌感染的抑制作用

Kaplan-Meier曲线表明注射重组蛋白BmAST-A的 试验组和阴性对照组家蚕幼虫的存活率。图5 重组BmAST-A蛋白对家蚕白僵病发病的抑制作用
经多次体外抑菌圈试验,均未能检测到BmAST-A蛋白对球孢白僵菌分生孢子发芽与生长的抑制作用。但我们前期的转录组研究结果表明,在球孢白僵菌感染的家蚕幼虫BmAST-A基因的表达被明显上调,表明BmAST-A基因编码的蛋白质可能参与家蚕对球孢白僵菌感染的抵御作用。为了解析BmAST-A蛋白在家蚕抵御球孢白僵菌感染过程中的作用,对接种感染球孢白僵菌的5龄家蚕进行了BmAST-A蛋白的体腔注射试验。感染前期家蚕正常食桑与生长,无明显症状,感染72 h后家蚕体壁上出现白僵病的典型油斑状症状,并且出现吐液等症状;取浑浊的血淋巴镜检能观察到球孢白僵菌短菌丝,死亡后的家蚕尸体出现僵硬并在2~3 d后体壁上长出白色菌丝,逐渐被白色菌丝和分生孢子覆盖形成白僵蚕,而空白对照组的家蚕正常生长直至结茧。但从图5可以看出,与阴性对照组相比,注射BmAST-A蛋白的试验组家蚕首见死亡的时间推迟了24.0 h,半数致死时间推迟了32.9 h。表明BmAST-A蛋白可能通过调控家蚕的免疫功能抑制家蚕白僵病的发病进程。
2.4 BmAST-A基因的RNA干扰
为了进一步验证BmAST-A蛋白对家蚕白僵病发病进程的抑制作用,对接种感染了球孢白僵菌的家蚕5龄幼虫采用RNA干扰方法沉默BmAST-A基因的表达。qRT-PCR检测结果表明,注射BmAST-A基因的siRNA后,家蚕BmAST-A基因的转录水平在24 h和48 h显著降低,在12 h和36 h的转录水平也有降低,但未达到显著水平(图6),表明BmAST-A基因的表达受到抑制。同时,注射了BmAST-A基因的siRNA的试验组家蚕幼虫的首见死亡时间比对照组提早了7.0 h,半数致死时间提早了16.8 h,全部死亡时间提早了15.0 h(图7),进一步证明BmAST-A蛋白可能通过调控家蚕的免疫能力延缓球孢白僵菌对家蚕的致病进程。

*表示差异显著,**表示差异极显著。图6 感染球孢白僵菌的家蚕注射siRNA后BmAST-A基因的表达变化

Kaplan-Meier曲线表明注射靶向BmAST-A基因的 siRNA试验组和阴性对照组家蚕幼虫的存活率。图7 siRNA干涉BmAST-A基因表达对家蚕白僵病发病的影响
3 小结与讨论
球孢白僵菌是研究和应用最多的病原真菌之一,能够引起家蚕等经济昆虫白僵病的发生,常给蚕桑产业等经济昆虫产业造成重大的经济损失。但球孢白僵菌因其寄主范围广泛、致病性和适应性较强以及制备和应用操作简便等优点,被认为是最好的生物防治菌种,广泛应用于农林害虫的生物防治。因此,研究家蚕抵御球孢白僵菌感染的免疫应答机制对于研发家蚕白僵病的有效防控措施和提高球孢白僵菌对农林害虫的防治效果具有重要意义。包括A型咽侧体抑制激素在内的咽侧体抑制激素神经肽家族在果蝇的觅食、进食、新陈代谢和睡眠等行为中发挥着神经调节剂和激素的作用[13]。肽类激素在昆虫繁殖、飞行、滞育、感染以及免疫等过程中也参与脂质代谢。直接或间接参与昆虫脂质代谢的主要肽类激素是AST-A[7,14]。黑腹果蝇被细菌感染后,伤害性神经元释放的AST-C作为免疫抑制肽发挥作用,减弱免疫反应,从而防止细胞过早死亡[15]。有研究认为,AST-C是一种由伤害感受器或果蝇血细胞释放的免疫抑制物质,抑制免疫缺陷(immune deficicncy,IMD)信号通路,以防止免疫病理或减少微生物刺激后不必要的代谢成本[15]。而在对AST-A进行生物信息学分析发现,AST-A与AST-C具有相同的受体结合区域[16]。我们的前期研究发现,家蚕感染球孢白僵菌后,AST-A基因的表达水平明显上调,咽侧体抑制激素前激素原基因的表达水平相应下调(未发表数据),暗示AST-A在家蚕应对球孢白僵菌侵染的过程中可能发挥重要的生理生化作用和抗真菌免疫调控作用。
本研究在原核系统中成功表达了家蚕BmAST-A蛋白,家蚕体内试验表明,表达的重组BmAST-A蛋白对家蚕白僵病的发生具有一定的抑制作用。将重组BmAST-A蛋白注射到染病家蚕体腔中,家蚕的发病时间较阴性对照组(注射等量的PBS缓冲液)缓慢,半数致死时间延迟了32.9 h。而在抑菌圈试验中,并未见重组BmAST-A蛋白对球孢白僵菌的抑菌效果。表明这类神经肽在家蚕体内可能参与了某个信号转导通路或免疫调控通路而发挥作用。在前人的研究中发现,咽侧体抑制激素受体(ASTR)与几种动物受体相关,并通过Gi/o G蛋白连接以抑制环腺苷(cAMP)并激活G-蛋白偶联内向整流钾通道(inward-rectifier potassium channel,GIRK)[17]。AST-A还通过其在脂肪酸释放激素(adipokinetic hormones,AKH)和胰岛素样肽(insulin-like peptides,ILP)产生细胞中表达的甘丙肽样受体“DAR2”(果蝇Allatostatin受体2)调节脂肪酸释放激素和胰岛素样肽进而干扰昆虫免疫[18],例如脂肪酸释放激素在病原感染后升高,而脂肪酸释放激素的升高可以诱导免疫反应[19]。虽然神经肽在免疫反应中的作用仍然是一个相对未知的领域,但有研究表明,神经肽参与了这些过程。例如,蟑螂的AST-A是由血细胞产生,表明AST-A在免疫反应中起作用[20]。在我们的RNA干扰试验中,将靶向BmAST-A的siRNA注射到感染球孢白僵菌的家蚕体腔内,抑制了BmAST-A的表达,家蚕的发病时间相较于阴性对照组(注射相同浓度的NC)提早,半数致死时间提前了16.8 h。在BACHTEL等[15]的实验中也通过敲除C型咽侧体抑制激素受体2(AstC-R2)的方法,检测AstC-R2缺陷突变体中的免疫信号,证明了AstC-R2特异性地抑制免疫缺陷途径。
总之,我们的研究结果表明,BmAST-A蛋白对家蚕白僵病的发生具有一定的抑制作用,延缓了家蚕白僵病的发病过程。推测其机理可能是通过调控家蚕的相关免疫通路和免疫效应因子的表达等来实现的,具体机理有待将来进一步深入研究。

