精子DNA碎片率与男性不育及其配偶早期复发性流产的关系
罗英 徐楗荧 林小民 金泷 曲仕浩
珠海市妇幼保健院1生殖医学中心,2男性生殖健康科(广东珠海519000)
目前,由于受到生活方式、饮食习惯,环境及压力等因素影响,尤其空气污染与男性DNA 损伤、精子形态异常及精子性能下降有关,导致男性不育的发病率呈上升趋势,且已经成为临床上亟待解决的问题[1-2]。但是,男性的生育指标检测方法贫乏,临床主要通过检测精液参数来反映精子质量,精子DCXR 蛋白表达和精子凋亡率作为男性不育症诊断的实验室依据[3]。在临床上15%左右的男性不育患者其精液参数检查结果正常[4]。因此,通过精液参数检查评估男性的生育能力存在一定不足之处。随着生殖医学研究的深入,学者们发现精子染色体结构的完整性与男性不明原因不育及其配偶早期复发性流产存在密切关联。精子DNA 碎片率(DNA fragmentation index,DFI)作为临床上反映精子遗传物质完整性的重要指标,影响男性的生育功能[5]。因此,本研究拟探讨DFI与男性不育及其配偶早期复发性流产的关系。
1 对象与方法
1.1 研究对象及分组 选取2018年12月至2020年12月在本中心进行DFI 检测的330 名男性,男方年龄≤45 岁,精子浓度>15 × 106/mL;女方年龄≤40 岁。依据其配偶既往生育情况分为不育组(A组n=96)、配偶早期复发性流产组(B 组n=86)及正常生育组(C 组n= 148)。纳入标准:(1)B 组:配偶有2 次或2 次以上孕早期自然流产史,且病因不明确;(2)夫妇双方在生殖系统上无异常;(3)女性在内分泌、妇科等检查中均无异常;(4)男方6 个月内未服用影响检测结果的药物。排除标准:(1)存在生殖系统缺陷或发育不良;(2)化疗或放疗;(3)合并有心、肝、肾等严重原发性疾病;(4)重度少、弱、畸形精子症。
1.2 精子DFI检测方法 受试者采取手淫的方法采取标本,禁欲时间:2 ~7 d。精液常规:采用SAS-Ⅱ型精子质量分析系统(赛司医疗科技北京有限公司)对精子浓度、精子的活力力及前向运动精子等参数进行分析。精子形态采用Diff-Quik 染色,每位患者制备两张形态染色片,1 000×油镜下观察两张形态染色片,以最接近的整数报告平均正常形态精子百分率。精液检测采用WHO 精液检测第5 版的标准。精子DNA 完整性:本次检测采用的是精子染色质扩散实验(Sperm Nucleus DNA Inetegrity Kit,SCD),深圳华康生物医学工程有限公司提供试剂盒,具体操作参考说明书。
1.3 观察结果及判断 染色质断裂较多的精子,染色后仅能观察到深染的精子头部,或仅存在较少的核晕;而精子染色体结构,保持相对完整的精子可以清晰看到染色较深的精子头部,还具有明显的核晕环。依据光晕与精子头部核心直径的比例,分析判断精子DNA 损伤程度,若光晕直径≥精子头部核心的1/3 为正常精子,否则为异常精子。
1.4 统计学方法 数据应用SPSS 22.0 软件进行统计学分析,计量资料以均数±标准差表示,组间比较用t检验;计数资料以例(%)表示,组间比较用χ2检验。检验标准取双侧α = 0.05,P<0.05 为差异有统计学意义。
2 结果
2.1 各组精液常规比较 三组年龄比较,差异均无统计学意义(P>0.05);A 组和B 组患者精子浓度、精子活力及前向运动精子(PR)均低于C 组(P<0.01),畸形率高于C组(P<0.01,表1)。
表1 各组精液常规比较Tab.1 The comparison of sperm parametersin each group ±s
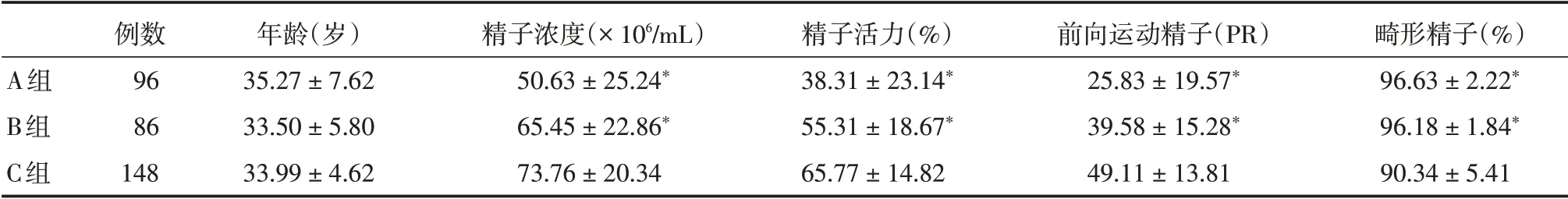
表1 各组精液常规比较Tab.1 The comparison of sperm parametersin each group ±s
注:与C 组比较,*P <0.01
A组B组C组例数96 86 148年龄(岁)35.27±7.62 33.50±5.80 33.99±4.62精子浓度(×106/mL)50.63±25.24*65.45±22.86*73.76±20.34精子活力(%)38.31±23.14*55.31±18.67*65.77±14.82前向运动精子(PR)25.83±19.57*39.58±15.28*49.11±13.81畸形精子(%)96.63±2.22*96.18±1.84*90.34±5.41
2.2 各组DFI 情况比较 A 组、B 组和C 组DFI ≥30%分别为52.1%、46.5%和6.8%;A 和B 组与C 组比较,DFI 显著升高,差异有统计学意义(P<0.01,表2)。

表2 各组DFI 情况比较Tab.2 The comparison of DFI in each group 例(%)
3 讨论
早期复发性流产是在女性孕12 周之前发生的两次或两次以上的自然流产,引起复发性流产的原因有很多,比如女性体内激素水平因素、生殖道因素、染色体异常及母胎免疫平衡失控等[6-7]。目前在临床中,主要是对女性的生殖指标进行筛查,而由于男性引起的早期复发性流产的检测指标贫乏,且现有的对于男性检测的指标对临床治疗指导意义有限。ROBINSON 等[8]研究表明,精子与卵子在形成受精卵的过程中,精子核内具有遗传编码的染色体将进入其中,将遗传信息传递给子代以确保胚胎的正常发育,精子DNA 在胚胎发育的过程中具有重要的作用;当精子DNA 受到损伤时,将会导致精子染色体结构异常;一定程度上卵子对受损伤的精子DNA 具有修复能力,如果损伤程度超过8%,那么卵子的修复能力不能降低胚胎的流产率;当DFI >30%早期自然流产率显著增加,而且在人类辅助生殖技术中较高的DFI 损伤也会使临床妊娠率下降及增加自然流产率。
目前,关于精子DNA 碎片化的发生机制仍不明确,精子的异常凋亡、体内氧化应激、精子发生过程中染色质的异常组装等的出现可能是其产生的原因。在精子DNA 损伤程度方面,许多研究发现,增加的DIF 会对受孕率产生不利影响,精子中的DNA 损伤会影响后代的健康和幸福[9-12]。精子浓度、活力、PR 级精子,精子存活率和正常形态精子是反映男性不育的常用指标,DFI 是对精子常规分析的补充项目。研究显示[13-16],DFI 导致精子染色体完整性降低,这可能导致复发性流产的发生;一项对16 个研究对象(包含2 969 对夫妻)的Meta分析显示,男性配偶DFI 水平高的妇女复发性流产率显著高于其配偶精子DFI 数值较低者。而且,精子畸形率升高和精子DFI 升高也会导致男性不育,升高的DFI 将通过影响受精卵原核的形成导致胚胎质量下降。本研究显示,不育组和配偶早期复发性流产组与正常生育组年龄比较差异无统计学意义(P>0.05);不育组和配偶早期复发性流产组患者精子浓度、前向运动精子及精子活力均低于正常生育组(P<0.01),畸形率高于正常生育组(P<0.01)。不育组、配偶早期复发性流产组和正常生育组DFI ≥30%分别为52.1%、46.5%和6.8%;不育组和配偶早期复发性流产组与正常生育组比较,DFI 显著升高(P<0.01)。杨弘毅等[17]研究表明精子浓度、活力、PR 级精子和正常形态精子与精子DFI 呈负相关,研究结果与本研究结果相同。针对精子参数与精子DNA 完整性的相关性,对此许多学者进行了深入的研究,影响精子参数,精子DFI 增高的因素多种多样,冯播等[18]研究表明支原体感染可使男性精子质量下降、精子DNA 碎片率增高。本研究由于病例数量仅为330例,对此研究数据有待更多的研究证实。同时本研究观测DFI 方法为SCD 法,SCD 方法虽然简洁、快速、在普通光学显微镜下即可判断结果,不需添置昂贵的实验设备,但只能判断精子DNA 完整性是否受损,没有定量或定位指标用于评估精子受损的程度。
综上所述,精子DFI 与男性不育及其配偶早期复发性流产有关,但精子DFI 增高原因多种多样,机制复杂,精子DFI 增高不利于正常受精、胚胎发育,因此,DFI 检测可以用于男性不育的评估。精子DFI 增高可由睾丸内发生的成熟缺陷和凋亡引起,也可由男性生殖道内的OS 引起。它也可以由外部因素引起[19-21],包括临床疾病状态(精索静脉曲张、癌症、糖尿病)、生活方式风险因素(吸烟、酗酒、肥胖)和环境暴露(空气污染、杀虫剂、工业化学品)。DFI 的检测方法多种多样;虽然一个特定的临界值还没有被一致确认,但目前研究表明20%的阈值被认为在有生育能力和不育的男性之间具有很好的区分准确性。本研究提出了DFI 检测方式及检测结果,不仅在临床工作中是最简便及可行的检测方法,而且在辅助生殖过程中可用来评估种植的成功率,具有一定的临床意义。多项研究表明对于包括不明原因和特发性不孕、RPL、精索静脉曲张、以及有生活方式/环境风险因素的DFI 增高的患者进行多种治疗干预措施,如抗氧化疗法、改变生活方式、精索静脉曲张切除术、以及使用先进的精子选择技术或睾丸精子进行ICSI,减低患者DFI 用以提高其受孕的可能性,这可能也为解决不孕不育原因提供多种研究的方向。

