钠滴着火特性和预燃模型综述
石文涛,杜海鸥,申凤阳,王荣东,王国芝,刘淑慧
钠滴着火特性和预燃模型综述
石文涛1,杜海鸥1,申凤阳1,王荣东1,王国芝1,刘淑慧2
(1. 中国原子能科学研究院,北京 102413;2. 广州中国科学院工业技术研究院,广东 广州 511458)
与碳氢化合物燃料液滴着火特性不同,液态钠滴在常温空气中会自发着火,钠滴着火延迟时间及着火极限受着火前的预燃阶段控制。预燃阶段钠滴主要发生表面氧化反应,该阶段的特性及表面氧化的速率模型是钠滴燃烧研究的一个重点。目前国内用于快堆雾状钠火安全分析程序的预燃模型是通过氧气向钠滴表面传输来控制表面氧化反应速率,着火延迟时间由钠滴温度升高到沸点(1 156 K)进行计算。基于温度的化学动力学控制模型以及传质与化学动力学组合控制模型被开发出来用于描述钠滴的预燃阶段,通过不同模型对不同初始条件钠滴着火特性的数值计算和分析对比,这两种模型可以预测不同条件下的钠滴着火极限,计算结果更加符合钠滴实际着火特性。
钠滴;预燃模型;着火延迟时间;着火极限
液态金属钠具有优良的热工水力学性质,低密度,高热导率和高沸点,和堆芯材料有很好的相容性,中子吸收截面小。因此,几乎所有已建、在建或将建的液态金属快中子增殖反应堆(LMFBR)都采用钠作为冷却剂。中国实验快堆(CEFR)和中国示范快堆(CFR600)均采用液态钠作为冷却剂,正常运行工况下,钠在封闭的设备及管路中运行,温度范围250 ℃至550 ℃,压力可达1.0 MPa。
钠是化学元素周期表中最活泼的金属元素之一,化学性质十分活泼,在空气中燃烧主要生成氧化钠(Na2O)和过氧化钠(Na2O2)。当钠工艺间中的钠设备、管道和阀门等由于制造缺陷、操作失误、疲劳等原因产生破口后,高温钠会在系统内压力作用下发生喷射泄漏,部分喷射钠会直接在破口处形成钠滴群或撞击障碍物后分散形成钠滴群,离散的液态钠滴会与空气中的氧气等发生化学反应,形成喷雾钠火。钠雾火涉及多种复杂输运过程,但本质上其特性受形成喷雾的单个液滴的点火和燃烧行为影响。
由于钠的低熔点(97.8 ℃),高沸点(882.9 ℃)及其化学活泼性,与碳氢化合物燃料液滴着火特性不同,液态钠滴出现在常温空气中后,经过一定时间的预燃阶段,通常能够自发着火发生气相燃烧。相对于钠滴燃烧的整个寿命来说,气相燃烧是钠滴燃烧的主要阶段,但预燃阶段表面氧化决定了钠滴的着火过程,普遍关心的钠滴着火延迟时间及着火极限即决定于预燃阶段。钠滴的预燃阶段不遵循Spalding[1]的液滴气相燃烧模型,该阶段的特性及物理模型是钠滴燃烧研究的一个重点。
本文介绍了钠滴燃烧预燃阶段特性及国内外钠滴预燃模型研究与应用进展,为我国后续钠火程序开发中钠滴燃烧预燃阶段采用更加合理准确的物理模型提供参考。
1 预燃特性
1.1 主要现象
Richard[2]等人(1968年,美国)对空气中的静态钠滴燃烧过程进行了观测,测量了温度为150~350 ℃,直径为1 mm、2 mm和3 mm的静态钠滴的燃烧速率,考察了钠滴的大小、氧摩尔分数和温度对燃烧速率的影响。试验中拍摄了直径1 500 μm、温度250 ℃和氧气浓度0.3下的钠滴的形成、氧化和燃烧过程,如图1所示。钠滴生成后,首先表面生成了粗糙的氧化物,着火前再次变得光滑,接着随机出现一个或多个着火的点并蔓延到整个表面,最终进入稳定燃烧状态。过氧化钠约510 ℃熔化,氧化钠约1 132 ℃熔化,研究人员认为粗糙表面是氧化物的产生,重新变得光滑是氧化物的熔解。由于钠优良的导热性能,氧化产生的热量传递给钠滴比进入气态更容易,从而不断提高钠滴的温度。从这一过程来看,可认为是钠滴表面温度上升使氧化物熔化,钠滴表面的一个或多个点处的内压使表皮破裂,新鲜钠喷发出来燃烧加速了钠滴的自加热和着火。

图1 钠滴(初始温度250 ℃,氧浓度0.3)形成、氧化和燃烧序列图像
Morewitz[3]等人(1976年、1977年,美国)进行了下落钠滴在大气中的着火和燃烧行为实验研究,初始温度550 ℃,初始直径4.62 mm、6.09 mm、7.20 mm的钠滴从滴嘴位置坠落到着火的火焰变化过程,如图2所示。钠滴直径越大,下落点到着火位置的距离越长。
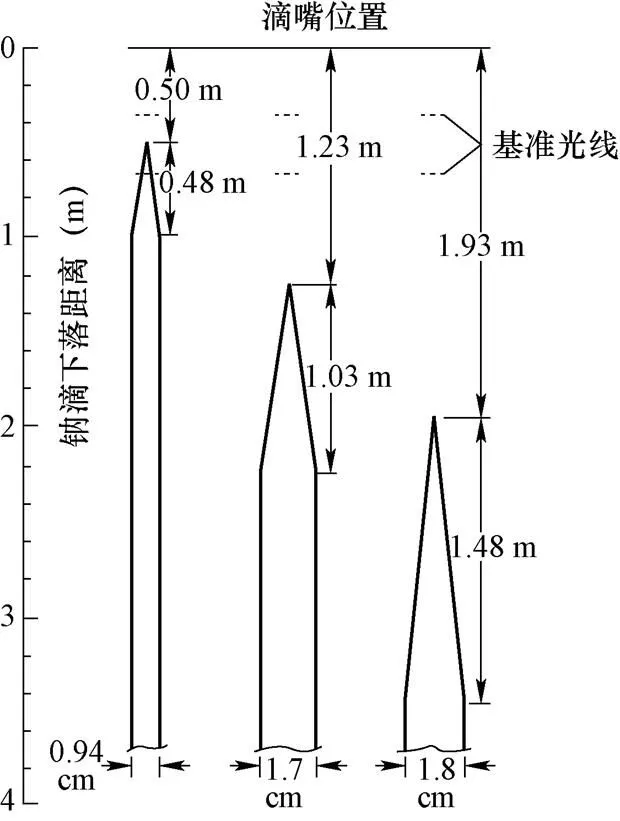
图2 下落钠滴火焰发展过程
杜海鸥等人(2019年,中国原子能科学研究院)进行了316 ℃液态钠的喷射泄漏试验,试验初期视频截图如图3所示,可观察到钠喷射流随喷射距离增加,着火的钠滴数量增加。

图3 钠喷射泄漏火灾试验
1.2 着火极限
通常认为钠滴氧化反应产生的反应热超过钠滴散热使钠滴温度持续加速上升时,着火才会发生。钠滴是否能够着火取决于表面积与体积的比、表面状况、环境温度、湿度、氧化剂的成分、气体吹扫钠滴表面的速度和环境压力等。
Richard静态钠滴试验中,在1 atm、1 cm/s空气流速下,采用99.99%纯度的钠在(200±3)℃的加热炉中生成的1~3 mm的钠滴可自发着火,钠滴着火时实际的表面温度难以得到。在低于200 ℃的加热炉中生成后,以5 ℃/min的温升速度提高加热炉温度,钠滴在加热炉280 ℃左右着火。这一温度280 ℃认为是氧化层不再起保护作用的温度。另外,还特别发现不同氧气浓度下这一温度变化并不明显。
1.3 着火延迟时间
Richard静态钠滴试验中,250 ℃、300 ℃和350 ℃的钠在氧气浓度0.1~0.5时,着火延迟时间大部分随氧气含量的升高而减小,但发现氧浓度0.1时着火延迟时间0.8 s,而250 ℃氧浓度0.2时着火延迟时间40 s,这可能是由于低氧浓度时钠滴表面建立一定厚度氧化保护层的速度较慢,氧化层无法起到保护作用。
Kenji[4]等人(1998年,日本)进行了空气中初始温度为300 ℃和350 ℃、不同初始直径的静态钠滴燃烧试验,研究了初始温度和钠滴直径等对钠滴着火延迟时间的影响,钠滴着火过程各阶段与时间的关系如图4所示。350 ℃时,钠滴直径越小,着火延迟时间越容易缩短;在接近钠滴着火极限温度300 ℃,发现小尺寸钠滴着火延迟时间越长的倾向。
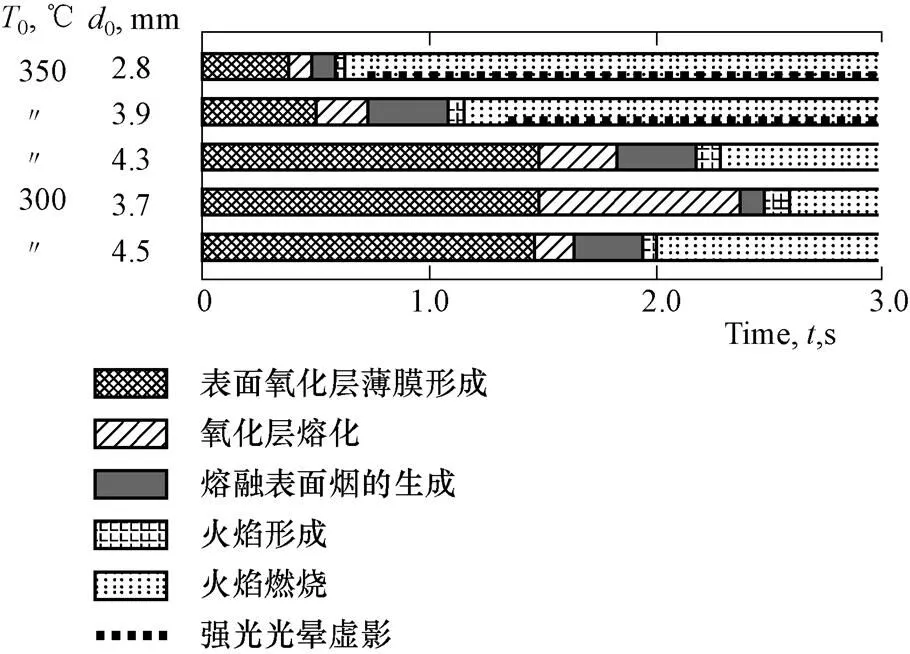
图4 着火过程各阶段与时间的关系
张智刚[5]等人(2014年,哈尔滨工程大学)进行的静态钠滴燃烧试验,研究了钠滴初始温度、环境氧气浓度和环境温度对钠滴燃烧过程的影响,并测量了钠滴燃烧过程中钠滴温度及钠滴附近空间温度的变化。在180~220 ℃的燃烧室中,钠滴初始温度200 ℃,直径约3~5 mm,氧含量21%钠滴可自发着火,氧含量8%需人为扰动钠滴表面才可燃烧。环境温度越高钠滴着火延迟时间越短、钠滴能达到的最高温度越高,初始温度和氧气含量均影响钠滴所能达到的最高温度。初始温度250 ℃、氧含量21%,燃烧室不同温度(204 ℃、77 ℃)条件下的钠滴温度变化曲线如图5所示。
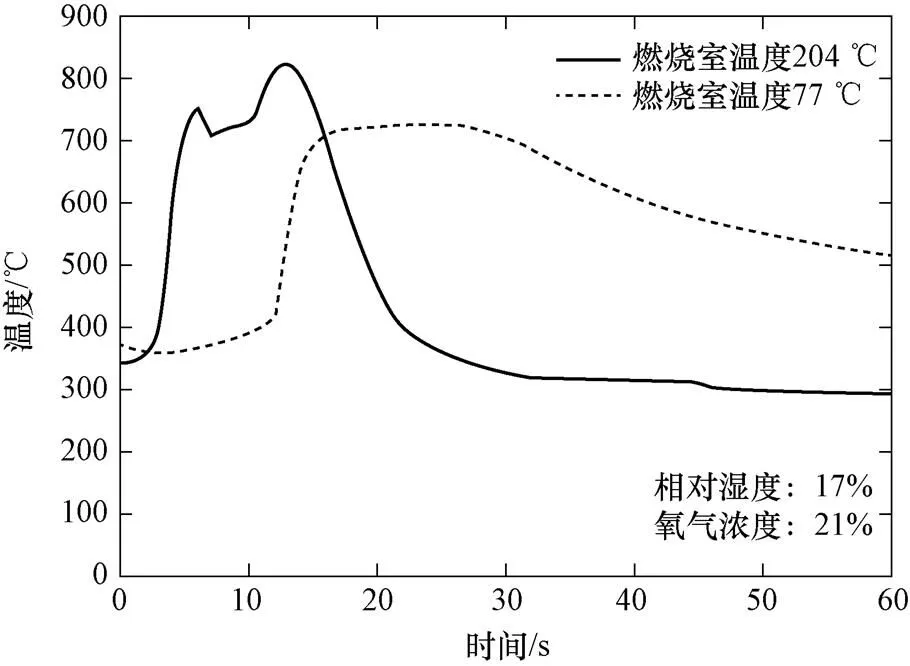
图5 钠滴燃烧过程温度变化曲线
2 预燃阶段燃烧速率模型
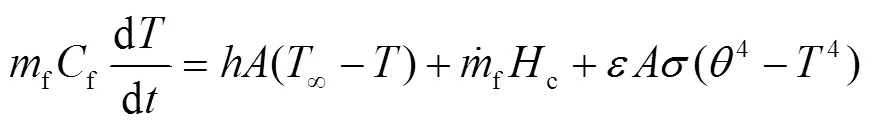
随着对钠滴预燃阶段试验及理论模型的研究,先后发展了氧气质量传输控制的燃烧速率模型、基于钠滴温度的化学动力学模型和两者组合控制模型。
2.1 传质控制模型
美国早期的喷雾钠火计算程序SPRAY[6]、SOMIX[7, 8]均假设钠喷雾出现后立即着火发生气相燃烧,忽略了钠滴燃烧的预燃阶段。后来,Tsai[9](1977年,美国)研究建立了描述空气中钠滴着火行为的预燃模型,该模型用于了NACOM[10]程序的开发。该预燃模型假设在钠滴着火之前的表面氧化反应由扩散到钠滴表面的氧气传输控制,将Ranz-Marshall关联式用于计算氧气向钠滴表面的传输计算,钠滴温度达到沸点1 156 K后开始气相燃烧。
Ranz和Marshall[11]提出的针对球形的强制对流热传输关系式,即Ranz-Marshall关系式:
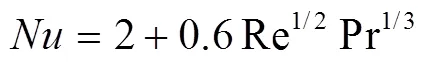
根据热质传递的相似性,质量传输满足:
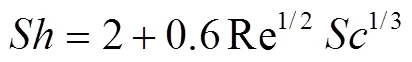
于是,氧化剂质量流量表达式为:
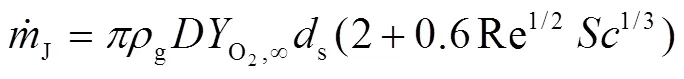
预燃阶段钠滴的燃烧速率可由氧气流量和化学计量率表示为:
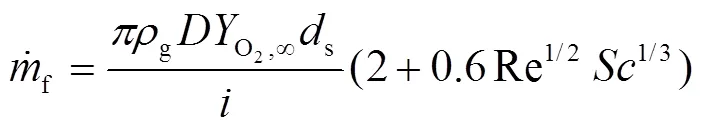
2.2 化学动力学模型
Makino[12, 13](2003年,日本)开发了一个基于温度的反应动力学模型来预测钠滴的点火行为,该模型预燃阶段钠滴质量燃烧速率为:
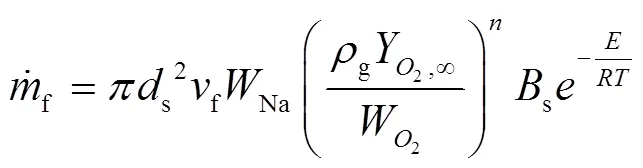
Bs和E为整个钠滴表面反应的频率因子和活化能,Makino通过拟合试验中的着火延迟时间和着火极限得到s=320 m/s,/=6 350 K。
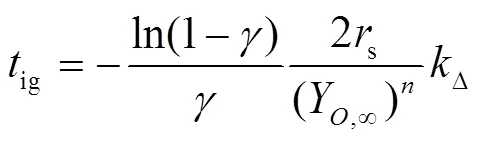
其中:
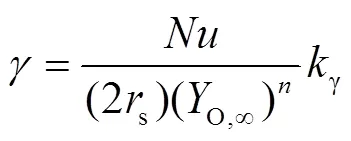
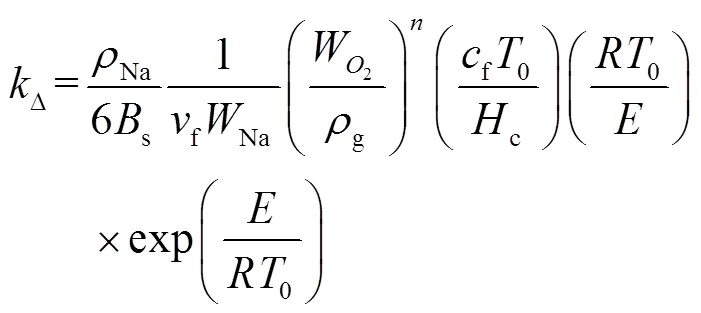
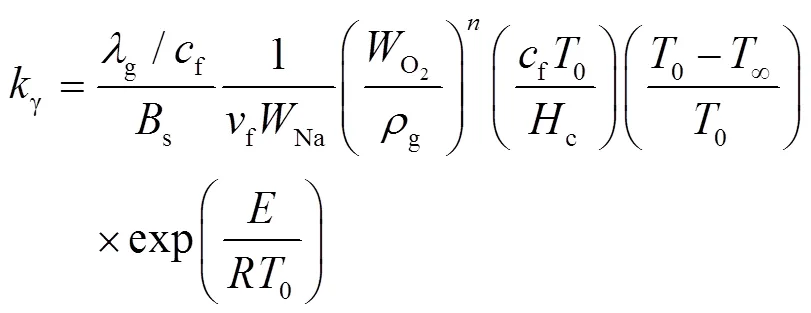
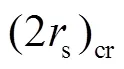
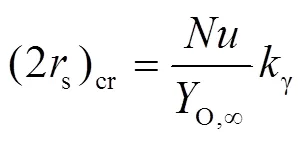
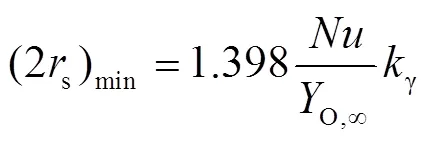
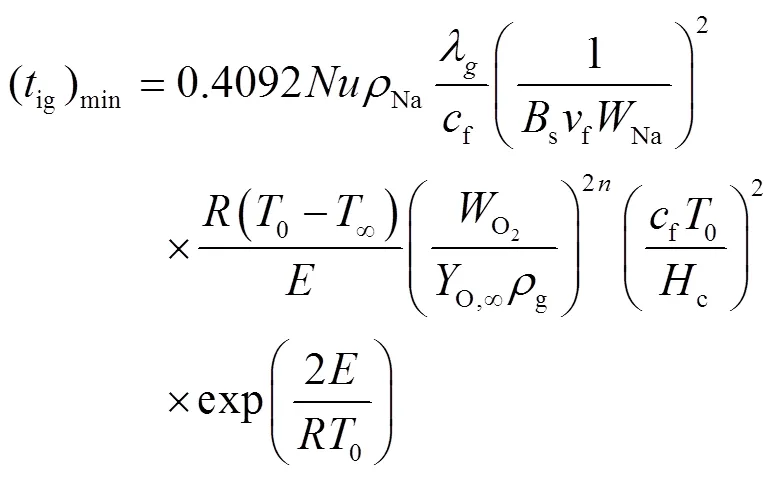
2.3 传质与化学动力学组合控制模型
Sathiah等人[14](2014年,荷兰)认为基于化学反应动力学和基于质量传递方法的预燃模型对于描述不同条件下的着火极限都是必不可少的,他们按照电路原理开发了一个传质和化学动力学组合控制的模型,模型可以预测低氧浓度、钠滴不同初始条件和对流条件下的可燃性极限,使用钠滴温度达到沸点开始气相燃烧来计算着火延迟时间。该模型钠滴预燃阶段质量燃烧速率为
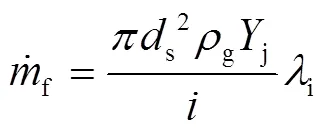
其中:


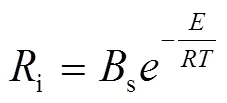
定义达姆科勒数Da为反应动力学速率和质量传递速率的比值:
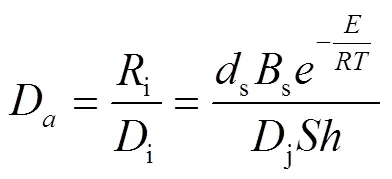
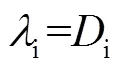
3 化学动力学模型与试验对比
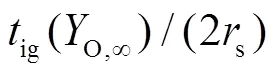
图6为钠滴着火延迟时间随初始温度变化曲线,数据点为直径1.6 mm钠滴,相对速度0.7~4.1 m/s在不同氧气浓度、初始温度下的试验数据,实线为Nu=8的理论曲线。可以看到随钠滴初始温度降低,着火延迟时间先缓慢增加后迅速增加。
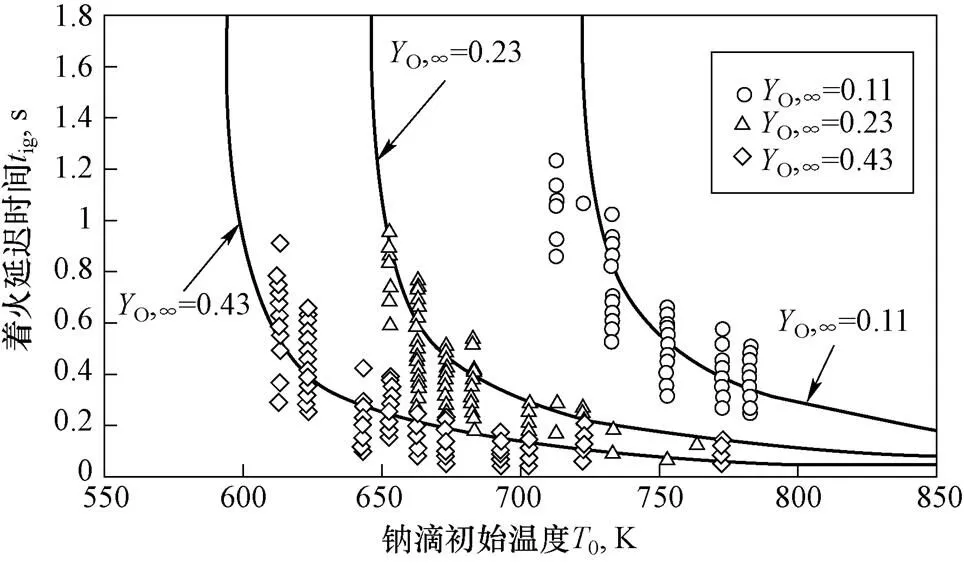
图6 着火延迟时间随钠滴初始温度变化曲线
图7为钠滴着火延迟时间随氧气质量分数变化曲线,数据点为直径1.6 mm、相对速度0.9~3.8 m/s、不同初始温度下钠滴的试验数据,实线为Nu=8的理论曲线。可以看到随氧气质量分数降低,着火延迟时间先缓慢增加后迅速增加。
图8为钠滴着火延迟时间随初始直径变化曲线,数据点为初始温度723 K,氧气质量分数0.23,速度0.6~5.2 m/s的试验数据,实线为理论曲线。可以看到随钠滴直径减小,着火延迟时间先减小后迅速增加,这主要由于体表比的变化带来的表面反应热量产生和损失的变化。
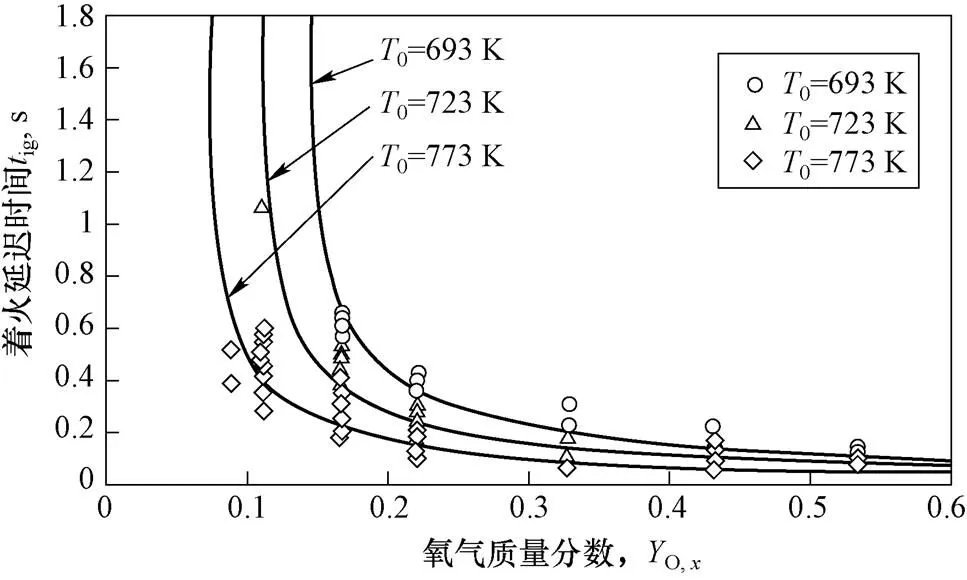
图7 着火延迟时间随氧气质量分数变化曲线
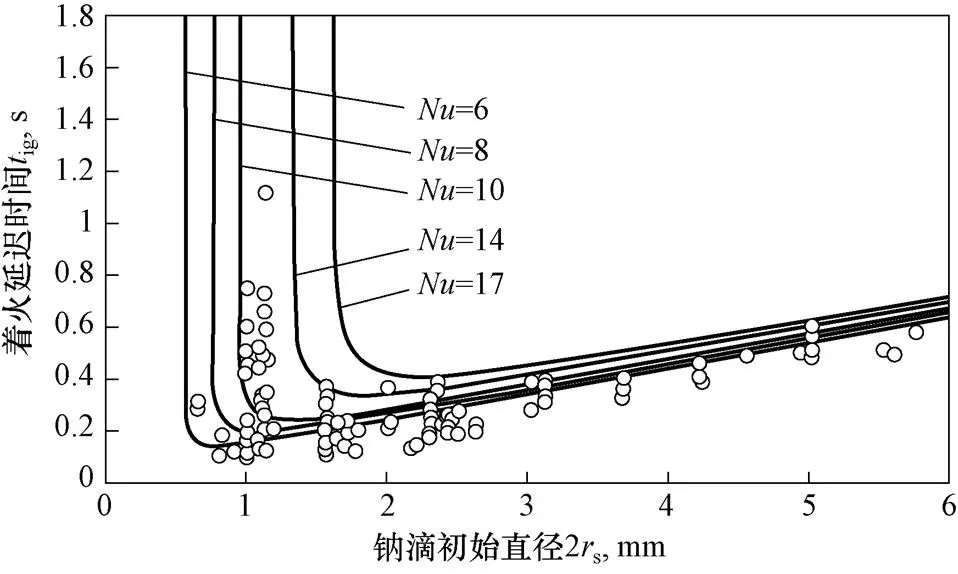
图8 着火延迟时间随钠滴初始直径变化曲线
图9为钠滴着火延迟时间随钠滴速度变化曲线,数据点为直径1.6 mm、氧气质量分数0.23,不同初始温度下钠滴的试验数据,实线为理论曲线。可以看到随速度增大,由于散热着火延迟时间先缓慢增大后迅速增加。
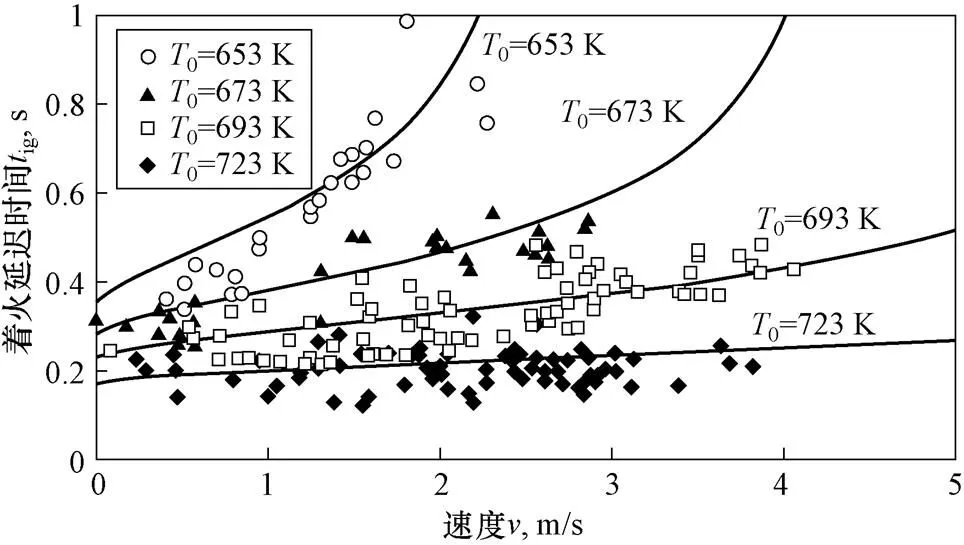
图9 着火延迟时间随钠滴速度变化曲线

图10 着火极限曲线试验数据点和理论曲线
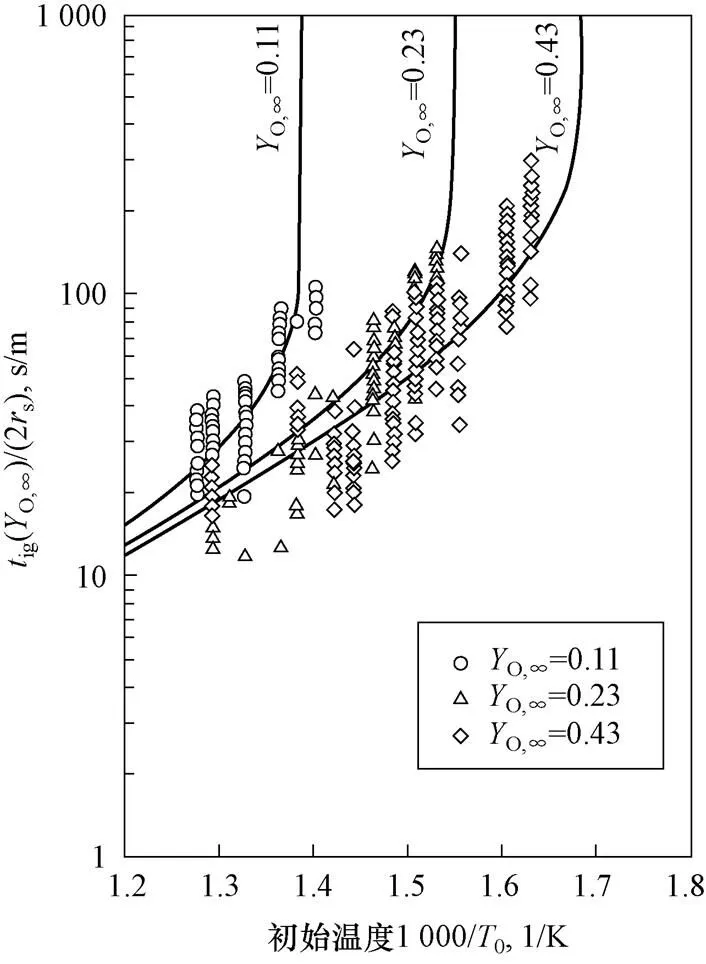
图11 着火延迟时间试验数据及理论曲线
4 钠滴着火特性数值计算和分析对比
Saravanan[15]等人(2011年,印度)使用传质控制模型和化学动力学控制模型对钠液滴着火过程进行了数值计算比较,Sathiah等人(2014年,荷兰)使用化学动力学控制模型和传质与化学动力学组合控制模型对钠液滴着火过程进行了数值计算比较,计算中均采用钠沸点1 156 K作为着火温度,钠滴温度从初始温度达到着火温度的时间为着火延迟时间。质量传输控制模型仅可预测低氧浓度下的着火极限,化学动力学控制模型和组合控制模型可以预测钠滴不同初始温度、氧气浓度、液滴直径和运动速度条件下的着火极限。
4.1 初始温度对着火特性的影响
如图12所示,三种模型钠滴着火延迟时间均随钠滴初始温度减小而增大,质量传输控制模型表面氧化速率受氧气传输控制,初始温度减小距离着火温度钠滴热容量增加,着火延迟时间增加;化学动力学控制模型随温度减小反应速率先缓慢减小后迅速减小,着火延迟时间相应先缓慢增大后迅速增加,初始温度低于着火极限温度时反应热释放速率小于散热速率,不能着火;组合模型预测的着火极限钠滴温度小于化学动力学控制模型。
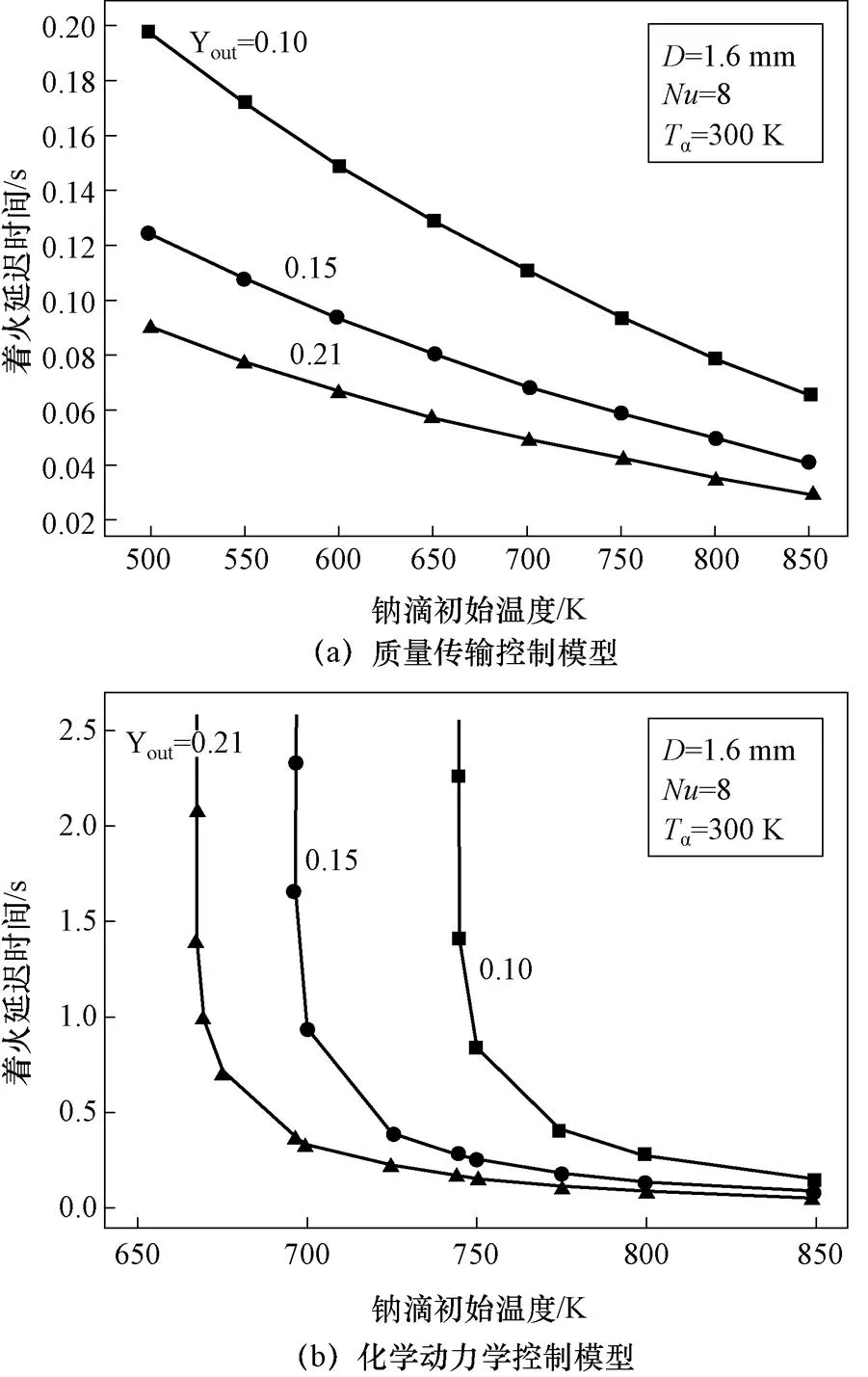
图12 不同模型钠滴初始温度对着火延迟时间的影响
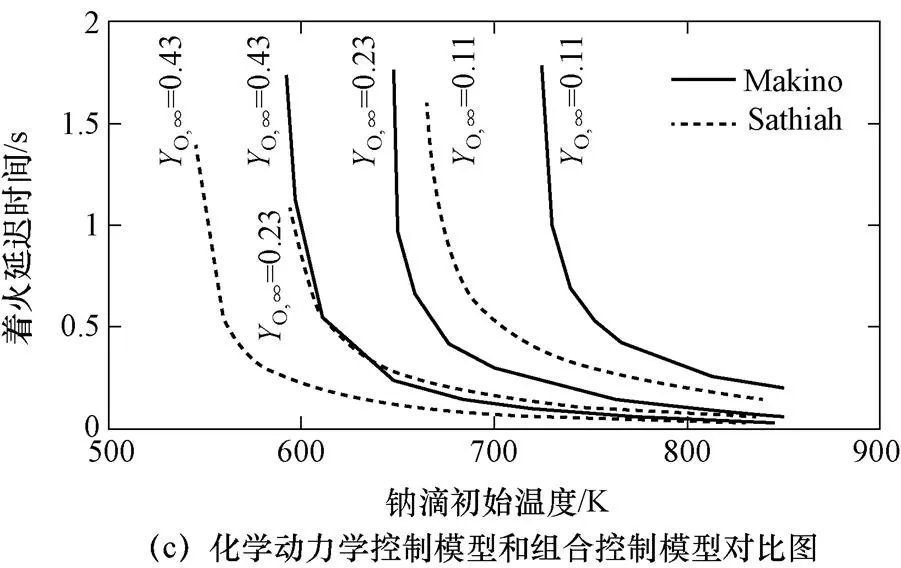
图12 不同模型钠滴初始温度对着火延迟时间的影响(续)
4.2 氧气浓度对着火特性的影响
如图13所示,三种模型钠滴着火延迟时间均随氧气浓度减小先缓慢减小后迅速减小,均能反映钠滴着火的氧气浓度极限,质量传输控制模型在极低氧气浓度(摩尔分数<0.02)下可以预测着火极限,化学动力学控制模型和组合模型可预测不同温度钠滴的着火氧气浓度极限,组合模型着火极限氧气浓度预测值小于化学动力学模型。
4.3 钠滴直径对着火特性的影响
如图14所示,质量传输控制模型散热系数和氧气传输系数均随钠滴直径减小而增加,反应释放热大于散热,因而着火延迟时间随钠滴初始直径减小也相应不断减小;化学动力学控制模型单位表面积的反应速率不受直径影响,受钠滴质量、换热系数变化影响,着火延迟时间先减小后增加达到着火临界尺寸;组合控制模型的临界尺寸小于化学动力学控制模型。
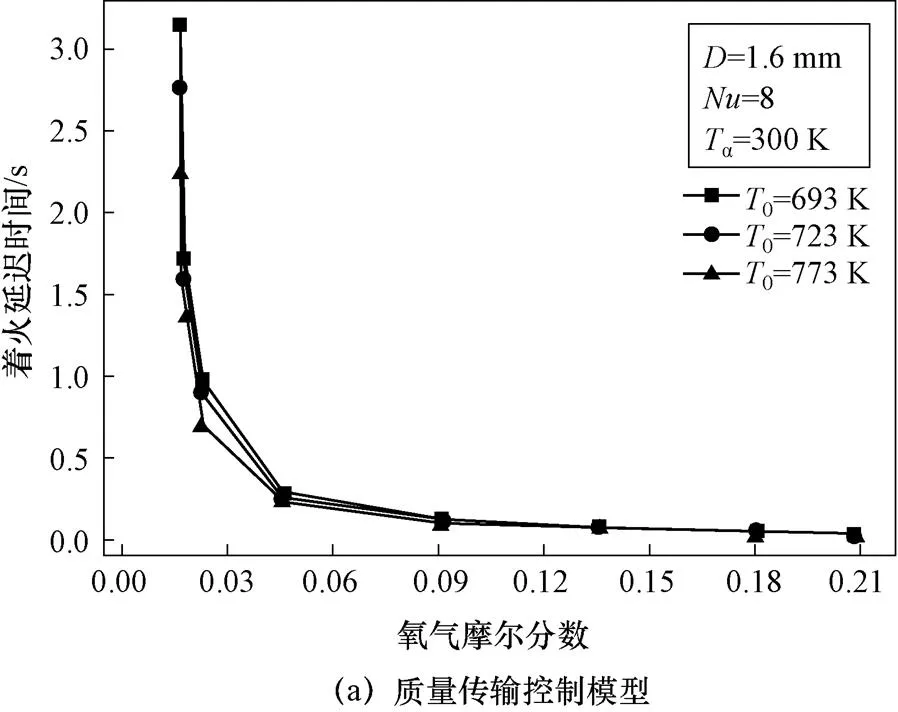
图13 氧气浓度对着火延迟时间的影响

图13 氧气浓度对着火延迟时间的影响(续)
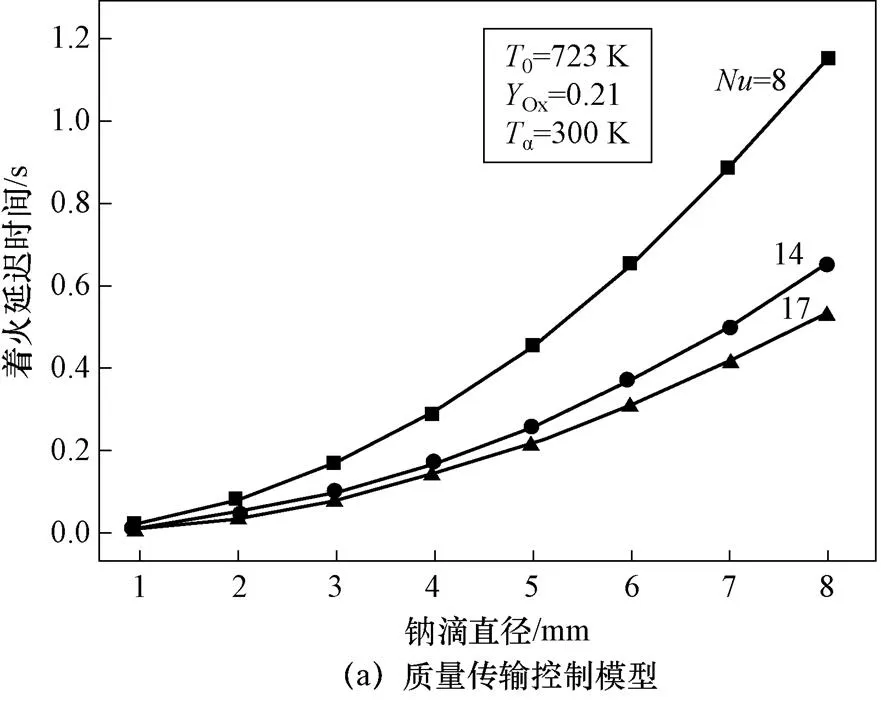
图14 钠滴直径对着火延迟时间的影响
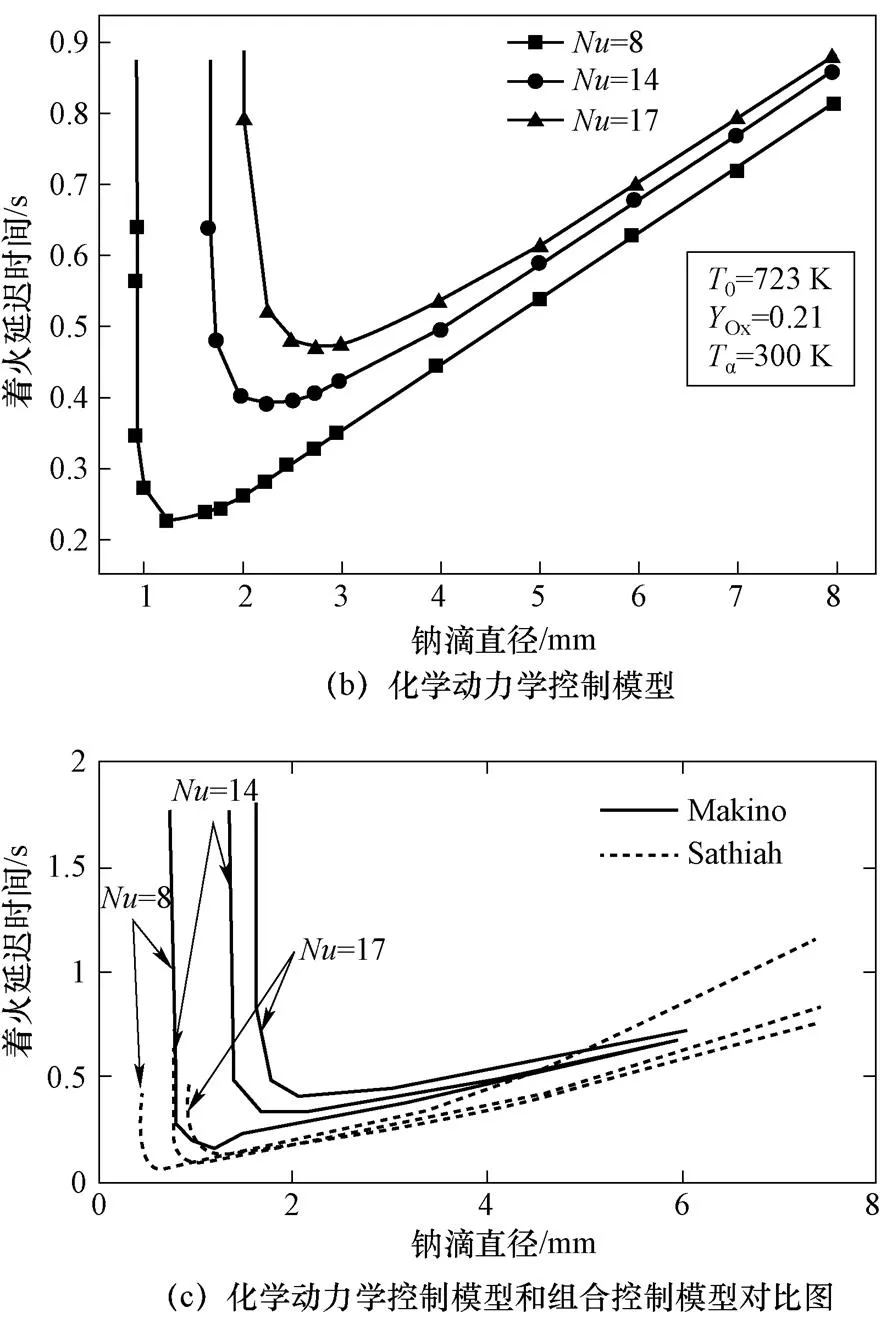
图14 钠滴直径对着火延迟时间的影响(续)
4.4 速度对着火特性的影响
如图15所示,质量传输控制模型由于速度增加引起氧气质量传输增加,反应产生热增加始终大于散热,着火延迟时间随钠滴速度增加不断减小;而化学动力学控制模型和组合控制模型,随速度增加散热增加,反应热与散热的差值越来越小,着火延迟时间增大,低温钠滴反应释放热量本身较小对速度更加敏感。化学动力学控制模型比组合控制模型对速度更加敏感,组合模型在钠滴速度很高时着火延迟时间才对速度敏感。
5 结论
本文通过研究钠滴预燃阶段特性、物理模型及模型计算分析对比情况得出以下结论:
(1)与碳氢化合物燃料液滴着火特性不同,由于钠的化学性质十分活泼,液态钠滴出现在空气后,满足着火极限条件可以自发着火,钠滴初始温度、直径、速度、环境氧含量和环境温度均影响钠滴着火延迟时间;
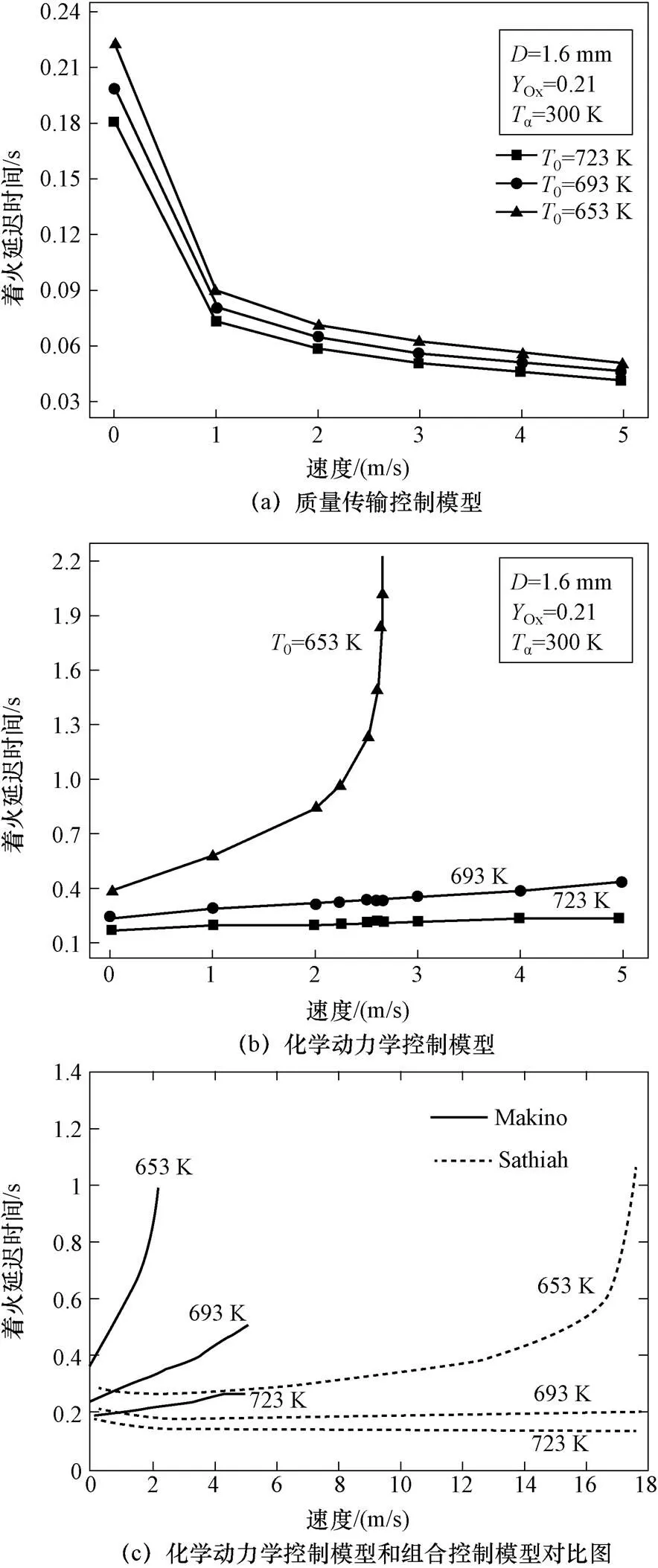
图15 速度对着火延迟时间的影响
(2)钠滴预燃阶段物理模型主要包括质量传输控制模型、基于温度的化学动力学控制模型和传质与化学动力学组合控制模型,其中,质量传输控制模型仅可预测低氧条件下的钠滴着火极限,化学动力学控制模型和组合模型可以预测不同条件下的钠滴着火极限;
(3)建议更加精确的钠火计算中钠滴预燃模型采用更加符合实际钠滴着火特性的化学动力学控制模型或传质与化学动力学组合控制模型。
[1] Spalding D. Some Fundamentals of Combustion[M]. Butteworths, London, England, 1955.
[2] Richard.J., Delbourgo.R, Laffitte.P. Spontaneous ignition and combustion of sodium droplet in various oxidizing atmospheres at atmospheric pressure[J]. Proceedings of the Combustion Institute, 12: 39–48, 1968.
[3] H. A. Morewitz, R. P. Johnson, and C. T. Nelson. Experiments on sodium fires and their aerosols [J]. Nuclear Engineering and Design, 42:123-134,1977.
[4] Kenji Sato. A Basic Experimental Study on Combustion of Suspended Sodium Droplet[R]. PNC TJ9807 98-001,1998.
[5] 孙树斌.钠滴氧化燃烧特性的实验研究[D].哈尔滨工程大学学位论文.2015.
[6] P. R. Shire. SPRAY Code User’s Report[R]. HEDL-TME 76-94, March 1977.
[7] Heisler, M.P., Mori, K. SOMIX-1 Users Manual for the LBL, CDC 7600 Computer[R]. N707TI130045, Atomics International, USA, 1976.
[8] E. U. Vaughan, K. K. Mort. The SOMIX-2C Sodium Spray Fire Code[C]. FAST REACTOR SAFETY, CONF- 850410-VO1.2, April 21-25,1985.
[9] S S. Tsai. Surface oxidation process prior to ignition on a sodium droplet[J]. Trans. Am. Nucl. Soc. 27, 524, 1977.
[10]S S. Tsai. The NACOM Code for Analysis of Postulated Sodium Spray Fires in LMFBRs[R]. NUREG/CR-1405, BNL-NUREG-51180, Brookhaven National Laboratory, Upton, NY, March 1980.
[11] Ranz W.E., Marshall W.R. Evaporation from Drops [J]. Chem Eng Progr, 1952, 48(4): 173~180.
[12]Atsushi Makino. Ignition delay and limit of ignitability of a single sodium droplet: theory and experimental comparisons[J]. Combustion and Flame, 134 (2003):149–152.
[13]Atsushi Makino, Hirokazu Fukada. Ignition and combustion of a falling, single sodium droplet[J]. Proceedings of the Combustion Institute,30 (2005) 2047–2054.
[14] Pratap Sathiah, Ferry Roelofs. Numerical modeling of sodium fire—Part I: Spray combustion [J]. Nuclear Engineering and Design,278 : 723–738,2014.
[15] Saravanan, S M., Rao, P.M., Nashine, B., Chellapandi, P. Numerical investigation of sodium droplet ignition in the atmospheric air[J].International Journal of Nuclear Energy Science and Technology,6 (4), 271–283, 2011.
Characteristics and Model Development of Sodium Droplet Pre-ignition
SHI Wentao1,DU Haiou1,SHEN Fengyang1,WANG Rongdong1,WANG Guozhi1,LIU Shuhui2
(1. China Institute of Atomic Energy, Beijing 100084, China;2. Institute of Industry Technology Guangzhou & Chinese Academy of Science, Guangzhou of Guangdong Prov. 511458, China)
Usually, the liquid sodium droplet can ignite spontaneously when it appears in normal temperature air ,which is different from the ignition characteristics of hydrocarbon fuel droplets. The ignition delay time and ignition limit of sodium droplets are controlled by the pre-ignition stage before gas phase combustion. In the pre-ignition stage, surface oxidation is the main process. The characteristics and physical model of this stage is a key point in the study of sodium droplet combustion. At present, the pre-ignition model used in the safety analysis program of the spray sodium fire of fast reactor in China controls the surface oxidation reaction rate by the rate of oxygen transfer to the surface of sodium drops, and the ignition delay time is calculated from the temperature of the sodium drop to the boiling point (1 156 k). The temperature based chemical kinetic control model and the combined mass transfer / reaction kinetic control model have been developed to describe the pre-ignition stage of sodium droplet. Through the comparison of the calculation and analysis results of different models for different initial conditions of sodium droplet ignition, the latter two models can predict the ignition limit of sodium droplet under different conditions and more in line with the actual ignition characteristics of sodium droplets.
Sodium Droplet;Pre-ignition Model;Ignition Delay Time;Ignition Limit
TL364
A
0258-0918(2021)03-0621-10
2021-02-29
石文涛(1989—),男,河北邯郸人,工程师,硕士,现主要从事钠火探测和消防方面研究

