腹腔镜下鞘外及鞘内解剖技术在左半肝癌患者中的应用
宋灏,谭勇,欧阳再兴,刘文瑛,朱剑华,吴黎明,黄从云
韶关市粤北人民医院肝胆外科一区,广东 韶关 512000
原发性肝癌为恶性肿瘤的主要类型,其恶性程度高,死亡率较高。目前原发性肝癌的治疗以手术切除为主,近年来腹腔镜技术在肝脏外科领域取得了较好的效果,现有研究证实腹腔镜肝切除术的治疗效果与传统开腹肝切除术相似,且在创伤、术后恢复方面更具优势[1]。但肝脏的解剖结构较复杂,血运丰富,腹腔镜下左半肝切除术的难度和风险相对较高。临床研究指出,肝血流阻断技术对术中大出血及术后肝功能衰竭的预防有重要作用[2]。既往临床在肝切除术中多选择全入肝血流阻断技术,其可明显降低大出血风险,但可引起血流动力学明显波动。近年来选择性半肝血流阻断法已在右、左半肝切除中开展,其可保留健侧血供,保持血流动力学平稳,降低手术风险[3]。选择性半肝血流阻断法包含Glisson鞘外和Glisson鞘内阻断法,目前缺乏腹腔镜下鞘内、鞘外解剖技术的系统性对比报道,本研究主要探讨左半肝癌患者腹腔镜下鞘外及鞘内解剖技术的应用效果。
1 资料与方法
1.1 一般资料 回顾性分析韶关市粤北人民医院肝胆外科一区2017 年4 月至2019 年8 月收治的65例左半肝癌患者的临床资料。纳入标准[4]:①患者确诊原发性肝癌,基础情况可,能够耐受外科大手术,且行腹腔镜手术治疗;②患者病历资料完整,且能进行随访调查。排除标准:①合并其他肿瘤者;②肝外转移或者肝内多发转移者;③其他器质性疾病者;④肝硬化失代偿期者。按照血流阻断方法分为鞘外解剖组34 例与鞘内解剖组31 例。两组患者的基线资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。本研究经韶关市粤北人民医院伦理委员会批准。
表1 两组患者的基线资料比较[,例(%)]
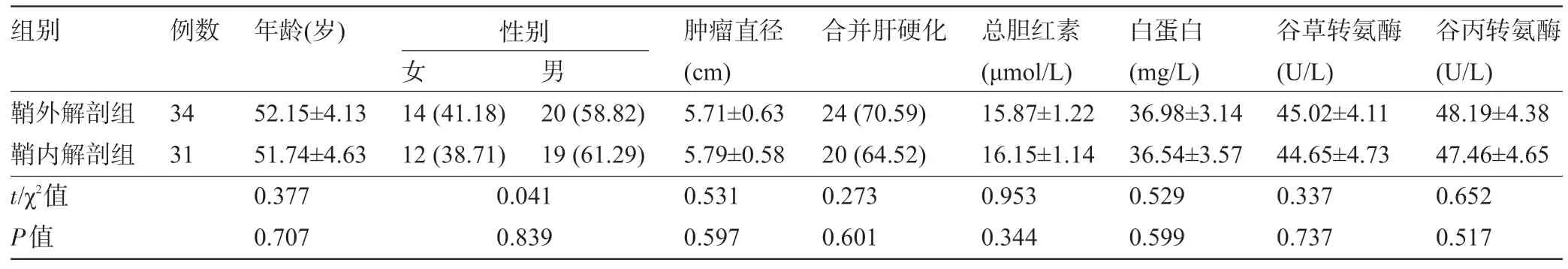
表1 两组患者的基线资料比较[,例(%)]
1.2 治疗方法 所有患者术前均进行常规准备,取人字形体位,在脐下缘取1 cm纵行小切口。创建气腹,腹内压控制在13 mmHg(1 mmHg=0.133 kPa)。在脐下Trocar 孔放置腹腔镜,在左锁骨中线肋缘下和右锁骨中线肋缘下切口放置10 mm Trocar 作为主操作孔,在右腋前线和左腋前线放置5 mm Trocar作为辅助操作孔,在观察孔内放置腹腔镜,常规探查腹腔。首先游离肝左叶,切断肝脏周围韧带。鞘外解剖组患者将肝脏肝门板打开,解剖困难时可少量切除肝组织。解剖左侧Glisson 蒂,于左侧Glisson 鞘间隙和肝实质进行由前至后的贯穿分离,于Glisson鞘和左尾叶肝实质之间穿出,绕过左侧Glisson 蒂,用血管吊带进行悬吊。鞘内解剖组患者解剖并显露第一肝门,小心分离肝门Glisson鞘内组织,充分暴露门静脉左支和左肝动脉,取可吸收夹进行夹闭或离断。解剖第二肝门,充分暴露左肝静脉主干,带线夹闭后并离断。两组患者均取超声刀离断相关韧带,游离左半肝,显露第二肝门。在左半肝缺血腺左侧用电钩标记肝切线,用超声刀离断肝实质。预估到达肝左静脉时进行Endo-GIA闭合离断。将切口扩大后完整取出病理组织并放置在标本袋中。术后查看肝断面出血和胆汁渗漏情况,必要时进行Prolene 线缝合,并对肝断面进行电灼止血。在腹腔常规置入引流管两根。两组术中发生难以控制出血情况时均马上转至开腹止血,本研究均无中转开腹患者。术后均进行抗感染、营养、护肝、吸氧和心电监护等对症支持干预。
1.3 观察指标与检测方法 (1)围术期指标:比较两组患者的手术时间、术中出血量、肛门排气时间(手术截止时间至术后肠道内有正常的肠鸣音,肠道内产生的气体开始正常排出体外的时间)、住院时间,引流管留置时间。(2)肝功能指标:术后第1 天和第7 天采集两组患者空腹外周静脉血,采用全自动生化分析仪测定总胆红素(TBIL)、谷草转氨酶(AST)、谷丙转氨酶(ALT)水平。(3)并发症:比较两组患者术后出血、胆漏、胸腔积液等并发症发生情况。(4)随访情况:所有患者术后均随访1 年,定期进行甲胎蛋白、腹部彩超、胸片等检查,统计肝癌复发(术后经实验室及影像学检查发现肝外或肝内存在实质性占位病变,甲胎蛋白呈阳性,或经肝穿刺活检病理确诊为肝癌)情况及1年内生存情况。
1.4 统计学方法 应用SPSS20.0 统计软件进行数据分析,计量资料以均数±标准差()表示,组间比较采用t检验,计数资料比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的围术期指标比较 鞘外解剖组患者的手术时间明显少于鞘内解剖组,差异有统计学意义(P<0.05);两组患者术中出血量、肛门排气时间、住院时间、引流管留置时间和切缘阴性率比较差异均无统计学意义(P>0.05),见表2。
表2 两组患者的围术期指标比较()
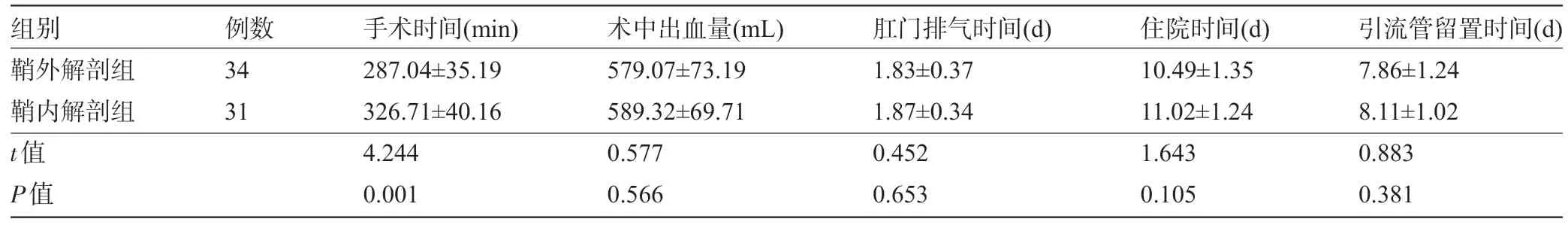
表2 两组患者的围术期指标比较()
2.2 两组患者手术前后的肝功能指标比较 术后第7 天,两组患者的TBIL、AST、ALT 水平明显低于术后第1 天,Alb 水平明显高于术后第1 天,差异均有统计学意义(P<0.05);两组患者术后第1 天和术后第7天的TBIL、Alb、AST、ALT 比较差异均无统计学意义(P>0.05),见表3。
表3 两组患者手术前后的肝功能指标比较()
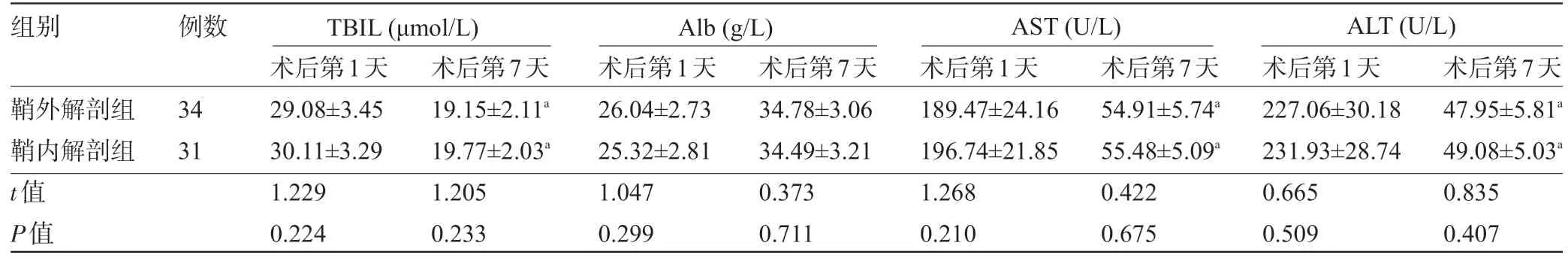
表3 两组患者手术前后的肝功能指标比较()
注:与同组术后第1天比较,aP<0.05。
2.3 两组患者的并发症发生情况比较 鞘外解剖组与鞘内解剖组术后出血分别有1例、胆漏分别有1例、胸腔积液分别有1例,鞘外解剖组与鞘内解剖组并发症总发生率分别为8.82%、9.68%,差异无统计学意义(P>0.05)。
2.4 两组患者的随访情况比较 鞘外解剖组患者的复发率和死亡率分别为11.76%、5.88%,与鞘内解剖组的9.68%、3.23%比较差异均无统计学意义(P>0.05)。
3 讨论
肝切除术是临床公认的治疗原发性肝癌的有效手段[5]。但开腹肝切除的切口和创伤较大,不利于机体术后恢复。
目前腹腔镜技术在肝脏外科中的作用已得到临床认可,较开腹肝切除术的创伤更小,术后并发症更低,术后恢复时间更短。有关研究表明,腹腔镜左半肝切除近年来已成为治疗左半肝癌的常用术式[6]。但肝脏具有双重血供,血运丰富,断肝时易发生大出血,增加腹腔镜下肝切除对出血的控制难度。全入肝血流阻断技术是腹腔镜左半肝切除中阻断肝血流的传统方法,其可有效控制手术中出血,提供清晰的手术视野。但有研究表示,全入肝血流阻断技术能够同时阻断左、右半肝血流,可能导致右肝细胞出现长时间的血氧不足,引起不可逆损伤,增加术后肝功能衰竭的发生风险[7]。另外据临床资料报道,肝癌患者多伴程度不一的肝硬化,基础肝功能相对较差,导致全肝血流阻断的开展受到一定限制[8]。有研究发现,选择性半肝血流阻断法能够有效控制感切除患者的术中出血,并可预防肝脏发生缺血再灌注损伤[9]。金辉等[10]研究也表示,左半肝癌患者术中阻断左门静脉及肝动脉,能够明显减少对胃肠道血流动力学的影响,避免出现胃肠道损伤。
鞘外和鞘内解剖是阻断半肝血流的代表性技术,其中腹腔镜下鞘外解剖是在患者肝门鞘外解剖显露Glisson 系统,无需精确解剖第一肝门,对半肝的入肝血流阻断后根据患者缺血带进行断肝,其操作更为快速、简便[11]。鞘内解剖在腹腔镜镜头直视下对血管进行分离及阻断,可避免鞘外组织对肝方叶实质和对侧肝管产生的损伤,在打开Glisson鞘后将门静脉和肝动脉选择性解剖、阻断,术中无需离断胆管,能够起到有效的入肝血流阻断作用,确保术中阻断的安全性[12]。但鞘内解剖应充分结合影像学资料,充分了解韧带管道解剖结构,避免盲目分离所引起的非必要性创伤出血。另外鞘内解剖的难度更大,且不适用于有解剖变异患者。目前临床缺乏对鞘外和鞘内解剖技术的对比报道,二者的可行性和安全性存在争议。本研究结果显示,鞘外解剖组手术时间相对较少,表明鞘外解剖技术的耗时更短,手术效率更高。两组术中出血量类似,提示两种肝血流阻断法均能够有效控制术中出血。肛门通气时间能够评价患者术后胃肠道功能恢复情况,本研究中两组患者术后肛门通气时间相似,但均少于既往文献报道的全入肝血流阻断法,提示腹腔镜下鞘外和鞘内解剖术对肠道功能的影响均较小[13]。但两组引流管拔除时间、住院时间差异无统计学意义。TBIL、Alb、AST、ALT为临床评价肝功能的常用指标,有研究报道,肝脏缺血再灌注损伤能够影响TBIL、Alb、AST、ALT等指标的表达[14]。本研究结果显示,术后7 d时患者TBIL、AST、ALT 较术后第1 天有所降低,Alb 有所增加,但组间比较各指标水平无明显差异,提示腹腔镜下鞘外及鞘内解剖术式对肝功能的保护作用方面无显著差异,患者术后的肝功能均可快速恢复。虽然腹腔镜有放大作用,但腹腔镜下操作的难度较大,有并发症可能。既往文献报道,术后出血、胆漏、胸腹腔积液为腹腔镜下肝切除术的常见并发症[15]。本研究中,两组术后均有少数患者发生并发症,经对症干预后均得到好转,且组间并发症发生率无显著差异。目前有关腹腔镜下鞘外和鞘内解剖术在原发性肝癌患者术后肿瘤复发和生存方面尚存争议。本研究结果显示,两组术后复发率、死亡率差异无统计学意义,提示鞘外和鞘内解剖技术在预后方面显著差异。
综上所述,左半肝癌患者腹腔镜下鞘外和鞘内解剖技术均可有效阻断肝门血流,但鞘外解剖技术能够缩短手术时间,临床需综合考虑从而合理选择术式。

