肝脏类器官的研究进展
景思佳 郑慧琳 张 蕾*
1(浙江科技学院生物与化学工程学院, 杭州 310023)2(浙江省农业生物资源生化制造协同中心,杭州 310023)3(浙江省农产品化学与生物加工技术重点实验室,杭州 310023)
引言
肝脏负责人体中代谢物转化、蛋白质合成和异源物质解毒等重要功能的实现[1]。实质细胞和非实质细胞共同构成肝脏,其中非实质细胞包括肝星状细胞、库普弗细胞、肝窦内皮细胞和各种免疫细胞[2]。由于受到药物损伤、饮食习惯、病毒感染等多种因素的影响,容易发生脂肪肝、肝硬化、药物性肝损伤甚至导致肝癌[3-5]。但由于肝脏内部微环境复杂,具有显著的个体差异,很难建立最佳的疾病模型来探索肝脏疾病的发生、发展和治疗。针对脂肪肝、肝炎、肝纤维化、肝癌等发病机制的研究以及药物的研发,目前主要以体外二维细胞模型和体内动物模型为主。体外二维模型即肝细胞株二维培养,表达较低的肝脏特有的合成和代谢相关酶,与体内肝脏生理环境相差甚远,且细胞与细胞外基质之间缺乏或不存在相互作用,但对于维持生物功能和原位表型以及组织特异性的细胞过程中的相互作用不可或缺[6-7];体内动物模型存在试验周期长、种属差异等缺陷,对于大规模的评估和筛药过程并不适用[8],如患者来源的异种移植模型[9-10],向免疫缺陷小鼠体内移植人类肝癌组织,成瘤率低于30%,肿瘤也会随之进化,导致与人类肿瘤有较大的差异[11-14]。而通过3D类器官培养技术,构建肝脏类器官模型(见表1),可形成已分化组织的复杂空间形态,维持细胞的生理功能,在细胞构成、组织结构和特定功能等方面与人肝脏的生理病理环境更为相似。

表1 肝脏类器官的优势Tab.1 The advantage of liver organoids
在肝脏类器官的形成过程中,首先通过诱导前肠内胚层分化形成肝祖细胞,在外源因子BMP、FGF、OSM、HGF等的响应下,调节多种信号通路,促进肝祖细胞增殖,并迁移到中胚层形成肝芽。在形成肝芽和肝叶的过程中,可通过加入肝成熟外源因子,使肝祖细胞向肝细胞和胆管细胞分化(见图1)。肝脏类器官能更好地模拟肝脏的代谢合成功能,如糖原代谢、脂质代谢、类固醇代谢、药物代谢、白蛋白分泌、尿素合成等;可高表达肝细胞相关的药物代谢酶、核受体及肝特异性标志物,如ALB、AAT、HNF-4α、HNF-3β等。

图1 肝脏类器官的构建Fig.1 The construction of liver organoids
1 肝脏类器官的研究进程
类器官保留了细胞间的接触,从而促成了它们的相互作用和自我聚集,是一种简化后的微型器官。类器官的微环境由细胞因子和细胞外基质组成,细胞因子调控多种信号通路,与细胞的增殖、自我更新和分化相关,并借助细胞外基质的作用,自组织特异性的类器官形成,使其在真实器官的结构和功能方面得到有效的反映[15]。肝脏类器官既可以模拟肝脏特有的功能[16-17],也可以模拟生理条件下药物在体内长期暴露后对肝脏的损伤和累积性毒性[18],并可结合荧光成像技术来实现药物的高通量评价[19]。肝脏类器官的发展非常迅速,如图2所示。2013年,Hans Clevers等[27]首次对人肝脏类器官进行研究,发现通过激活Wnt信号通路,利用Lgr5+的肝脏干细胞,可成功构建肝脏类器官,并通过分化和移植实验,证明其具有肝细胞的功能活性。虽然构建的肝脏类器官仅具有肝脏的部分基础功能,但却为后续研究与开发奠定了基础。2019年,使用iPSC衍生的肝脏类器官的研究表明,由于再现了肝脏固有的免疫反应,所以促成了乙肝病毒(hepatitis B virus, HBV)和丙肝病毒(hepatitis C virus, HCV)的自然进入[31]。虽然肝脏类器官较真实地再现了宿主病毒的相互作用,但它们是否可用于筛选抗病毒个性化治疗还有待进一步研究。随后,利用类器官进行多器官的联合培养也成为一种研究方向。Takebe等[32]在世界上首次利用iPSC成功培育出了3种互相连接的类器官,包括肝脏、胰腺和胆管,为研究人类器官早期形成的复杂相互作用过程提供了可能。

图2 肝脏类器官的发展进程Fig.2 The development of liver organoids
1.1 肝脏类器官的种子细胞
多种细胞可作为种子细胞进行肝脏类器官的培养(见表2),肝癌细胞如HepG2细胞,常被用于肝细胞体外功能的研究,且可能具有肝细胞不具有的基质重建能力[59],常被用于药物肝毒性检测[61]。以肝癌细胞为种子细胞的类器官在一定程度上反映了肝癌患者某些方面的异质性——癌细胞组成、表型、治疗反应等[62],但由于其相对恒定的遗传信息,无法充分个性化地显示其肝脏的病理状态。而利用原代肝细胞进行类器官的培养,可以保留遗传信息的异质性,被认为是肝脏体外研究的最佳标准。然而,人原代肝细胞较难获得,而且分离得到的肝细胞的功能很难在体外维持。在体外培养时,由于缺乏合适的微环境和无法维持长期的培养[63],会导致肝细胞脱分化,使肝细胞功能丧失,从而限制了肝细胞用于体外类器官的培养。以诱导性多能干细胞(induced pluripotent stem cell, iPSC)或成体干细胞(adult stem cell, ASC)为种子细胞,一直是肝脏类器官的研究方向。iPSC由体细胞重编程而得,具有自我更新能力和多向分化潜能,可以产生大量特定的细胞类型,基于iPSC的系统可以用于研究体外复杂细胞的相互作用,且iPSC衍生的肝细胞具有药物代谢能力,适用于检测早期药物的肝毒性,并有望用于个性化治疗。但是,基于iPSC建立的肝脏类器官经长期培养后往往会出现基因组突变等问题,而ASC建立的肝脏类器官的染色体和基因组较为稳定,可作为肝脏类器官潜在的优势种子细胞类型[64]。间充质干细胞(mesenchymal stem cell,MSC)作为一种ASC,在体外具有多向分化潜能,可分化为肝细胞、肝窦内皮细胞、肝星状细胞、成纤维细胞、脂肪细胞等,参与肝脏类器官的构建[19]。在保持肝脏类器官细胞多样性的同时,基于间充质干细胞建立的肝脏类器官又可以长期培养,用于大规模的药物筛选[65]。基于间充质干细胞和间充质干细胞分化而得的各细胞构建的肝脏类器官,可以保证来自同一个体,使整体染色体和基因组保持一致。故这些细胞对于肝脏类器官的开发应用(见图3),如基于肝脏类器官的药物筛选平台和疾病模型(包括脂肪肝、肝纤维化和肝癌类器官等模型)的建立,都有重要意义。
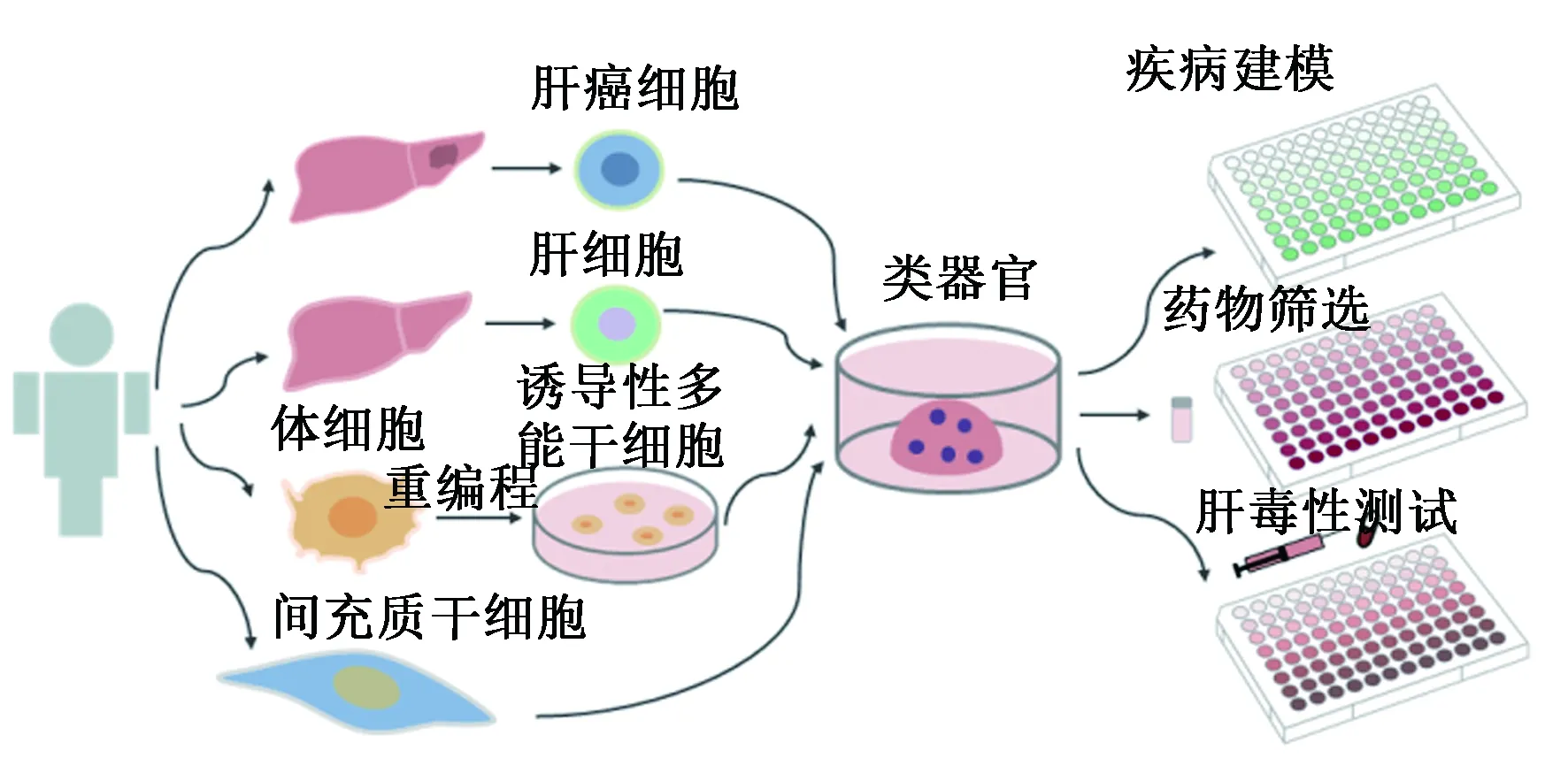
图3 肝脏类器官的开发及应用Fig.3 The development and application of liver organoids

表2 肝脏类器官的种子细胞Tab.2 The seed cells of liver organoids
1.2 肝脏类器官的构建方式
类器官的自发形成通过生理性的内源机制来实现,且细胞与基质间的相互作用是必不可少的。近年来,许多生物材料(见表3)被用于体外类器官培养,构建安全、稳定、可塑性强的活性生物材料将为肝脏类器官生长研究提供更大的时间和空间弹性。水凝胶作为一种生物材料,表现出各向异性的板层结构和不同大小的孔隙,可用于模拟肝脏的结构。研究表明,在利用肝细胞脱细胞外基质水凝胶进行三维培养后,所形成的具有三维结构的类器官能够实现对药物的代谢[81];但其能够维持肝细胞功能的时间仍较短,不能满足长期的研究需求。以肝细胞脱细胞外基质水凝胶进行肝脏类器官培养的技术目前并不成熟,其制备方式、是否与其他成熟水凝胶混用及培养方式仍有待研究。作为肝脏类器官培养,基质胶是最常见也是较为成熟的一种细胞外基质。Takebe等[82]将混合细胞放在基质胶中共同培养,发现其自组装成肝芽;形成的肝芽具有血管化和功能化,但未形成胆管结构,与人成熟肝脏仍有一定的差距。Broutier等[83]利用基质胶,形成了具有胆道祖细胞特征的三维类器官,并可向肝系分化,在长期培养后仍能保持稳定的遗传特征。对于疾病建模、药物筛选等,需要大量具有完全持续分化功能的人肝细胞。Wang等[77]通过建立化学成分确定的培养基或限定化学成分的(无血清、无饲养层)培养基,以基质胶为细胞外基质,产生了可扩展的肝脏类器官,能够稳定地维持双能干/祖细胞的表型特征,并具有向功能性肝细胞或胆管细胞分化的能力。目前,基质胶培养肝脏类器官的方式相对较为成熟,且培养的肝脏类器官在稳定性、功能性等方面表现出优异性,但在基质胶中培养的细胞非常脆弱且易碎,因此在大规模生产时存在问题。而生物反应器在类器官的大规模生产中具有一定的优势,并能够增加氧和营养物质的输送,防止细胞沉降等,从而克服了静态培养体系固有的局限性[84]。利用生物反应器——旋转瓶,可建立一种高效的Lgr5+干细胞的类器官培养方法,结果显示成熟的肝细胞标记物较静态的类器官有较高的上调,细胞色素P450活性达到与肝细胞相当的水平[85],有望实现肝脏类器官的大量生产。在未来的研究中,将基质胶与生物反应器结合来培养肝脏类器官,既能快速稳定地形成肝脏类器官,又能实现大规模生产,从而应用于临床实际。
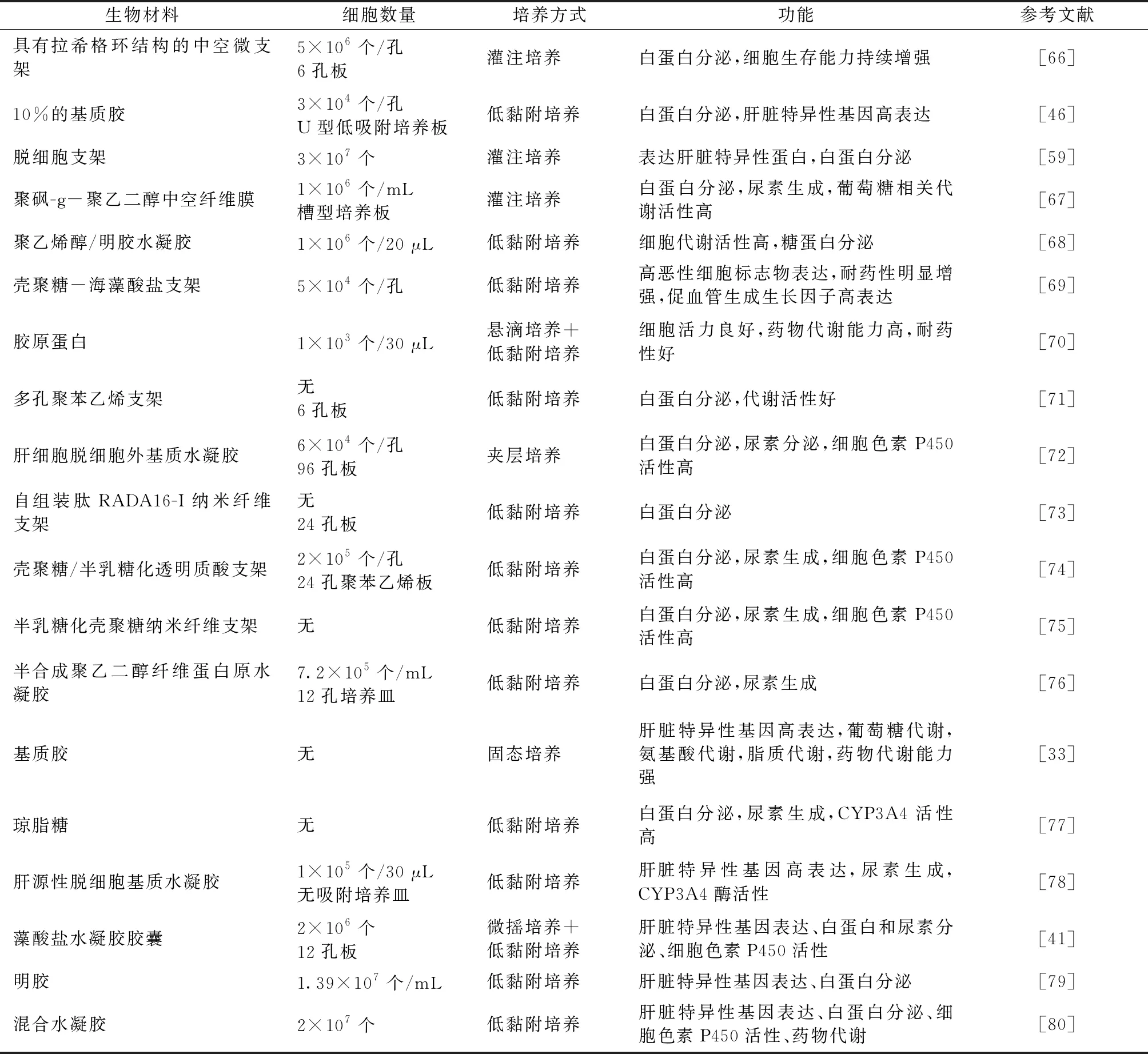
表3 生物材料在肝脏类器官培养中的应用Tab.3 Application of biological materials in liver organoids culture
2 肝脏类器官具有疾病建模能力
目前,利用肝脏类器官成功建立的疾病模型主要包括酒精性/非酒精性肝病模型、脂肪变性模型、肝纤维化模型、肝癌模型等。2015年,Hach等[86]利用从成人肝脏组织中分离得到的基因组稳定的干细胞建立了肝脏类器官,不仅其具有分化活性,而且还通过建立A1AT缺陷的疾病模型,证明其可以缓解肝细胞的功能活性。虽然该研究目前仅限于建立了肝脏疾病模型,对于肝脏类器官在其他领域的应用仍是空白,但也为通过肝脏类器官研究人类肝脏再生、人类肝脏疾病机制、毒理学或药物测试开辟了一条新途径。2019年,Guan等[87]通过肝脏类器官建模,发现了一条对早期肝脏发育至关重要的途径,即磷脂酰乙醇胺生物合成,基于这一发现,开发了一种用于治疗原发性肝癌的新型联合药物。从机制研究出发,肝脏类器官的形成过程为详细分析调控肝脏发育各个阶段的途径提供新思路;开发的新型联合药物可作为原发性肝癌的临床药物,为原发性肝癌患者提供新的治疗方案。在作为肝纤维化和非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)模型方面,肝脏类器官也具有巨大的潜力。肝纤维化与肝星状细胞的状态变化相关,肝星状细胞作为肝脏内的特异性间充质细胞,当肝脏受到损伤时,静止的肝星状细胞向增生性肌纤维肝星状细胞分化。Leite等[88]通过肝细胞和肝星状细胞的共同混合培养产生肝脏类器官,在单次或重复暴露于促纤维化化合物烯丙醇和甲氨蝶呤14天后,表现出纤维化特征,如星状细胞活化、胶原分泌和沉积。由分化的肝细胞和原代肝星状细胞培养的肝脏类器官是第一个模拟药物诱导肝纤维化的体外方法,这对于研究肝纤维化的形成和改善具有重要意义。但是,仅仅通过激活细胞因子介导的星状细胞来研究纤维化表型,并不能代表人体复杂的肝脏疾病,Wang等[77]通过整合的肝脏类器官,开发了酒精性肝病模型,可表现酒精性肝病相关的病理变化,如氧化应激产生、炎性介质释放、脂肪变性和纤维化;其构建的模型可以完全模拟酒精性肝病的病理生理变化和发病机制,未来可以通过引入免疫细胞,构建更为准确的体外类器官疾病模型,进一步分析脂肪性肝炎。脂肪在肝细胞中的积累和脂毒性,对非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)的炎症和纤维化的发展具有重要作用。2019年,Ouchi等[89]建立肝脏脂肪变性类器官模型,结果表明其脂质代谢相关的代谢物明显增加,表现出脂滴积聚、甘油三酯升高和线粒体损伤。在构建该模型时,研究人员引入了由iPSC分化而来的免疫细胞——Kupffer细胞,使得该模型可以用来代表更为普遍的环境依赖性纤维化表型,如脂肪性肝炎。肝脏类器官也可通过基因工程模拟人类肝癌的初始变化,并监测组织学变化[90]。由成体干细胞、诱导性多能干细胞、肝细胞等产生的肝脏类器官具有疾病建模能力,为肝脏类器官作为药物筛选和肝毒性测试的平台提供了一个机会。
3 肝癌类器官具有对药物的敏感性
肝癌是最常见的癌症相关死亡原因之一,但目前缺乏能够再现肿瘤病理变化的体外模型用于筛选治疗药物,而肝癌类器官模型可以最大限度地模拟亲代肿瘤的基因组及组织学结构和肿瘤发生机制[91]。Buzzelli等[92]利用结直肠癌(colorectal cancer,CRC)肝转移瘤来源的类器官,对5-氟尿嘧啶、伊立替康或奥沙利铂等药物进行了抗肿瘤效果的筛选,结果表明这些药物可以明显延缓肿瘤类器官的生长,所构建的CRC肝转移类器官可用于评价晚期患者的药物反应和化疗耐药情况。但目前人体多发的肝癌仍是原发性肝癌,故筛选治疗原发性肝癌的药物至关重要。Broutier等[52]首次制造出人类原发性肝癌类器官,所建立的肝癌类器官来自8个个体,代表了癌症中最常见的3种亚型:肝细胞癌(hepatocellular carcinoma, HCC)、胆管癌(cholangiocarcinoma, CC)和HCC/CC合并癌(combined hepatocel-lular-cholangiocarcinoma, CHC),并证实ERK抑制剂SCH772984可作为新型的潜在治疗剂,用于治疗原发性肝癌(primary liver cancer, PLC)。但该培养体系仍存在局限性,无法研究肿瘤细胞基质和免疫系统的相互作用,从而无法确定ERK抑制剂SCH772984在更大范围肝癌中的有效性。Cao等[93]在建立肝脏类器官后,以二乙基亚硝胺诱导产生肿瘤,并证明索拉非尼和瑞格菲尼可成功抑制肝癌类器官的生长。该研究覆盖了多达129种肝脏和肝癌样本,提高了药物筛选的可靠性,但局限于小鼠,所以成功筛选的两种敏感性药物对于人体肝脏是否同样适用仍是未知。Sun等[91]通过向肝脏类器官引入其他致癌基因和肿瘤抑制因子来建立肝癌模型,并发现Crenigacestat和Nifuroxazide使肝癌细胞数量和相关基因的表达大幅下降。以肝癌类器官筛选药物正作为药物发现过程的一种替代方法被进一步研究,使得预测患者对特异性药物的反应成为可能。
4 肝脏类器官适用于药物肝毒性检测
药物或其中间代谢物可造成对肝脏的毒性作用,即药物性肝损伤(drug-induced liver injury, DILI),易引发急性肝衰竭,导致药物撤出市场[94]。因此,在药物研发过程中进行药物肝毒性的评估是必不可少的,而肝脏类器官将会是药物肝毒性筛选的良好模型。Sgodda等[95]发现,肝脏类器官对具有肝毒性的乙酰氨基酚有高敏感性,且有很高的重复性。Bell等[96]证明,肝细胞三维培养模型在肝毒素的慢性暴露下,其敏感性急剧增加,其中一种药物在三维模型中重复给药后表现出肝毒性,而在过去的体外二维模型中并未检测到肝毒性,表明构建的三维模型更适用于药物肝毒性的评估;并且其在三维培养中保留了个体间的差异,可被用于研究药物对具有特定基因型的肝细胞的毒性反应。Chakraborty等[97]发现,免疫细胞参与药物肝毒性的发生,而免疫系统的参与是某些药物的肝损伤作用发生的主要原因[98]。Kostadinova等[99]发现,将肝细胞与免疫细胞混合培养,所建立的三维肝脏培养模型在被特定的肝毒性物质孵育后,与肝细胞二维培养模型相比,能更好地检测出体内药物诱导毒性,包括物种特异性药物效应。因此,研究药物的肝毒性,可以通过免疫细胞与肝细胞或其他细胞的共培养建立的肝脏类器官模型来实现。2019年,Mun等[33]由iPSC为种子细胞的肝脏类器官模型发现,在以CYP3A4-和CYP1A2/2E1-介导的肝毒性药物的作用下,该模型较二维培养模型呈现显著的敏感性;由于其具有极性胆管样结构,可用于预测肝胆抑制药物的胆汁淤积毒性、肝细胞毒性以及DILI的混合型毒性,且适用于大规模的药物肝毒性检测。未来可借助高通量筛选建立肝脏类器官生物信息库,通过肝脏类器官生物信息的筛选进行新药肝毒性的测试。
5 总结与展望
目前,国内外研究主要围绕着Lgr5+干细胞、iPSC诱导的肝细胞混合间充质干细胞和血管内皮细胞、临床组织样本等进行肝脏类器官的培养,不断创造各种新型生物材料作为细胞外基质,以支撑肝脏类器官的三维生长,不断探索各细胞因子的混合使用比例与时间,以促进类器官的分化,并借助组织工程技术重塑肝组织的完整性,提供了一个3D环境来更准确地再现体内环境,旨在提供一个模拟肝脏发育、疾病发生和癌症进展的模型,部分取代动物模型来检测临床药物的有效性和安全性。
但是,目前对于肝脏类器官的研究仍处于早期发展阶段,利用基质培养,其组成没有定义,在培养中引入变量,对于其在临床上的应用是有限制的。类器官的微环境本质上是异质性的,其周围的细胞接受了最多的营养和氧气,而靠近中心的细胞通常是缺氧的[33,99-101],在培养过程中难以控制其形状、细胞成分,不能完全概括肝脏中存在的多种细胞类型及成熟程度,即无法完全实现成熟肝脏的功能,以及器官的免疫化、血管化和神经支配。肝脏类器官的实际表型更接近于胆管细胞[102],需要有更好的条件将这些细胞分化为成熟的肝细胞,否则可能限制肝脏类器官在疾病模型或药物筛选等方面的适用性,只能部分替代动物建立疾病模型,且由肝脏类器官所建立的疾病模型能否保持疾病的表观遗传特征,即能否用于疾病的发生与发展,仍是未知的。
因此,需要从不同方面解决肝脏类器官培养过程中存在的问题,如优化3D培养体系、不同方式联合培养、不同细胞以最佳混合比例及种类共培养等。需要进一步研发新的生物合成材料或无基质培养平台,使细胞能够在三维结构中自聚集而不丢失它们的发育命运。进一步开发共培养体系,如利用上皮细胞与内皮细胞、间充质干细胞和免疫细胞的相互作用,创造更复杂的类器官系统,积极参考和应用肠道类器官在这方面的研究成果[103-104]。肝脏类器官系统还可结合基因组编辑技术,确定肝脏疾病引起的突变如何影响肝脏发育和发病机制。目前研发的各类肝脏类器官模型,为研究人类肝脏及其相关疾病创造了机会,从肝脏疾病的疾病建模到药物肝毒性等生物医学应用方面都具有良好的前景。

