植物活性成分调节胰岛素分泌机制研究进展
张晓云,张薛勤,梅晓宏
(中国农业大学食品科学与营养工程学院,农业农村部农业转基因生物安全评价(食用)重点实验室,北京 100083)
糖尿病(Diabetes Mellitus,DM)是一组以高血糖为特征的代谢紊乱性疾病,常伴如随肾病、神经性病变、心脑血管疾病等多种慢性并发症[1],分为1型糖尿病(Type 1 Diabetes Mellitus,T1DM)、2型糖尿病(Type 2 Diabetes Mellitus,T2DM)、妊娠糖尿病(Gestational Diabetes Mellitus,GDM)和其他特殊类型糖尿病,其中T2DM占总糖尿病病例的90%左右[2]。1型糖尿病又名胰岛素依赖型糖尿病,是由胰岛素分泌绝对不足所引起,而2型糖尿病主要是因为产生胰岛素抵抗(Insulin Resistance,IR)或胰岛素分泌相对不足所导致[3]。国际糖尿病联合会(IDF)预测,随着糖尿病患病人数与日俱增,大约30年后,患病人数将高达6.93亿[4]。糖尿病日益成为最具挑战的公共健康问题之一,因此,如何预防和治疗糖尿病成为当今全球关注的焦点。
1型糖尿病和2型糖尿病的病理生理基础均与胰岛素分泌缺陷有关,因此通过药物促进胰岛素分泌或者注射胰岛素成为目前治疗糖尿病的重要方案。由于口服促胰岛素分泌的降糖药物尚存在不同程度的副作用[5−7],因此,越来越多的研究致力于从植物中提取具有生理活性的天然物质,探究这些植物活性成分对胰岛β细胞及其分泌胰岛素功能的影响,从而开发具有基础科学知识支撑的降血糖和治疗糖尿病产品。研究表明,多糖类、黄酮类、萜类、多酚类、生物碱等植物活性成分具有降低血糖、调节胰岛素分泌等改善糖尿病及其并发症的作用,其调控机制也具有多样性。迄今为止,植物活性成分降血糖、改善糖尿病及调控机制类的综述较多,而植物活性成分调控胰岛素分泌机制类的综述较少且不全面,因此,本文对近年来国内外植物活性物质调控胰岛β细胞分泌胰岛素的作用机制进行全面综述,旨为促进胰岛素分泌的天然降血糖产品的研究和开发提供科学理论依据。
1 胰岛素的合成与分泌
胰岛素是由51个氨基酸残基组成的小分子球状蛋白,由A和B两条多肽链组成,两条链通过二硫键连接,在生物体内由胰岛β细胞合成与分泌,用以维持体内正常血糖水平。当胰岛β细胞合成与分泌胰岛素能力受损时,将导致血糖升高,甚至引发糖尿病。
胰岛素的合成是在胰岛β细胞内完成[8]。人的胰岛素基因位于11号染色体短臂上[9],该基因经转录翻译后得到的整个肽链称为前胰岛素原。在胰岛β细胞的粗面型内质网中,前胰岛素原经微粒体酶的作用裂解形成胰岛素原,然后转运至高尔基体,此过程中结合Ca2+和Zn2+,由成笼蛋白包被形成初始胰岛素分泌泡。而后经过分泌泡酸化、蛋白内切酶将胰岛素原酶切为胰岛素和C肽、分泌泡脱去部分蛋白衣壳后,形成成熟胰岛素分泌泡[10]。当胰岛β细胞受到葡萄糖等刺激后,胰岛素分泌泡与细胞膜融合以胞吐的形式释放胰岛素,以维持机体血糖水平的稳定[11]。
2 胰岛素分泌研究模型
目前,主要应用细胞和动物模型来研究天然植物活性成分对胰岛素分泌的调控作用。
细胞模型中所使用的细胞一般包括研究胰岛细胞功能和药物对胰岛细胞毒性作用的人或动物原代胰岛细胞和众多胰岛细胞系。由于原代胰岛细胞存在分离过程严格、易污染,且胰腺来源少、细胞产量低等缺点,因此应用受到一定的限制。国内外利用克隆技术和转基因技术开发了许多新的胰岛细胞系,如大鼠RIN胰岛瘤细胞系INS-1细胞和RINm-5F细胞、βTC细胞系,小鼠MIN胰岛瘤细胞系MIN6细胞、NIT细胞系的NIT-1细胞以及βHC和βTC-tet细胞系,地鼠HIT胰岛素瘤细胞系的HIT-T15细胞等。其中,INS-1细胞和MIN6细胞的应用最为广泛[12]。由于上述胰岛细胞系仍存在各种不足和应用局限性,因此研究者利用基因技术对细胞进行永生化改造以建立理想的细胞模型,如NAKT-15和BRINBD11细胞即能够无限增殖,又能维持胰岛β细胞的正常生理功能[13]。所应用的细胞模型大多采用葡萄糖和棕榈酸诱导成糖毒性及脂毒性,或者两者联用诱导成糖脂毒性。此外还包括用过氧化氢(H2O2)诱导的氧化应激模型、白细胞介素1β(Interleukin-1β,IL-1β)诱导的胰岛细胞线粒体损伤模型以及胰岛淀粉样多肽(Islet Amyloid Polypeptide,IAPP)诱导胰岛素淀粉样多肽纤维沉积而引起的细胞凋亡模型等[12]。
动物模型所运用到的实验动物种类很多[14],如啮齿类的大鼠和小鼠,灵长类的猴,还有猫、狗、猪等。建立糖尿病模型的方法主要包括部分胰腺切除法、化学药物诱导法、食物诱发及催肥法等。在诸多方法中,化学药物诱导法因其操作简单、可行性较高等优点而得到广泛应用。化学药物诱导法中常用药物有链脲佐菌素(Streptozotocin,STZ)和四氧嘧啶(Alloxan,ALX)。此外,很多研究以自发形成糖尿病的大、小鼠作为实验动物[15],如db/db小鼠、ob/ob小鼠、KK小鼠、BB大鼠、Zucker大鼠和GK大鼠等,其中应用最广泛的是db/db小鼠[16]。
除细胞和动物模型外,模式生物秀丽线虫和黑腹果蝇也可用于胰岛素分泌的研究,在食物中加入高糖或高脂,导致线虫和果蝇遭受糖毒性或者脂毒性,从而构建营养过剩导致的糖尿病模型[17−18]。
3 植物活性成分调节胰岛素分泌作用机理
通过整理近年来植物活性成分调节胰岛素分泌的文献,发现许多不同结构类型的天然功能成分,如多糖类(包括糖苷类和蛋白多糖类)、黄酮类、萜类、多酚类、生物碱和甾体类等,均具有调节胰岛素分泌的生理活性。同时研究表明这些植物活性成分能够通过调节离子通道、保护和修复胰岛β细胞、抗凋亡和调节信号通路等方面对胰岛素分泌进行调控。
3.1 调控离子通道
胰岛β细胞分泌胰岛素是一个极其复杂的过程[19],涉及钙离子(Ca2+)通道、钾离子(K+)通道和钠离子(Na+)通道等多种离子通道的参与。目前研究已证实β细胞功能、细胞老化以及分泌胰岛素能力与细胞内Ca2+浓度以及细胞膜的电位紧密相关[20]。Ca2+通道是使Ca2+在生物膜内外流动的蛋白质复合体,细胞内的Ca2+可在内质网的尼克酰胺腺嘌呤二核苷酸磷酸(Nicotinic Acid Adenine Dinucleotide Phosphate,NAADP)受体通道[21]、三磷酸肌醇受体(Inositol 1,4,5-triphosphate Receptor,IP3R)通道[22]和兰诺定受体2(Ryanodine Receptor 2,RYR2)通道[23]的调控下流动,从而调节胰岛β细胞分泌胰岛素。ATP敏感的K+通道(KATP通道)、钙激活的K+通道(KCa通道)和电压依赖性K+通道(KV通道)是参与调控胰岛素分泌的主要K+通道。如图1所示,当葡萄糖等营养物质在体内代谢,使细胞内的ATP含量增加时,会导致β细胞膜去极化,KATP通道关闭,电压依赖性的Ca2+通道打开,细胞内Ca2+浓度升高,促进胰岛素分泌[24];KCa通道是同时受膜电压和Ca2+浓度调节的离子通道,KV通道是受膜电压调节的离子通道,二者在胰岛β细胞膜复极化过程中均起着关键作用[25];这类Ca2+和K+通道,常被作为治疗2型糖尿病的药物的潜在靶点。例如磺脲类降糖药物(格列苯脲和格列吡嗪)选择性阻滞KATP通道,打开KV通道,Ca2+内流,触发胰岛素的释放。此外,Na+通道[26]、Ca2+激活的单价阳离子通道TRPM 5[27]以及连接蛋白36(Connexin36,Cx36)通道[28]等均可调控胰岛素的分泌。
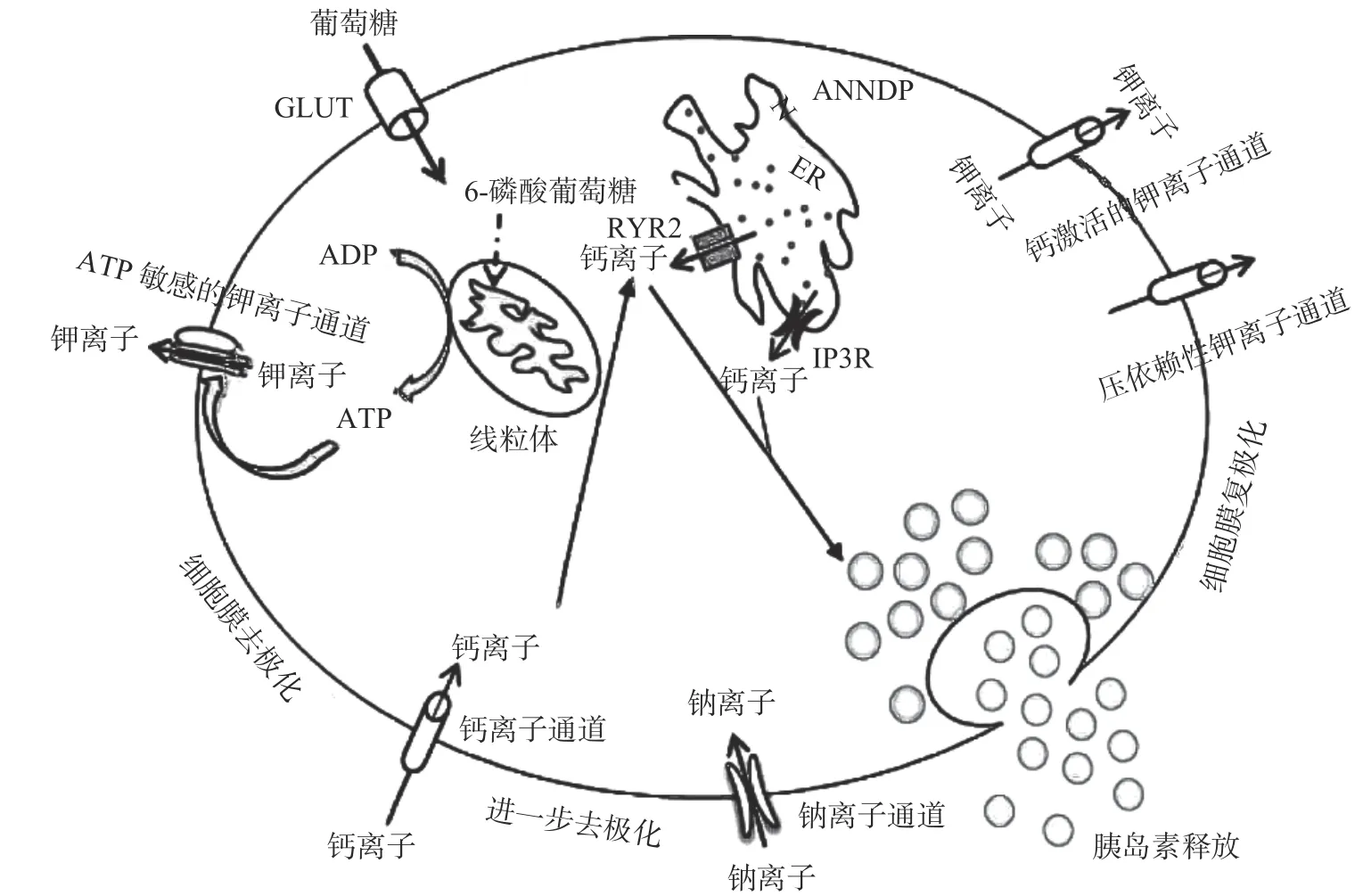
图1 离子通道调控胰岛素分泌[29]Fig.1 Ion channel regulation of insulin secretion[29]
近年来,大量的研究报道植物活性成分具有通过调节离子通道从而促进胰岛素分泌的作用,如表1所示,促进胰岛素分泌的植物活性成分种类很多,大部分活性成分主要通过作用于K+通道来影响细胞内Ca2+的浓度,达到调控胰岛素分泌的作用;也可以直接通过影响Ca2+通道的开放程度和Ca2+通道蛋白的表达量来调控胰岛素的分泌。胰岛β细胞分泌胰岛素的机理非常复杂,天然产物种类多且活性成分复杂,某些含量少的活性成分提取分离难度大,使得使用纯化合物探究调控机理难度较大;此外,除了K+通道和Ca2+通道外,对其他离子通道研究较少,例如目前对Na+通道调控的天然产物只有马齿苋多糖。研究模型主要包括MIN6细胞、INS-1细胞和大、小鼠,虽然在细胞水平和动物水平(鼠科动物)已经阐明了植物活性成分通过调控离子通道促进胰岛素的分泌,但是对人类胰岛β细胞分泌胰岛素的调节作用是否与之一致仍有待探究。因此,进一步对天然产物和离子通道深入探究,更为系统的阐明其调节机制,开发更多具有调控胰岛素分泌作用的天然活性成分,对2型糖尿病的治疗具有非常重要的意义。

表1 通过离子通道调控胰岛素分泌Table 1 Regulation of insulin secretion through ion channels
3.2 保护和修复胰岛β细胞
胰岛β细胞结构和功能的完整是分泌胰岛素的必要前提。研究表明,植物活性成分可以通过缓解氧化应激、抗炎症途径保护和修复胰岛β细胞。
3.2.1 缓解氧化应激 当胰岛细胞内氧化水平与抗氧化水平发生失衡时,会产生过量的自由基,如活性氧(Reactive Oxygen Species, ROS)和活性氮(Reactive Nitrogen Species,RNS),导致细胞处于氧化应激状态,损伤DNA和蛋白质等一些生物大分子,从而严重影响细胞的正常生理功能[39]。细胞内长时间氧化-抗氧化动态失衡,导致其中的抗氧化酶:超氧化物歧化酶(Superoxide Dismutase,SOD)、过氧化氢酶(Catalase,CAT)、谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH-Px)等含量和活性下降。同时,核因子(Nuclear Factor 2,Nrf2)含量也会下降,Nrf2多在细胞质中,受ROS刺激会进入细胞核,与抗氧化元件(Anti-oxidative Response Element,ARE)结合,结合体Nrf2-ARE编码调控抗氧化酶的表达。另外,氧化应激会进一步抑制与胰岛素合成有关的重要转录激活因子的表达,如磷酸肌醇依赖性蛋白激酶l(Phosphoinositide Dependent Protein Kinase-1,PDK-1)、肌腱膜纤维肉瘤癌基因同源物A(Musculoaponeurotic Fibrosarcoma Oncogene Homolog A,Maf A),同时增加核因子κB(Nuclear Factor kappa-B,NF-κB)蛋白、叉形头转录因子O1(Forkhead Box Protein O1,FoxO1)的表达。NF-κB家族的P65蛋白一旦被激活,则NF-κB/P65迅速进入细胞核中,与靶基因结合,所以通过检测细胞核中NF-κB含量和活化程度,可以判断胰腺组织或胰岛细胞的健康状况;FoxO1是穿梭于细胞核内外的转录因子,是Fox基因家族的亚家族Fox O的一个亚族。在肝细胞中,抗氧化剂能抑制胰岛素激活FoxO1,改善胰岛素抵抗[40]。由此可见,氧化应激损伤可影响胰腺β细胞正常胰岛素分泌功能,进而影响机体的代谢。
很多天然活性物质具有缓解细胞氧化应激、保护和修复胰岛细胞的功能,且调控机制具有多样性。如表2所示,所运用到的模型主要是MIN6细胞和INS-1细胞细胞,可能原因是相比于动物实验,细胞实验操作较为简单、实验时间短且效果显著。很多天然产物(如黄酮类、多酚类和多糖类)都具有一定的抗氧化性,能对胰岛细胞起到缓解氧化应激的作用,如葡萄籽多酚[41]、茶多酚[42]、苦瓜多糖[43]、仙人掌多糖[44]、青钱柳多糖[45]和黑果枸杞多糖[46]均能增加抗氧化酶SOD、CAT和GSH-Px活性,起到缓解氧化应激的作用。除了直接作用于抗氧化酶外,还可以作用于多种转录因子的表达,如番石榴酸[47]、金钗石斛多糖[48]和蓝刺头多糖B[49]可以通过提高转录激活因子PDK-1和Maf A的表达,最终促进胰岛素分泌的分泌;姜黄素[50−51]和罗汉果甜苷[52]分别作用于FoxO1的转移和活性调节,壳聚糖硫酸酯[53]、芒柄花黄素[54]和铁皮石斛多糖[55]作用于核因子κB蛋白,实现缓解因氧化应激损伤导致的胰岛素分泌不足的作用。

表2 通过缓解氧化应激调控胰岛分泌Table 2 Regulation of islet secretion by relieving oxidative stress
3.2.2 抗炎症 炎症反应是胰岛β细胞功能受损的重要原因之一[48]。炎症细胞因子,如肿瘤坏死因子α(Tumor Necrosis Factor-α,TNF-α)、IL-1β、白细胞介素6(Interleukin-6,IL-6)和白细胞介素8(Interleukin-8,IL-8)表达增加,会引发炎症反应。用高糖处理原代胰岛细胞后,胰岛细胞中IL-1β表达量增加且分泌至细胞外,通过激活NF-κB,造成胰岛β细胞分泌胰岛素功能障碍[56]。
植物活性成分可降低促炎症因子的表达,保护胰岛β细胞,如当归多糖[57]和榼藤子总皂苷[58]均可以降低TNF-α和IL-6的表达,保护和修复炎症因子侵染的胰岛β细胞;太子参多糖[59]可通过降低TNFα、提高抗炎症因子白细胞介素10(Interleukin-10,IL-10)的水平缓解炎症反应。除直接作用于炎症因子之外,也可以作用于核因子κB蛋白起到抗炎症的作用,如中药大黄提取物大黄酸[60]可以减少db/db小鼠胰腺NF-κB含量,明显抑制胰岛细胞的炎症反应。还可以通过多种途径协同起到保护和修复胰岛β细胞的作用,如南苜蓿总皂苷[61]可以降低糖尿病大鼠胰腺组织中TNF-α、IL-1β和MDA的水平,提高抗氧化酶SOD、GSH-Px的含量,即通过抑制氧化应激和炎症反应,协同保护胰岛β细胞。青钱柳复方制[62](以青钱柳为君药,桑白皮和石斛为臣药,陈皮为佐药)可以下调了NF-κB、STAT、TNF-α、IL-1β、IL-6、Bax基因的表达,显著降低了氧化损伤和炎症水平,减少胰岛细胞凋亡,上调胰岛素合成基因Ins1、Ins2和抗凋亡基因Bcl2的表达,多重机制协同作用增加血清胰岛素水平。
3.3 抗凋亡
胰岛细胞分泌胰岛素含量降低主要有两方面的原因:一方面是细胞自身分泌能力下降,另一方面胰岛细胞发生凋亡,导致分泌总量降低。因此促进细胞的增殖及抑制凋亡,是维持胰岛β细胞正常生理功能的重要环节,同时也是治疗糖尿病的关键控制点。从植物中提取的天然活性物质除了能调节胰岛β细胞分泌胰岛素之外,大都具备抗凋亡能力,其抗细胞凋亡的机制主要包括抑制内质网应激介导的细胞凋亡、抑制凋亡通路等。
3.3.1 抑制内质网应激介导的细胞凋亡 胰岛β细胞的内质网约占整个细胞体积的75%,是合成和加工胰岛素等蛋白质的重要场所,长时间内质网应激将会导致内质网启动凋亡信号通路,因此内质网应激是造成胰岛β细胞损伤和凋亡的重要因素之一。缓解内质网氧化应激可以改善胰岛信号的转导,从而有效抑制胰岛β细胞凋亡。
D-柠檬烯[63]和小檗碱[64]可以通过缓解内质网氧化应激来实现对胰岛β细胞的保护作用;灵芝蛋白多糖[65]通过诱导IAPP的结构转变,以及通过JNK/CHOP途径抑制IAPP引起的内质网应激导致的凋亡;牛樟丸[66]通过过氧化物酶体增殖物激活受体-γ(Peroxisome Proliferators-Activated Receptor-γ,PPAR-γ)通路修复内质网应激导致的凋亡。
3.3.2 抑制细胞凋亡通路 细胞凋亡是细胞自主的有序的死亡,其过程由多基因严格控制,如Bcl-2家族和Caspase家族等[67−69]。B淋巴细胞瘤-2(B-cell Lymphoma-2,Bcl-2)属于原癌基因,Bcl-2蛋白可通过维持线粒体跨膜电位,抑制凋亡过程中线粒体途径细胞色素C的释放过程,最终抑制细胞凋亡的发生。因此Bcl-2表达量的增加可抑制细胞凋亡。半胱氨酸蛋白酶3(Caspase-3)是细胞凋亡过程中发挥重要功能的凋亡执行蛋白之一,其表达量的增加可促进细胞凋亡。当受到凋亡信号刺激时,Bax从细胞质中迁移至线粒体外膜,介导下游凋亡分子的释放,其表达量的增加也可促进细胞凋亡的发生。
大量研究表明天然活性物质可以通过抑制细胞凋亡通路来实现促胰岛素分泌的作用,如黄精多糖[70]能下调Caspase-3的表达,降低STZ诱导的糖尿病大鼠血清糖化血红蛋白含量,改善胰岛细胞形态,增加胰岛素分泌;枸杞多糖[71−72]和芒果苷[73]通过促进Bcl-2的表达,抑制Bax的表达,使得直接导致细胞凋亡的Caspase-3含量减少,以降低高糖糖诱导和H2O2诱导的INS-1细胞凋亡;牡荆素[74]、丹酚酸B[75]、马里苷[76]均能上调Bcl-2的表达量以抑制细胞凋亡。
3.3.3 其他抗凋亡机制 植物活性成分除了抑制内质网应激介导的细胞凋亡和抑制细胞凋亡通路外,还有其他抗凋亡机制。如从西洋参中提取合成的人参皂苷CK[77]能抑制腺苷酸活化蛋白激酶-氨基末端激酶(AMPK-JNK)-线粒体凋亡途径;杨桃根提取物DMDD[78]通过TLR4/My D88/NF-κB信号通路抑制胰岛细胞的凋亡;玉米水溶性多糖[79]可能通过修复胰岛β细胞的免疫损伤,抑制细胞凋亡和促进受损细胞再生,从而增加胰岛素水平。
目前植物活性物质抗胰岛细胞凋亡信号通路研究还不够具体,一方面由于凋亡信号通路错综复杂,难以明确是作用某种信号物质还是同时作用多种通路多种信号物质,如桑叶多糖[80]可以显著提高PDX-1的表达量,促进Ca2+内流,进而提高胰岛素的合成和分泌;可以明显提高高糖培养INS-1细胞线粒体膜电位,减少细胞色素C(Cyt-C)在胞浆中的表达,抑制细胞凋亡;可以有效降低高糖培养INS-1细胞和细胞线粒体中MDA含量,提高抗氧化酶SOD、CAT和GSH-Px的活性,改善细胞形态,同时可有效降低糖尿病大鼠血浆和胰腺、肝脏及肌肉三个组织中MDA含量,减轻脏器组织形态的损伤,促进胰岛素分泌;另一方面活性物质本身作用靶点未知,导致目前植物活性物质抗凋亡作用的机制仍需进一步深入研究。
3.4 调节信号通路
3.4.1 PI3K/Akt信号通路 当细胞表面受体受到胞外信号刺激时会被激活,同时磷脂酰肌醇3-激酶(Phosphatidylinositol-3-Kinase,PI3K)磷酸化而激活,活化后的PI3K磷酸化细胞膜上的脂质,形成第二信使磷脂酰肌醇(3,4,5)-三磷酸(PIP3)。Akt是PI3K信号下游的靶蛋白,能通过与磷酸肌醇发生相互作用移动到细胞膜上,被磷酸化激活后通过活化下游因子引发一系列生物学反应,包括细胞生长、增殖、迁移和凋亡等,称为PI3K-Akt信号通路[81−82]。Akt磷酸化后能够使转录因子Fox O1磷酸化,促进其从细胞核转移至细胞质中,使得胰岛素合成的关键转录因子PDK-1进入细胞核,转录胰岛素合成相关基因[83−84]。此外,Akt还可以调控胰岛素囊泡胞吐相关的SNARE(Syntaxin-1、SNAP25、VAMP2)蛋白的表达[85]。
研究表明抑制Akt磷酸化后β细胞分泌胰岛素明显减少[86],虫草素[87]能促进胰腺INS-1E细胞Akt的磷酸化,促进胰岛素的分泌和合成;白藜芦醇[88−89]可以调节高脂膳食诱导的C57BL/6J小鼠过高的基础胰岛素水平,深入研究其机理发现,白藜芦醇可能通过激活PDK-1、PI3K-Akt通路增加胰岛素分泌,增强高糖诱导的细胞活性并抗细胞凋亡;黄芪黄酮与葛根黄酮配伍[90]能协同缓解胰腺脂毒性及炎症反应、调控PI3K/Akt信号通路增加模型大鼠胰岛素分泌;铁皮石斛[91]提取液和柚皮素[92]均能通过PI3K/Akt信号通路提高糖尿病大小鼠的胰岛素分泌水平,改善胰岛素抵抗。青钱柳双瓜袋泡茶[93]可有效缓解2型糖尿病大鼠的氧化损伤,能上调IRS2、PI3K、p85、Akt2、AMPK mRNA表达水平和上调IRS2、PI3K、p85、p-Akt、Akt、AMPKα蛋白表达量,因此可能通过激活PI3K/Akt信号通路起到降脂降糖作用,使金钱柳有望成为治疗2型糖尿病的天然产物和潜在治剂。
3.4.2 cAMP-PKA信号通路 环磷酸腺苷cAMP是一种环状核苷酸,需要依赖蛋白激酶A(Protein Kinase A,PKA)及其下游靶点蛋白磷酸化才能发挥生理作用。cAMP/PKA信号途径是指细胞外信号与相对应受体结合后,通过调节胞内第二信使cAMP的水平而引起一系列反应的信号通路,从而影响细胞代谢和细胞行为。
已有研究证实cAMP-PKA信号通路的激活可以刺激胰岛β细胞分泌胰岛素[94]。珍珠花中提取物圣草酚[95]可以通过调控cAMP/PKA信号途径促进胰岛素分泌,提高葡萄糖耐受能力;植物活性成分绿茶多糖[96]可以上调PKA、PDX-1的转录,通过cAMPPKA通路刺激胰岛素的分泌,从而降低血糖水平。
3.4.3 MAPK信号通路 丝裂原活化蛋白激酶(Mitogen-Activated Protein Kinase,MAPK)可将信号从细胞表面传递到细胞核内部,参与细胞增殖、分化和凋亡等生理活动,它主要包括细胞外调节蛋白激酶1/2(Extracellular Regulated Protein Kinases, ERK 1/2)、p38、ERK 5以及Jun氨基末端激酶(Jun N-terminal Kinase,JNK)4个亚族[97]。
干栀子花提取物京平尼苷[98−99]通过激活胰高血糖素样肽-1受体(Glucagon-Like Peptide 1 Receptor,GLP-1R)和AMPK信号通路促进胰岛素分泌和抗凋亡;桑葚多糖[100]通过下调Caspase-3蛋白、p-JNK和p-p38的表达,抑制胰岛细胞的凋亡,降低STZ诱导糖尿病小鼠的空腹血糖水平,提高胰岛素水平。青钱柳提取物[101]可以显著降低STZ诱导的糖尿病小鼠的体重、摄食量和血糖水平,增加胰岛素水平和胰岛素β细胞的数量,并且体内和体外试验均表明,其促胰岛素分泌机制是通过抑制caspase-3的表达以及下调Bax/Bcl-2比例、p38、ERK和JNK的磷酸化,促进Akt磷酸化,即通过影响MAPK和Akt信号通路,实现对胰岛细胞的保护作用和胰岛素的正常分泌,从而降低血糖。
3.4.4 其他信号通路 研究植物活性成分调节胰岛素分泌的信号通路,除了PI3K/Akt信号通路、cAMPPKA信号通路和MAPK信号通路之外,还有G蛋白偶联受体(G Protein Coupled Receptor,GPCR)信号通路[102]、胰高血糖素-胰高血糖素样肽(Glucagon-GLP-1)信号通路[103−104]、糖皮质激素通路[105]、ADP核糖基化因6-细胞分裂控制蛋白42-Rac1蛋白(Arf6-Cdc42-Rac1)信号通路[106]、环磷酸鸟苷-蛋白激酶G(cGMP-PKG)信号通路[107]等。
4 展望
糖尿病患者人数激增、低龄化以及所引起的并发症已引起全社会高度关注。到目前为止,大量研究利用细胞模型和动物模型,证实从植物性食材和药材中提取的活性成分具有调节胰岛素分泌的作用。这些活性成分主要通过调控离子通道、保护和修复胰岛β细胞、抗凋亡和调控信号通路来实现对胰岛素分泌的调节。植物活性成分由于其具有的独特分子结构和官能团,通过与多种胰岛素分泌相关的内源性生物分子结合,抑制或激活相关酶、受体、信号分子及转录因子等,从而参与了胰岛β细胞增殖、衰老、凋亡或分泌胰岛素信号通路。此外因为有许多不同的生物靶标,可引发多效性[108],相比单一合成药物作用于某一个特定的酶或者信号分子,植物活性成分的调控更加安全、多效。但活性物质调节胰岛素分泌的功能和其他生理功能之间的作用联系尚未阐明,同时植物活性成分功能多样,相互之间的协同和拮抗关系需要进一步研究。阐明植物活性成分调节胰岛素分泌机理,对开发更为健康有效的包含多种活性成分的产品或膳食配方,以及降血糖食品药品的开发和糖尿病治疗都具有一定的意义。

