特纳草黄酮超声强化提取工艺的响应面法优化及其抗氧化性
谭春远,阎 杰 ,黄惠敏,周志坚,邬子君
(1.仲恺农业工程学院轻工食品学院,广东广州 510225;2.仲恺农业工程学院化学化工学院,广东广州 510225)
特纳草(Damiana),又称达迷草、达米阿那,是墨西哥和中南美洲特有的一种唇形科特纳草属多年生草本植物,主要分布于巴西东北部、中美洲、加勒比海地区、墨西哥和德克萨斯州干旱和半干旱地区[1,2]。特纳草在国外因壮阳作用而闻名,具有较高的经济效益,可用于治疗阳痿、痛经、激素失衡、性病、抑郁症、痢疾、食欲不振、消化不良等,是很多重要药品和保健品的原料[2−7]。
黄酮是特纳草中重要的有效成分,Zhao等[8]和Johanna等[9]分别从特纳草中分离鉴定出19种和3种黄酮成分,Piacente等[10]从墨西哥采摘的特纳草中分离出6种黄酮成分。综合分析国外文献,已鉴定结构的特纳草黄酮按母核结构主要分成五类:黄烷酮、柚皮素、芹菜素及其衍生物、木犀草素和苜蓿素衍生物、槲皮素和杨梅素衍生物[5,8−15]。黄酮可通过溶剂萃取、超临界流体萃取、微波提取、超声提取等方法提取[16−19]。对于特纳草黄酮的提取,目前文献报道主要采用溶剂萃取法,也有采用超声强化法[7,9−10]。Piacente等[10]和Kumar等[7]分别用沸水和甲醇从墨西哥和印度种植的特纳草中提取出黄酮。常规溶剂提取时间较长,而超声作用能促使细胞壁、细胞膜破裂,利于有效成分溶出和扩散,提高效率,缩短时间[20,21]。Johanna等[9]以70%丙酮为溶剂,采用了超声强化提取特纳草黄酮成分,效率高,用时短。
特纳草提取物具有明显的抗氧化作用。Torres-González等[22]研究发现特纳草醇-水提取物具有明显的清除DPPH自由基作用,提取物浓度为1.0 mg/mL时,清除率达82.47%。Salazar等[23]试验表明,特纳草甲醇提取物能清除DPPH自由基,还能抑制黄嘌呤氧化酶的活性。Jonathan[24]的研究显示特纳草提取物具有明显的抗氧化作用,且起作用的主要成分为黄酮类化合物——木犀草素。
近年来,我国云南开展了特纳草的引种种植,由于时间短,尚没有开展有效成分提取及相关性质的研究。基于此,本论文以我国引种的特纳草为原料,进行超声强化黄酮的提取,通过试验考察超声时间、温度、超声功率、料液比、乙醇体积分数等对黄酮提取率的影响,结合响应面法进行优化,并通过清除DPPH自由基、ABTS自由基及还原力试验考察黄酮的抗氧化能力,以期为我国特纳草的开发利用提供参考。
1 材料与方法
1.1 材料与仪器
特纳草 云南红河谷辣木产业有限公司;芦丁(99%) 上海麦克林生化科技有限公司;1,1-二苯基-2-苦苯肼自由基(DPPH·)、22’-二氮-双-3-乙基苯并噻唑啉-6-磺酸阳离子自由基(ABTS+·) 南京都莱生物技术有限公司;过硫酸钾、醋酸钠 福晨(天津)化学试剂有限公司;醋酸 天津市富宇精细化工有限公司;硝酸铝、亚硝酸钠 天津市永大化学试剂有限公司;氢氧化钠、无水乙醇 天津市百世化工有限公司;自制去离子水;所有测试用试剂 均为分析纯。
DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限公司;UV-1800紫外可见吸收光谱仪日本岛津公司;800Y高速多功能粉碎机 武义海纳电器有限公司;SHZ-D(Ⅲ)循环水式真空泵 巩义市予华仪器有限公司;DHG-9030A鼓风干燥箱上海一恒科学仪器有限公司;BILON-1000D超声波信号发生器 上海比朗仪器有限公司。
1.2 试验方法
1.2.1 特纳草黄酮的提取工艺流程60℃烘至恒重→粉碎→过50目筛→加入溶剂→超声提取→定容→过滤(滤液作为提取液)。
1.2.2 超声提取试验
1.2.2.1 超声时间对黄酮提取率的影响 以60%乙醇,料液比1:60(g/mL),超声功率240 W,超声温度55℃为固定条件,考察超声时间为10、20、30、40、60 min时对特纳草黄酮提取率的影响。
1.2.2.2 超声温度对黄酮提取率的影响 以60%乙醇,料液比1:60(g/mL),超声功率240 W,超声时间30 min为固定条件,考察超声温度为30、40、55、65、75、85℃时对特纳草黄酮提取率的影响。
1.2.2.3 超声功率对黄酮提取率的影响 以60%乙醇,料液比1:60(g/mL),超声时间30 min,超声温度55℃为固定条件,考察超声功率为0、160、240、320、400 W时对特纳草黄酮提取率的影响。
1.2.2.4 料液比对黄酮提取率的影响 以60%乙醇,超声功率240 W,超声时间30 min,超声温度55℃为固定条件,考察料液比为1:20、1:40、1:60、1:80、1:100 g/mL时对特纳草黄酮提取率的影响。
1.2.2.5 乙醇体积分数对黄酮提取率的影响 以料液比1:60(g/mL),超声功率240 W,超声时间30 min,超声温度55℃为固定条件,考察乙醇体积分数为0%、20%、40%、60%、80%、90%、无水乙醇时对特纳草黄酮提取率的影响。
1.2.3 响应面试验设计 根据上述试验结果,使用Design-Expert.V8.0.6.1软件,以黄酮提取率为响应值,超声时间、超声功率、超声温度和乙醇体积为响应变量,设计4因素3水平的响应面分析试验,根据结果确定特纳草黄酮的最佳提取条件。试验因素及水平如表1所示。

表1 响应面试验因素与水平设计Table 1 Response surface test factors and level design
1.2.4 黄酮提取率的测定
1.2.4.1 标准曲线的制作 按文献方法[25]进行操作。以芦丁为标准品,采用氯化铝-甲醇法测400 nm波长处的吸光度,以质量浓度对吸光度绘制标准曲线。在0.005~0.050 mg/mL浓度范围内得回归方程为:y=21.0589x−0.00518,R2=0.99969。
1.2.4.2 黄酮提取率的测定 准确吸取适量提取液于10 mL比色管中,摇匀得样品液,其余操作与上述标准曲线的制作相同,测定样品液中黄酮含量,并计算黄酮提取率。

式中,m1和m2分别表示提取液中黄酮的质量和原料(干基)中黄酮的质量(g)。
1.2.5 抗氧化性试验
1.2.5.1 清除DPPH自由基试验 参照陈丛瑾等[26]方法稍作修改,对1.2.1的黄酮粗提液进行浓缩,用去离子水稀释浓缩液制成0.005、0.01、0.015、0.03、0.1 mg/mL 5个不同浓度样品液,取0.5 mL样品液于10 mL比色管中,加入4.5 mL 0.1 mmol/L DPPH无水乙醇溶液充分混匀,室温下反应30 min,于519 nm处测定吸光值A0,同时测定0.5 mL样品液与4.5 mL无水乙醇混合后的吸光值Aj和空白样品吸光值Ac。
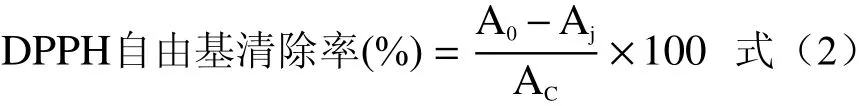
1.2.5.2 清除ABTS自由基试验 参照李培源等[27]方法稍作修改,称取一定量ABTS溶解于20 mmol/L、pH4.5的醋酸-醋酸钠缓冲溶液中,振荡溶解配制成7 mmol/L的ABTS储备液;称取一定量的过硫酸钾溶解于去离子水中,配制成2.45 mmol/L过硫酸钾溶液,取体积比为1:1的ABTS储备液和过硫酸钾溶液混合摇匀,在黑暗处氧化12 h,稀释30倍得到ABTS自由基工作液。设置5个样品浓度,分别为0.005、0.01、0.015、0.05、0.1 mg/mL,取1 mL不同浓度的样品液与4 mL工作液于25 mL比色管中,充分混合后在黑暗处反应30 min,在734 nm处测吸光值,记为A′0,再取1 mL样品液与4 mL无水乙醇充分混合后测量吸光值,记为A′j, 空白样品吸光值为A′c。
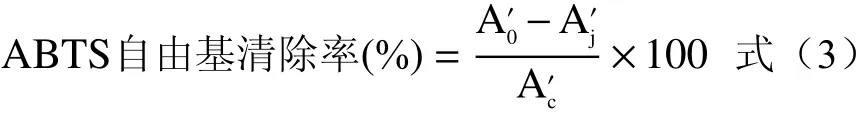
1.2.5.3 还原力试验 参考文献[28],分别移取0.01、0.02、0.03、0.0785、0.157 mg/mL 5个不同浓度的样品溶液1.5 mL于离心管中,加入0.2 moL/L磷酸盐缓冲液(pH6.6)1.5 mL和1%铁氰化钾溶液1.5 mL,将混合物于50℃水浴保温20 min,加入1.5 mL 10%(w/v)三氯乙酸溶液,混合溶液3000 r/min离心10 min,精密吸取上清液2.00 mL,加入7.5 mL蒸馏水和0.5 mL 1%的三氯化铁溶液,在700 nm处测吸光度(吸光度值越大,还原力越强)。
1.3 数据处理
所有试验重复3次,采用Origin2017和Design-Expert.V 8.0.6.1软件对试验数据进行作图和分析。
2 结果与分析
2.1 单因素实验结果
2.1.1 超声时间对提取率的影响 由图1可知,随着提取时间的延长,黄酮提取率先升高后趋于稳定,体现了提取量随时间延长的累积效应[29],在提取时间为40 min时基本趋于平稳,可能是随着时间的增加,粘液等物质溶出,溶液中杂质的含量增加,降低了黄酮类物质在溶剂中的扩散速度,影响黄酮的提取率[30]。选择40 min左右比较适宜。

图1 超声时间对黄酮提取率的影响Fig.1 Effect of ultrasound time on the extraction rate of flavonoids
2.1.2 超声温度对提取率的影响 由图2可知,随超声温度的升高,特纳草黄酮的提取率先升高后下降,在65℃时提取率达到最大,当超声温度超过65℃时,含量下降。从理论上讲,升高超声温度,分子的运动速率加快,提取液黏度降低,利于黄酮的溶解与溶出,提取率增加[31]。但当超声温度继续升高,溶剂挥发加剧,有效溶剂量降低,溶剂与特纳草接触面积减少,降低了扩散速率,使得提取率降低;此外,在高温条件下,杂质更容易溶出,对后续分离不利,同时也增加了能耗[32]。综合各因素考虑,适宜的超声温度为65℃。

图2 超声温度对黄酮提取率的影响Fig.2 Effect of ultrasonic temperature on the extraction rate of flavonoids
2.1.3 超声功率对提取率的影响 由图3可知,随超声功率的加大,特纳草黄酮的提取率先升高后下降,在320 W时提取率达到最大。由于超声波在溶液中传播时,具有空化效应,能破坏细胞壁和细胞膜,使存在于细胞内的物质更容易溶出,超声功率越大,空化越剧烈,细胞破坏越充分,黄酮越易溶出,提取率越大[33]。但超声功率过大,会产生大量无用的气泡,形成声屏障,阻碍声传播,对提取反而不利[34]。本试验较佳的超声功率为320 W。

图3 超声功率对黄酮提取率的影响Fig.3 Effect of ultrasonic power on the extraction rate of flavonoids
2.1.4 料液比对提取率的影响 由图4可知,随着溶剂用量的增大,黄酮的提取率大体呈上升趋势,但料液比从1:40 g/mL增加到1:100 g/mL之间,提取率增加的幅度较小,提取率增加小于2%。随着料液比的增加,溶剂用量大,会大幅提高提取液中溶剂回收的成本。因此,适宜的料液比为1:40 g/mL。
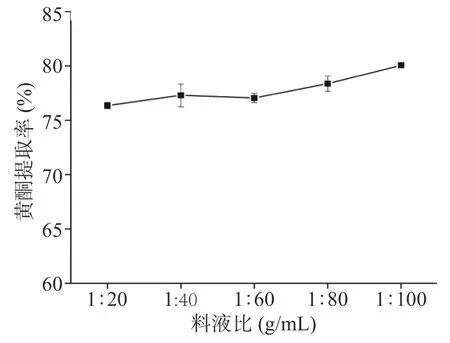
图4 料液比对黄酮提取率的影响Fig.4 Effect of material-liquid ratio on the extraction rateof flavonoids
2.1.5 乙醇体积分数对提取率的影响 由图5可知,随着乙醇体积分数的提高,特纳草黄酮提取率逐渐增大。当乙醇体积分数达到80%时,黄酮的提取率最大。超过80%时,溶剂极性降低,根据相似相溶原理,亲水性强的黄酮溶出减少,反而醇溶性的杂质溶出增多,降低了黄酮的提取率[32]。所以,乙醇体积分数80%左右比较适宜。
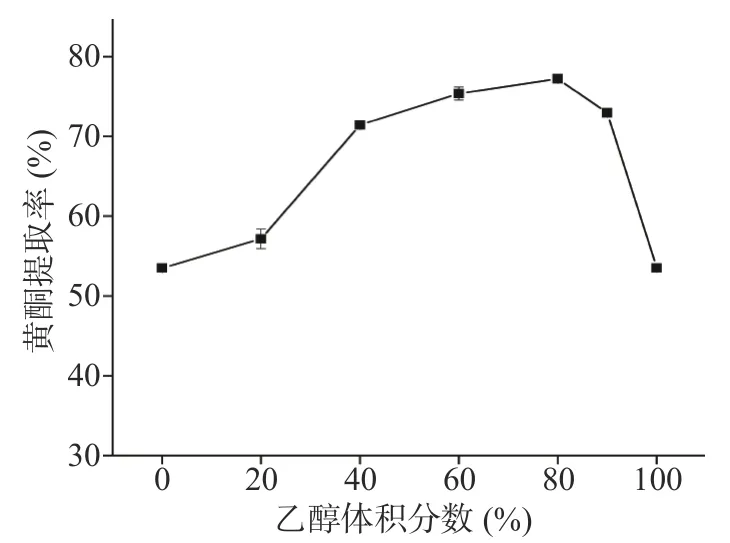
图5 乙醇体积分数对黄酮提取率的影响Fig.5 Effect of ethanol volume fraction on the extraction rate of flavonoids
2.2 响应面法优化提取工艺
前述试验结果表明,料液比对特纳草黄酮提取率的影响较小,为简化试验,减少试验次数,选择超声时间、超声功率、超声温度和乙醇体积为响应设计变量,设置4因素3水平响应面分析试验共有29个试验点,其中5个中心点,24个析因点,设计方案及结果见表2。
2.2.1 模型的建立及其显著性检验 利用Design-Expert.V 8.0.6.1对表2的试验结果进行响应面分析法分析,以黄酮提取率为响应值,对超声时间(A)、超声功率(B)、超声温度(C)、乙醇体积分数(D)经回归拟合后,得到的回归方程为:

表2 试验设计方案及结果Table 2 Experimental design scheme and results

根据回归方程方差分析及相关系数来考察模型的可靠性。由表3可知,二次回归模型的F值为29.74,P值<0.0001,失拟项P=0.6710>0.1000,表示试验结果和数学模型拟合良好。试验模型的决定系数R2=0.9675,说明该回归方程能很好地描述各因素与响应值之间的真实关系,可以用其确定最佳提取工艺条件,试验结果与模型预测结果有着良好的一致性。试验模型的校正系数Radj2=0.9349,试验结果有93.49%受试验因素的影响。因此,结果可靠,该数学模型可用于推测特纳草黄酮提取量试验结果。4个因素对黄酮提取量的影响顺序为:超声温度>超声功率>超声时间>乙醇体积分数。一次项A、B、C、D,交互项AB、AC及二次项A2、B2、C2、D2对试验指标有极显著的影响(P<0.01),交互项AD、CD对试验有显著的影响(P<0.05),其余项不显著。
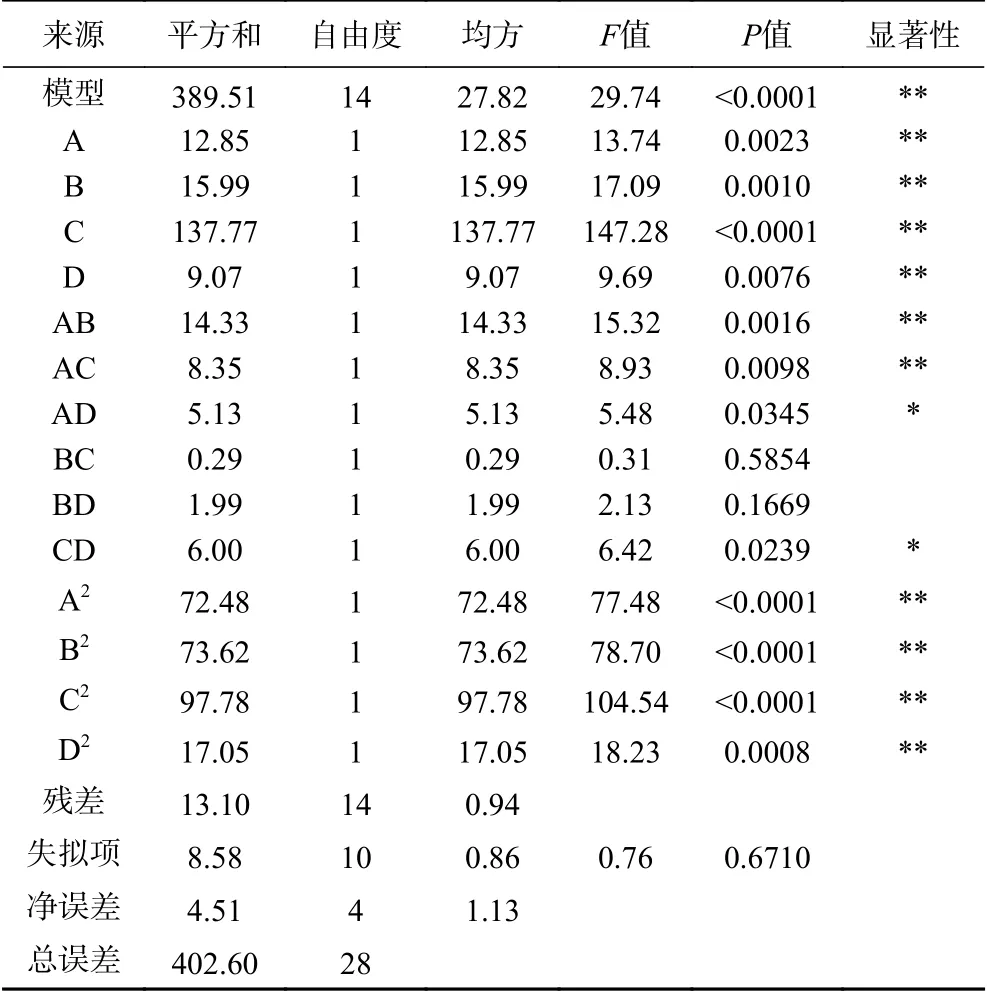
表3 回归方程各项的方差分析Table 3 Analysis of variance of the regression equation
2.2.2 响应面交互作用分析及最优条件验证 利用Box-Behnken分析各因素交互作用,拟合出响应面立体图,更直观描述各因素之间的交互作用对特纳草黄酮提取率的影响,结果如图6~图11所示。
由图6~图11可知,超声温度对特纳草黄酮提取效果的影响最为显著。在交互项对提取率的影响中,超声时间与超声功率、超声时间与超声温度之间交互作用明显,表现为曲线较陡,响应值变化较大;超声时间和乙醇体积分数、超声温度和乙醇体积分数之间的交互作用对响应值的影响较小,曲线较为平滑,对响应值变化较小。
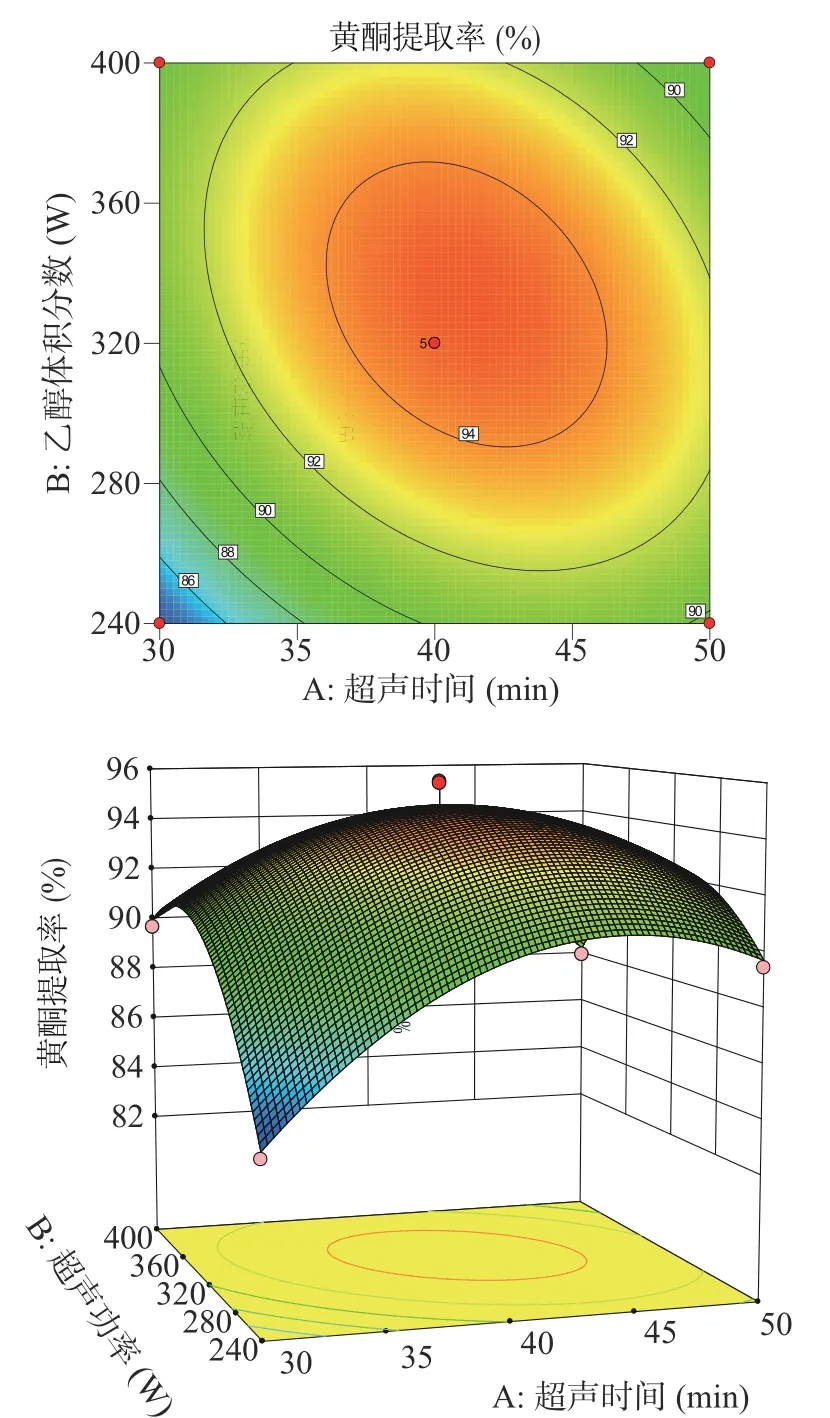
图6 超声功率和超声时间对特纳草黄酮提取率的影响Fig.6 Effect of ultrasonic power and ultrasonic time on the extraction rate of damiana flavonoids

图11 超声温度和乙醇体积分数对特纳草黄酮提取率的影响Fig.11 Effect of ultrasonic temperature and ethanol volume fraction on the extraction rate of damiana flavonoids
由响应面分析建立的数学模型可知,预测黄酮提取最佳工艺条件为超声时间42.26 min、超声温度69.55℃、超声功率324.8 W、乙醇体积分数81.75%,考虑实际操作方便,调整最佳工艺条件为超声时间42 min、超声温度70℃、超声功率320 W、乙醇体积分数82%,在此工艺条件下,特纳草黄酮提取率为94.4%±2.37%,与模型预测值95.68%之间的标准差为0.9051,模型能较好预测特纳草中黄酮提取率,优化工艺条件真实可靠。
2.3 特纳草黄酮抗氧化试验
2.3.1 清除DPPH自由基效果 黄酮类物质可以提供质子与DPPH自由基结合而形成一种稳定的抗磁性分子,降低DPPH自由基的含量[25,35]。由图12可知,随着黄酮提取液浓度的增加,DPPH自由基的清除率也在增加,黄酮提取液对DPPH自由基清除作用的IC50值为0.0283 mg/mL,而VC为0.0070 mg/mL。由此可知,特纳草黄酮提取液对DPPH自由基的清除能力弱于VC。

图7 超声时间和超声温度对特纳草黄酮提取率的影响Fig.7 Effect of ultrasonic time and temperatureon the extraction rate of damiana flavonoids
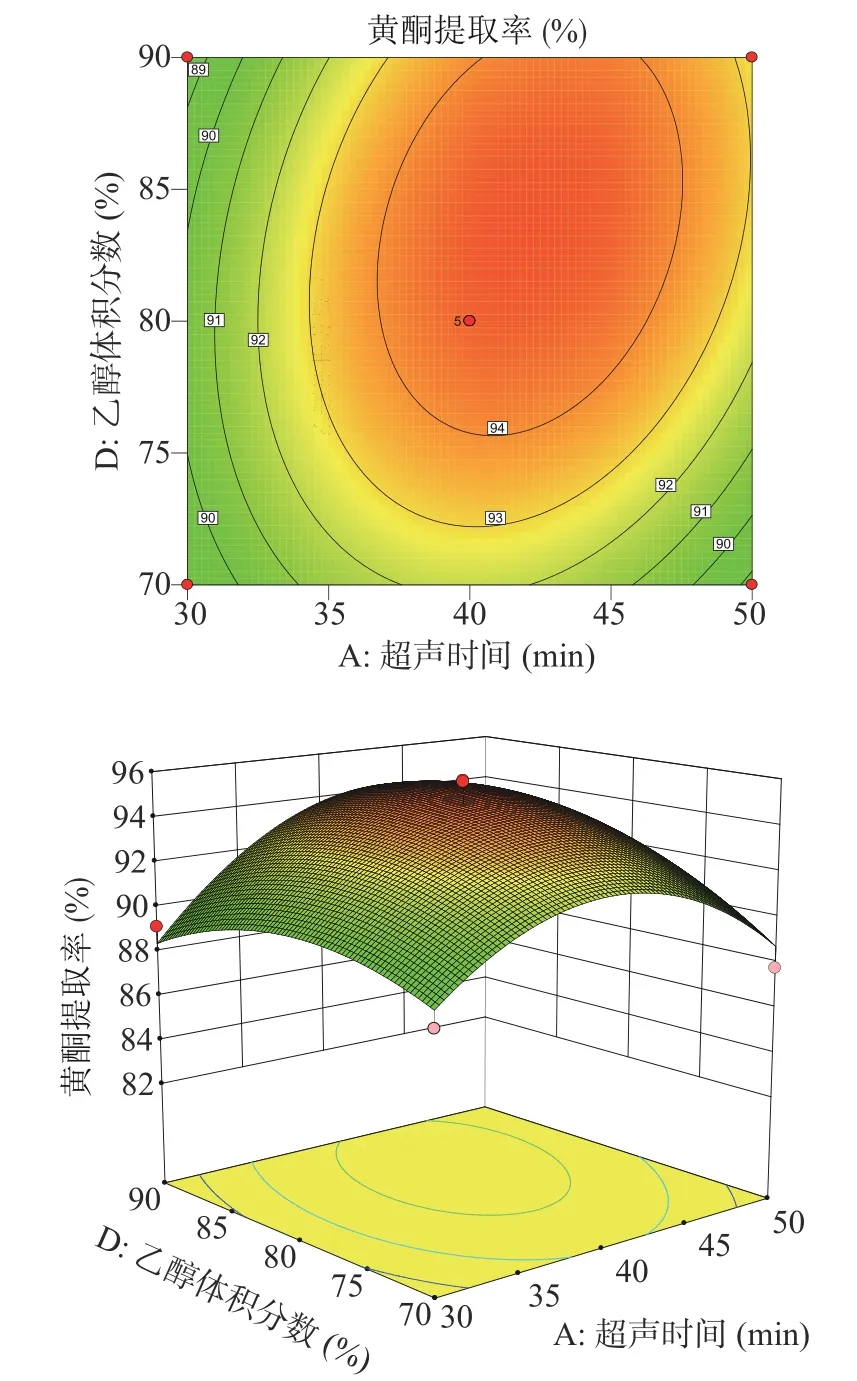
图8 超声时间和乙醇体积分数对特纳草黄酮提取率的影响Fig.8 Effect of ultrasound time and ethanol volume fraction on the extraction rate of damiana flavonoids
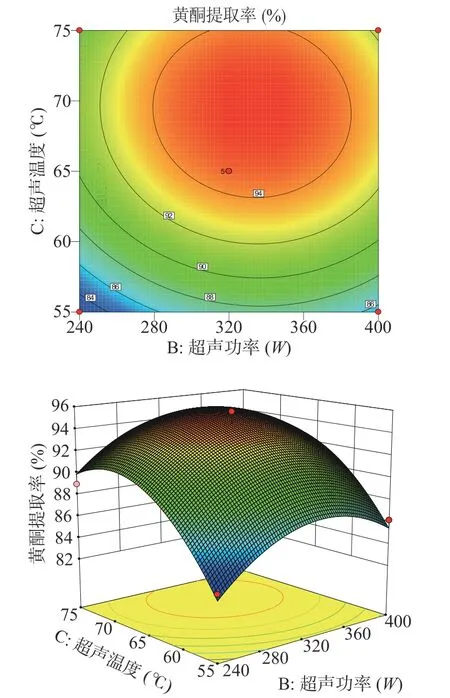
图9 超声功率和超声温度对特纳草黄酮提取率的影响Fig.9 Effect of ultrasonic power and temperature on the extraction rate of damiana flavonoids

图10 超声功率和乙醇体积分数对特纳草黄酮提取率的影响Fig.10 Effect of ultrasonic power and ethanol volume fraction on the extraction rate of damiana flavonoids

图12 特纳草黄酮提取液对DPPH自由基的清除效果Fig.12 Scavenging effect of damiana flavonoids extract on DPPH free radicals
2.3.2 清除ABTS自由基效果 由图13可知,样品液中黄酮含量与对ABTS自由基的清除能力正相关。特纳草黄酮提取液对ABTS自由基清除作用的IC50值为0.0272 mg/mL,说明其对水溶性自由基有良好的清除作用;而VC的IC50值为0.0065 mg/mL,说明特纳草黄酮提取物有一定的清除ABTS自由基的能力,但是效果较VC弱。
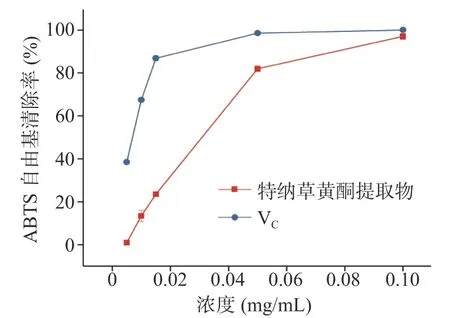
图13 特纳草黄酮提取液对ABTS自由基的清除效果Fig.13 Scavenging effect of damiana flavonoids extract on ABTSfreeradicals
2.3.3 还原力测定 特纳草黄酮提取物的还原力变化如图14所示,随着提取液黄酮浓度的增加,吸光值呈线性增加,吸光度值越大,还原力越强。当浓度小于0.09 mg/mL时,特纳草黄酮的还原力与VC基本相同,当浓度大于0.09 mg/mL时,特纳草黄酮的还原力比相同浓度的VC强,浓度越大还原力差异越明显,表明特纳草黄酮具有较高的抗氧化性。

图14 特纳草黄酮提取液的还原力Fig.14 Reducing power of damiana flavonoid extract
3 结论
在单因素实验基础上,使用Design-Expert 8.0软件对乙醇体积分数、超声时间、超声温度和液料比进行中心组合实验设计和数据拟合,得到模型的决定系数R2=0.9675,说明试验结果与模型预测结果有着良好的一致性;各因素对黄酮提取率的影响顺序为:超声温度>超声功率>超声时间>乙醇体积分数;最佳提取工艺条件为超声时间42 min、超声温度70℃、超声功率320 W、乙醇体积分数82%,在此工艺条件下,特纳草黄酮提取率为94.4%。特纳草黄酮的抗氧化试验结果表明,特纳草黄酮具有较强的清除DPPH自由基和ABTS自由基能力以及还原力,是良好的天然抗氧化剂。试验表明特纳草黄酮具有抗氧化作用,但本文所用原料是特纳草的黄酮粗提液,杂质较多,黄酮可能不是其唯一抗氧化作用的物质,还需进一步纯化、结构鉴定,用得到的纯化产物进行抗氧化试验等研究。

