拟南芥转录因子AtOFP19功能的初步研究
韩佳良,王鹤萌,张冬瑞,常 缨
(东北农业大学 生命科学学院,黑龙江 哈尔滨 150036)
转录因子(Transcription factors)是一种具有特殊结构的蛋白质,通过与其他蛋白质复合物的特定序列或DNA的特定序列结合来调控基因的表达[1],也称作反式作用因子。植物中的转录因子分为2种,一种是非特异型转录因子,它们非选择性地调控基因的转录表达,还有一种称为特异型转录因子,它们能够选择性调控某种或某些基因的转录表达。
通过对番茄的一系列遗传研究发现,番茄的果实形状是由一个单隐性数量性状位点(QTL)控制的[2]。这个基因位点可以控制番茄的果实形状由圆形变成梨形[3],该位点被命名为梨形(pr)位点。后来发现pr与控制果实由扁圆形变为椭圆形的位点是等位的,因此又将该位点命名为卵形(o)位点[4]。2002年,Liu等[2]对该位点进行了测序和精细的定位分析,将卵形基因缩小到一个包含8个开放阅读框(ORFs)的55 kb片段中。对基因编码的蛋白质氨基酸序列进行分析,发现蛋白的羧基端有一个70 aa的结构域,被称为OVATE结构域,含有该结构域的蛋白质被指定为OVATE家族蛋白,也叫作卵形家族蛋白(OFPs),这个结构域在水稻和拟南芥中都是保守的。OVATE蛋白包含2个结构域,一个是假定的核定位信号(NLS),另一个是Von Willebrand类型C因子 (VWFC)结构域,这两个结构域是蛋白质与蛋白质相互作用所必需的。通过这些特征将OVATE蛋白与之前所确定的植物转录因子区分开[2]。
迄今为止,OFPs主要在拟南芥中表现出来,AtOFPs是一类新型的,植物特有的转录因子,并被证明与植物的生长发育相关[5]。现有研究表明,AtOFP1会导致植物的地上器官包括下胚轴、莲座叶、茎生叶的长度均有所减少[6];AtOFP4会抑制表皮细胞伸长[7]。2011年,Wang等[8]发现在拟南芥中有18个基因被预测编码卵形蛋白。但在2014年Liu等[9]发现2个以前未发现的AtOFP,At2g36026(命名为AtOFP19)和At1g06923(命名为AtOFP20)。由于AtOFP9失去了卵形家族蛋白典型的OVATE结构域,所以AtOFP9被从拟南芥卵形家族蛋白中剃除,因此,拟南芥卵形蛋白家族成员由原来的18个变为现在的19个,这些基因分布在5条染色体上。
植物激素是存在于植物体内的有机小分子[10],在植物生长发育各个时期均有作用,包括植物种子发芽、开花、结果、植物体的生长以及植物体凋零阶段[11]。当植物面对不利的环境因素时,细胞会从舒适状态变为胁迫响应状态,这一系列的生理状态变化主要取决于对胁迫状态信号的感知、转录因子的活化、激素的变化等一系列过程[12]。现研究表明,植物激素对萝卜中的RsOFP2.3的表达有影响[13],表明RsOFP2.3受到激素的调控进而影响植物的生长发育。
目前为止,对AtOFPs中其他AtOFP的功能已有了深入的研究,但对新发现的AtOFP19基因的研究知之甚少。本试验基于TAIR网站上的信息对AtOFP19基因进行初步分析,并利用生物信息学对AtOFP19蛋白结构、保守结构域进行分析,还完成了转录活性、亚细胞定位、激素处理等试验,对AtOFP19基因功能进行初步研究,对后续研究AtOFP19基因功能奠定基础。
1 材料和方法
1.1 植物材料
选用哥伦比亚(Col)野生型拟南芥种子,订购于ABRC(Arabidopis Biological Resource Center)的T-DNA插入突变体(atofp19)。
1.2 试验方法
1.2.1AtOFP19基因的生物信息学分析 应用TAIR数据库查询基因的基本信息。用NCBI进行保守结构域分析。应用ExPASy数据库对蛋白质初级结构进行分析。蛋白质二级结构预测、蛋白质三级结构预测分别应用SOPMA、SWISS-MODEL软件。使用SignalP软件分析信号肽。亚细胞定位预测采用最新的拟南芥亚细胞定位预测网站SUBA4软件[14]。网站链接见表1。
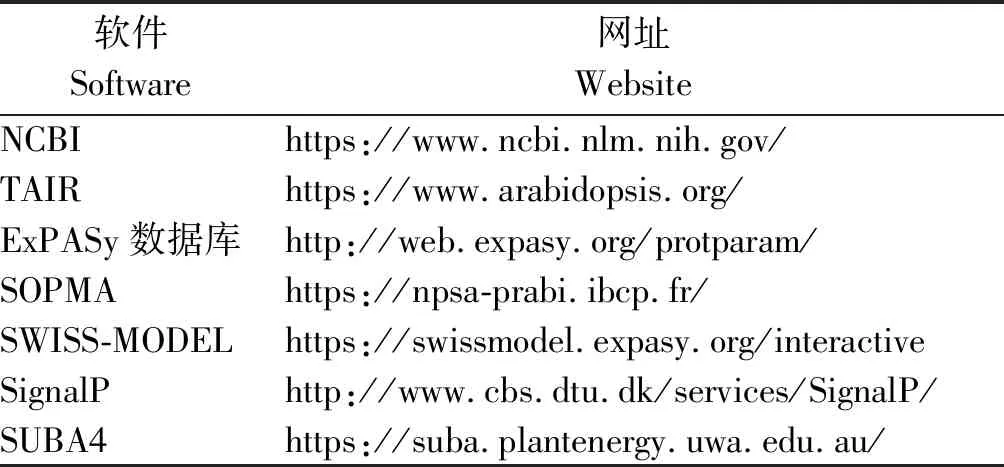
表1 生物信息学网站Tab.1 Bioinformatics website link
1.2.2 拟南芥的种植与培养 将约100粒拟南芥种子放入干净的2 mL EP管中,加入1 mL 30% 84消毒液,放入摇床中室温振荡15~20 min。用蒸馏水清洗消毒过的拟南芥种子,连续清洗4次尽量保证将消毒液清洗完全。用移液器把种子均匀点在固体培养基中,将种子铺匀。密封,避光放入4 ℃冰箱培养48 h。将培养后的种子放在组培架上用垂直光照进行培养。7~10 d后,用镊子把拟南芥幼苗移种到土壤中,每2 d浇水一次。
1.2.3AtOFP19基因克隆 采用植物总RNA提取试剂盒(北京擎科新业生物技术有限公司)提取拟南芥总RNA,利用HiScript Ⅱ Q Select RT SuperMix for qPCR(南京诺唯赞公司)进行反转录。以拟南芥cDNA第一链为模板,进行PCR扩增,扩增体系为20.0 μL:2×Taqmix 酶,上下游引物各 1.0 μL,cDNA模板1.0 μL,ddH2O 7 μL。扩增程序为:95 ℃预变性5 min;95 ℃变性30 s,57 ℃退火30 s,72 ℃延伸30 s,30个循环。进行琼脂糖电泳验证PCR产物,连接PUC载体,转化大肠杆菌进行扩增,挑选3个阳性克隆菌液送至库美生物技术有限公司测序。
1.2.4 35S∶HA-AtOFP19转基因植株的获得 选择XbaⅡ、BamH Ⅰ酶切位点用限制性内切酶酶切pBI121载体,对载体进行线性化。利用ClonExpress One Step Cloning试剂盒将目的基因与载体连接。引物设计的总原则:通过在引物5′端引入同源序列,使扩增产物之间以及扩增产物与线性化克隆载体之间都具有能够相互同源重组的完全一致的序列。插入片段PCR扩增,使用高保真聚合酶进行扩增。通过农杆菌介导法浸染拟南芥,具体步骤参考蔡玲[15]的研究。将浸染后的植株,用盖子盖好(不透光)室温避光一夜,第2天拿到培养架上,正放培养。将拟南芥植株转化后得到的第1批种子称为T1。将灭菌后的T1种子种到含有Kan(50 mg/mL)抗性的1/2MS固体培养基中,筛选出绿色幼苗,移到土壤中培养。收集T1植株的种子称为T2,按照上述步骤重复操作,得到纯合35S∶HA-AtOFP19转基因植物。
1.2.5 亚细胞定位的观察 构建pCAMBIA1302-AtOFP19-GFP载体,通过原生质体瞬时转染技术[16]将载体转入到原生质体中,在遮光室温条件下孵育16 h,用移液器将少量的原生质体溶液滴加在载玻片上,由一端轻轻地将盖玻片盖到载玻片上,要尽量避免产生气泡。在盖玻片的表面滴加少量的镜油,选择GFP激发光,利用激光共聚焦显微镜观察亚细胞定位情况,并拍摄记录。
1.2.6 荧光定量试验 荧光定量试验采用全式金公司荧光定量试剂盒,以β-Actin为内参,进行荧光定量PCR,每次试验进行3次生物学重复(表2)。
1.2.7 AtOFP19对种子萌发的影响 将WT种子、OE种子、atofp19种子,用30% 84消毒液消毒10 min,无菌水漂洗5~6次。将3种种子接种到无激素无抗性1/2MS培养基上,每个平板中接种100粒种子,4 ℃春化2 d,然后转移到培养箱中进行培养。以胚根突破种皮为萌发标志,每天统计萌发率,连续统计7 d。相同的试验进行3次,然后对数据进行分析。

表2 荧光定量体系Tab.2 Fluorescence quantitative system
1.2.8 激素调控AtOFP19基因的表达量 将野生型拟南芥种子接种到含不同浓度脱落酸ABA(0.2,0.5,1.0 μmol/L)、细胞分裂素6-BA(0.5,1.0,2.0 μmol/L)、赤霉素GA3(0.5,1.0,2.0 μmol/L)、生长素IBA(0.5,1.0,2.0 μmol/L)和乙烯利ETH(0.2,0.5,1.0 μmol/L)的1/2MS培养基上,以不添加激素处理为对照,选取最适浓度培养基中的幼苗移到土壤里培养,qRT-PCR测定AtOFP19基因的相对表达量,每个处理进行3次生物学重复。
2 结果与分析
2.1 AtOFP19基因生物信息学分析
2.1.1AtOFP19基因的分析 在已发表的文献中可查询AtOFP19基因的基因号为AT2G36026.1。在TAIR网站上查询AtOFP19基因的基本信息。可知,AtOFP19基因全长552 bp,CDS区552 bp,无内含子,位于第2号染色体。
2.1.2 AtOFP19保守结构域分析 应用NCBI对AtOFP19保守结构域分析发现,作为AtOFPs中的一员,AtOFP19蛋白在C末端有一个OVATE保守结构域(图1),与家族中其他成员一样拥有OVATE蛋白家族特征结构域,并且除了这个结构域外,AtOFP19蛋白中未预测到其他已知的结构域。
2.1.3 AtOFP19蛋白初级结构分析 对AtOFP19蛋白质理化性质进行分析,AtOFP19蛋白由183个氨基酸组成,AtOFP19蛋白的分子式为C892H1386N260O272S8,分子量为20.36 ku,理论等电点为9.32(图2)。
通过对AtOFP19基因编码的氨基酸进一步分析发现,AtOFP19蛋白质由19种氨基酸组成,其中Ser含量最多,占氨基酸总数的17.5%,Leu、Lys、Ala次之,Trp含量最少,仅占氨基酸总数的1.1%。带正电荷的氨基酸残基 (Asp+Glu)总数为16个,带负电荷的氨基酸残基(Arg+Lys)总数为23个(图3)。

图1 AtOFP19保守结构域分析Fig.1 Analysis of conserved domains about the AtOFP19 protein

图2 AtOFP19蛋白初级结构分析Fig.2 Analysis of AtOFP19 protein primary structure
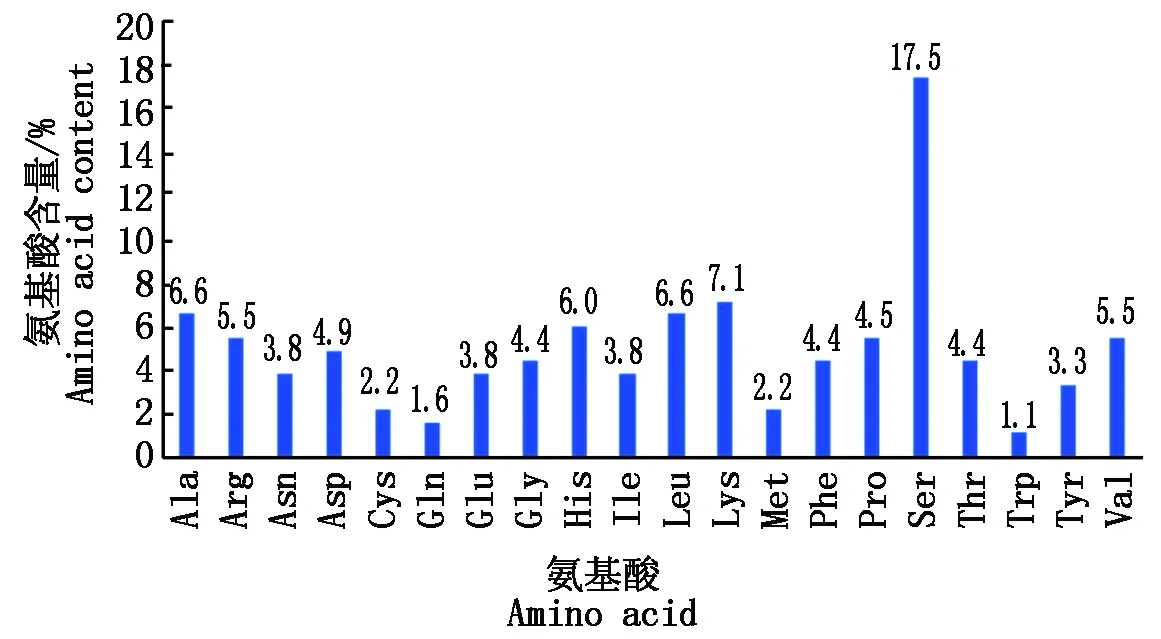
图3 AtOFP19蛋白氨基酸组成分析Fig.3 Amino acid composition analysis of the AtOFP19 protein
2.1.4 AtOFP19蛋白二级及三级结构分析 运用SOPMA对AtOFP19编码的蛋白质进行二级结构分析,在AtOFP19蛋白中,无规卷曲 (Random coil)含量最多,占48.09%,是AtOFP19蛋白质二级结构的主要构成元件;α螺旋 (Alpha helix)和延伸链 (Extended strand)次之,分别占28.96%,18.03%,β转角 (Beta turn)最少,占4.92%(图4)。
利用SWISS-MODEL软件预测AtOFP19蛋白的三级结构,对AtOFP19的三级结构进行分析,结果显示AtOFP19蛋白质三级结构中构成元件与二级结构预测结果基本一致(图5)。
2.1.5 AtOFP19蛋白信号肽分析 应用SignalP在线分析软件对AtOFP19蛋白编码的氨基酸进行信号肽预测,结果显示,在N端前70个氨基酸中,最大的S值为0.003 8,推测AtOFP19蛋白不具有信号肽,是非分泌蛋白(图6)。
2.1.6 AtOFP19蛋白亚细胞定位分析 AtOFP19是转录因子OVATE家族中的一员,应用最新的拟南芥亚细胞定位预测网站SUBA4对其进行亚细胞定位预测,结果显示,AtOF19蛋白被预测定位在细胞核中(图7)。

Hh.α螺旋;Ee.延伸链;Tt.β转角;Cc.无规卷曲。Hh.Alpha helix;Ee.Extended strand;Tt.Beta turn;Cc.Random coil.
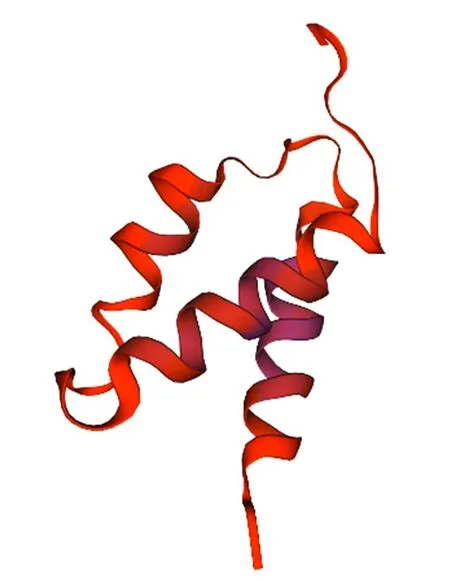
图5 AtOFP19蛋白三级结构分析Fig.5 Analysis of AtOFP19 protein tertiary structure
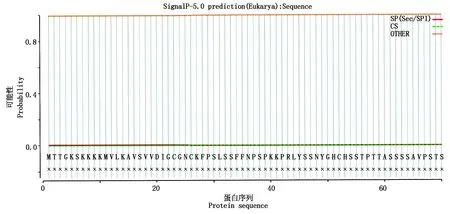
图6 AtOFP19蛋白信号肽分析Fig.6 Signaling peptide analysis of AtOFP19 protein
图7 AtOFP19蛋白亚细胞定位分析Fig.7 Subunit localization analysis of AtOFP19 protein
2.2 AtOFP19基因的克隆
提取拟南芥总RNA,反转录得到cDNA。以cDNA为模板,利用PCR技术克隆得到AtOFP19基因。PCR产物大小在550 bp左右,与生物信息学分析结果一致(图8),并通过基因测序分析验证了得到的目的片段为AtOFP19基因。
2.3 AtOFP19亚细胞定位分析
将构建带有GFP信号的载体转入拟南芥原生质体中,通过激光扫描共聚焦显微镜观察荧光分布情况。结果如图9所示,AtOFP19-GFP融合蛋白只在细胞核中表达,说明AtOFP19蛋白定位在细胞核中。
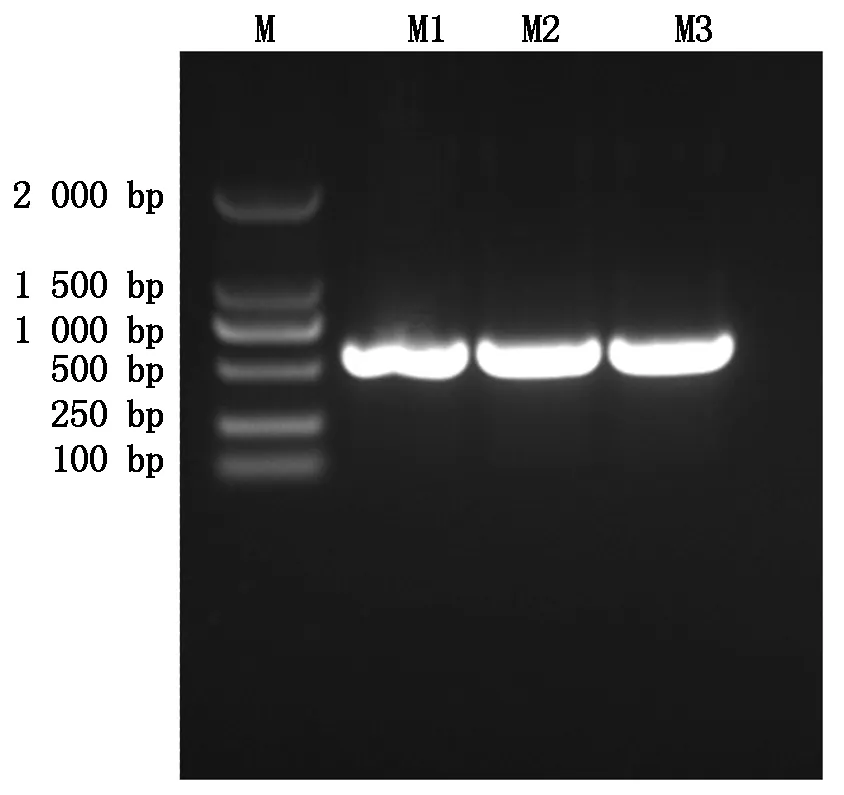
M.Marker;M1、M2、M3. AtOFP19基因条带。M.Marker;M1,M2,M3. AtOFP19 gene.
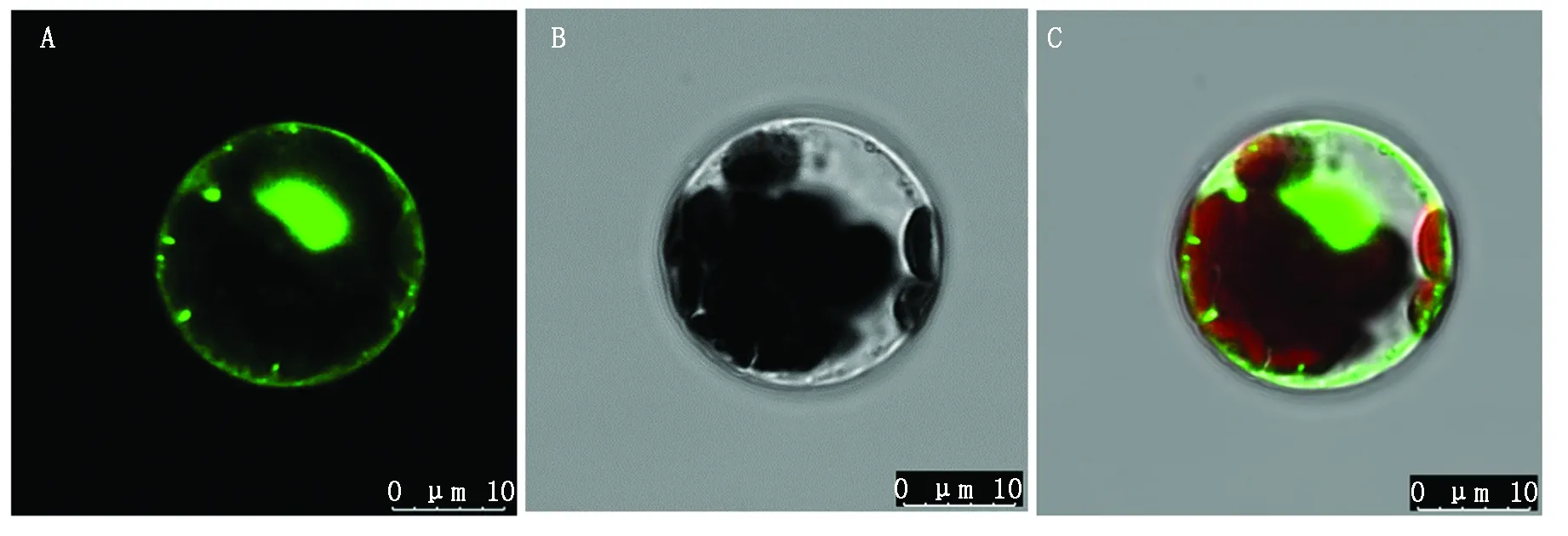
A.绿色荧光;B.明场;C.叠加。A. Fluorescence;B.Normal light;C.Merged.
2.4 AtOFP19基因表达分析
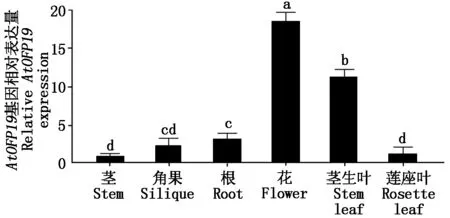
2.4.1AtOFP19基因组织表达分析 取生长到35 d左右的拟南芥为材料,利用qRT-PCR对AtOFP19基因在拟南芥各部位表达量进行分析。结果表明,AtOFP19基因在根、茎、叶、花、角果中均有表达,在茎生叶和花中的表达量相对较高,其中在花中的表达量最高,在角果、根、茎中的表达量较少。这些结果表明,AtOFP19基因在拟南芥花和茎生叶的形成过程中起作用(图10)。
不同小写字母表示0.05水平差异显著性。图11,12,15同。Different lowercase letters indicate significant differences in 0.05 levels.The same as Fig.11,12,15.
2.4.2AtOFP19基因在不同发育时期表达分析 每隔10 d取WT植株为材料,进行qRT-PCR测定AtOFP19基因的相对表达量。结果表明,AtOFP19基因在拟南芥幼苗生长初期阶段(10 d)表达量较高,随着植物的生长发育AtOFP19基因的表达量下降,到开花时期(50 d)表达量又升高(图11)。这暗示着AtOFP19基因在拟南芥幼苗生长阶段与植株开花阶段起作用。
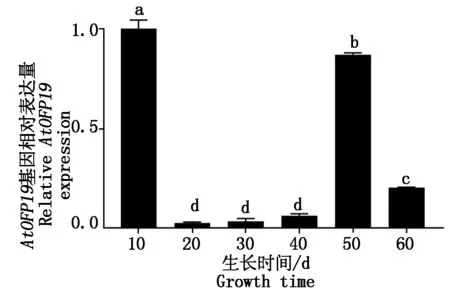
图11 AtOFP19基因在不同时期的表达量
2.5 AtOFP19是转录抑制子
构建PUC-GD-AtOFP19载体,以LD-VP16、GD、GD-AtOFP19为效应基因,Lex-Gal4∶GUS为报告基因共同利用瞬时转染技术,转到原生质体中,检测GUS的相对表达量,来检测其转录活性。已知LD-VP16是转录激活子,它能够激活报告基因的表达,因此将GD、LD-VP16和报告基因Lex-Gal4∶GUS共转染到原生质体中,报告基因GUS表达量会高表达。结果表明,GD-AtOFP19、LD-VP16和报告基因Lex-Gal4∶GUS的试验组中GUS表达量较对照组低(图12)。因此,证明了AtOFP19具有转录抑制活性。

图12 AtOFP19为转录抑制子Fig.12 AtOFP19 is a transcriptional repressor
2.6 35S∶HA-AtOFP19转基因植株、atofp19突变体植株与野生型植株表型对比
将构建的pBI121-HA-AtOFP19载体利用农杆菌浸染技术转入野生型植株中,筛选得到2株纯合OE植株(OE1、OE2)。将OE、atofp19与WT的表型进行对比,发现WT与atofp19的表型没有明显差异,而与WT相比,OE植株莲座叶较小,茎细,植株整体细小(图13)。
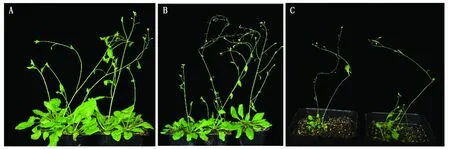
A.野生型植株;B.atofp19转基因植株;C.OE转基因植株。A. Wild type plants;B. atofp19 mutant plants;C.OE transgenic plants.
2.7 AtOFP19抑制种子萌发
种子休眠和萌发受到种子内部生长物质的调控和外部环境因子的影响,是一个十分复杂的生理过程。为研究AtOFP19是否在拟南芥种子萌发过程中起作用,本试验将OE、atofp19与WT的种子种到无激素无抗性的1/2MS培养基中,统计1~7 d种子萌发率。结果表明,当培养4 d后种子萌发率基本稳定。与WT植株种子的萌发率相比,OE植株种子萌发率较低,而atofp19植株种子萌发率较高(图14),表明AtOFP19对拟南芥种子的萌发具有抑制作用。
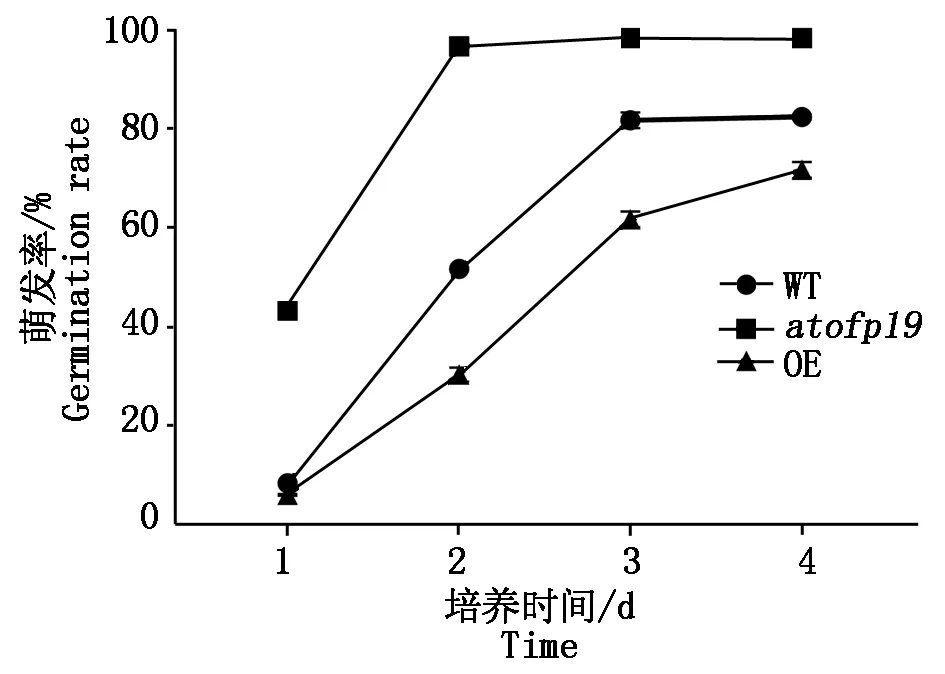
图14 种子萌发率Fig.14 Seed germination rate
2.8 AtOFP19基因受6-BA激素的调控
为探究AtOFP19基因的表达是否受到激素的调控,将WT种子接种到含不同浓度 ABA、6-BA、GA3、IBA和ETH的1/2MS培养基上,以不添加激素为对照,筛选出生长状况较好的幼苗移到土壤里培养,利用qRT-PCR测定AtOFP19基因的相对表达量。结果如图所示,6-BA处理组中的AtOFP19基因表达量最高。而ABA、GA3、IBA处理组植株中的AtOFP19基因表达量与对照组的无显著差异(P>0.05)(图15),表明AtOFP19基因的表达主要受6-BA的调控。
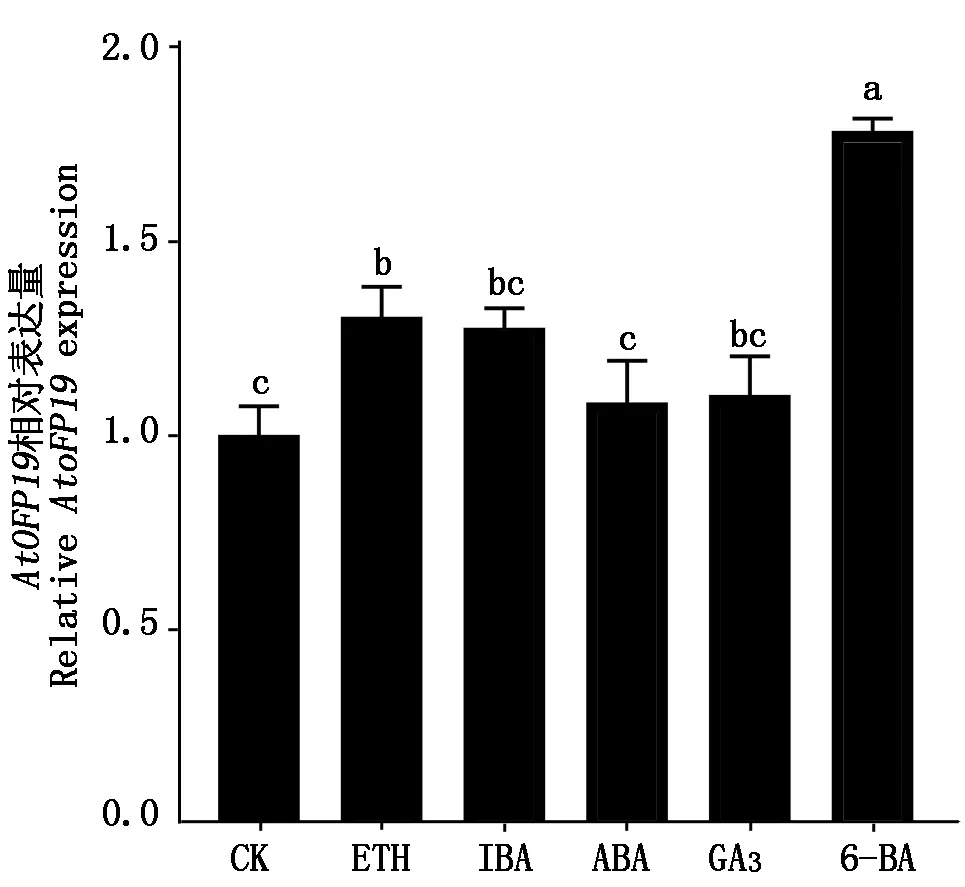
图15 激素处理后AtOFP19基因相对表达量
3 讨论
2011年Wang等[8]为研究AtOFPs在植物生长发育中发挥的作用,利用生物信息学、生物化学、分子生物学、遗传学表型观察等方法对拟南芥AtOFP基因进行了分析。观察过表达AtOFPs植物的表型发现AtOFP1、AtOFP2、AtOFP4、AtOFP5和AtOFP7过表达的植物表型为肾形子叶和圆形、卷曲的叶子,花发育迟缓,莲座叶较小,结实率下降,将这几个基因归为Ⅰ类AtOFP基因。过表达AtOFP6和AtOFP8的植物表型为扁平、厚的青色莲座叶,归为Ⅱ类AtOFP基因。过表达AtOFP13、AtOFP15、AtOFP16和AtOFP18的植物表型相似,为莲座叶较小,结实率降低,花发育延迟,角果末端钝平,归为Ⅲ类AtOFP基因[8]。本试验成功地获得了过表达AtOFP19植株,其表型为莲座叶较小,茎细,植株矮小,与Ⅲ类基因的表型相似。
在2007年发现了AtOFP1是转录抑制因子,在植物细胞伸长过程中起抑制作用[6]。2011年Li等[5]发现过表达AtOFP2、AtOFP7的植株表型与过表达AtOFP1的植株表型相似,通过试验证实了AtOFP2、AtOFP7也是转录抑制因子。在此之后Wang等[8]证实了其他AtOFPs也是转录抑制因子,这表明AtOFPs可能是一个新的转录抑制因子家族。本试验通过构建PUC-GD-AtOFP19载体,利用原生质体瞬时转染技术,将构建的载体转入原生质体中,酶标仪测定试验组和对照组的GUS相对表达量,发现试验组中GUS表达量较对照组低,验证了AtOFP19也是转录抑制子。
MYB类转录因子是植物体内最大的转录因子家族之一,MYB类转录因子会通过多种途径参与植物对干旱胁迫、高温胁迫、低温胁迫、重金属胁迫、盐胁迫的响应[17-19],同时MYB转录因子对植物体内的激素具有调节作用[20]。现研究表明,植物激素对萝卜中的RsOFP2.3的表达有影响,在12 h内,RsOFP2.3的表达对ABA、NAA、6-BA和GA3的反应显著上调,并且对GA3处理最敏感,其次是6-BA、ABA和NAA,而在处理12,24 h后对乙烯的反应均无明显变化,这表明RsOFP2.3受到激素的调控进而影响植物的生长发育[13]。那么拟南芥中的转录因子AtOFP19是否也受到植物激素的调控,本试验发现AtOFP19的表达量受到6-BA的调控,而其他激素对AtOFP19表达量的调控没有明显作用,这暗示着AtOFP19基因主要受到6-BA激素的调控进而影响植物的生长发育,其调控的分子机制还需要进一步试验探究。

