MicroRNA-150水平与原发性肝癌手术预后的关系*
吴娜娜,陈星宇,姚辉华,王忠福
(成都市第一人民医院1.肿瘤二科,2.胃肠疝外科,3.介入血管外科,四川成都610041)
原发性肝癌(primary hepatocellular carcinoma,PHC)恶性程度高,发病隐匿,大部分患者确诊时已处于中晚期,且有肝内外转移,即便接受肿瘤切除术,患者术后5年生存率仅有24%~50%[1-3]。目前临床针对PHC 高危人群的筛查主要依赖于超声检查及甲胎蛋白(alpha-fetoprotein, AFP),但超声检查很难发现微小病灶,且PHC 患者中AFP 轻度升高或呈阴性占比高达20%~40%,存在一定的漏诊率[4-5]。因此,挖掘新的PHC 预后分子标志物,探讨新型防治靶点及侵袭转移分子机制,对延长患者生命具有指导性意见。PHC 的发生、发展属于一个多步骤、多阶段过程,每个阶段均有着不同的细胞信号传导通路异常、癌基因及抑癌基因失衡、细胞周期调节改变等,而miRNA 可作为抑癌基因或癌基因影响细胞凋亡、增殖、迁移等肿瘤相关通路,进而调控肿瘤诸多生物学行为[6-7]。miR-150 是定位于19q13.33的单链miRNA,长度为2 nt,近年来不断有研究发现,miR-150 在系统性硬化病、恶性肿瘤、组织纤维化、肺动脉高压等多种疾病中异常表达[8]。有研究发现,肝癌患者血清miR-150 水平下调,其水平与患者病理学特征密切相关,但尚不清楚miR-150与肝癌患者预后的关系[9]。
1 资料与方法
1.1 一般资料
选取2016年1月—2018年1月在成都市第一人民医院接受手术治疗的PHC 患者80 例作为PHC 组。其中,男性52 例,女性28 例;年龄45~79 岁,平均(63.02±5.11)岁;体重指数(body mass index, BMI)18.5~24.6 kg/m2,平均(21.59±2.24)kg/m2。纳入标准:①符合《原发性肝癌规范化病理诊断指南(2015年版)》[10]中PHC诊断标准;②Child-Pugh分级A级、B级;③检测前未接受放疗、化疗及射频消融等治疗;④首次接受肿瘤切除术,无手术禁忌证。排除标准:①活动性肝炎;②药物或酒精性肝损伤;③既往接受肝移植或肝胆手术;④肿瘤保留不完整、边界模糊;⑤凝血功能异常;⑤伴有自身免疫疾病、其他肿瘤或精神疾病。另选取同期本院健康体检者80 例作为对照组。其中,男性49例,女性31例;年龄42~80岁,平均(62.94±4.86)岁;BMI 18.95~25.2 kg/m2,平均(22.03±2.15)kg/m2。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准,患者及家属自愿签署知情同意书。
1.2 主要试剂
Trizol Reagent 试剂盒(德国凯杰公司),TapMan MicroRNA RT 试剂盒(美国ABI 公司),miR 特异性TapMan 探针及TapMan Universal PCR Master Mix(美国ABI 公司)。
1.3 方法
采集PHC 组术前、术后3 d 及对照组体检当日的5 ml 空腹静脉血,置于含有EDTA 抗凝试管中,室温下静置1 h,3 000 r/min 离心10 min,取上清液于干净离心管中,置入-80℃冰箱冷冻保存。使用Trizol Reagent 试剂盒提取血清中总RNA,通过TapMan MicroRNA RT 试剂盒将RNA 逆转录成cDNA,具体操作参照说明书。使用miR 特异性TapMan 探针及TapMan Universal PCR Master Mix 进行miR-150 的qRT-PCR 检测,U6作为内参基因,其正向序列:5'-GGTATGATGCAGTAGCACC-3',反向序列 :5'-AAGTGATCGCAGTACGTAC-3',长度分别为121 bp、119 bp;miR-150 正向序列:5'-GTGTATGCAGCAGT AGCTGGA-3',反向序列:5'-CAGTAGTCAGTACGGA CGAAG-3',长度分别为116 bp、118 bp。总反应体系为20 μl,qRT-PCR 反应条件:50℃预变性2 min,95℃预变性10 min,95℃变性15 s,60℃退火1 min,共循环40 次。根据2-ΔΔCt法计算miR-150 相对表达量。电话随访时间截止至2021年2月,统计PHC 患者术后1年和术后3年生存率。
1.4 统计学方法
数据分析采用SPSS 23.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以构成比表示,比较用χ2检验;Kaplan-Meier法绘制生存曲线,比较用Log-rank χ2检验,影响因素的分析用多因素Cox 风险比例模型。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者手术前后血清miR-150相对表达量比较
对照组、PHC组患者术前血清miR-150相对表达量分别为(0.93±0.15)和(0.42±0.09),经t检验,差异有统计学意义(t=26.077,P=0.000),PHC组较对照组低。PHC组术后血清miR-150相对表达量为(0.73±0.12),与术前miR-150相对表达量比较,差异有统计学意义(t=18.485,P=0.000),术后较术前高。
2.2 不同血清miR-150水平患者的临床病理特征比较
以miR-150 相对表达量0.42 作为分界值,将PHC组分为高表达组和低表达组,分别有48和32例。两组患者不同组织分化程度、不同TNM 分期、是否伴有肝硬化及是否伴有转移比较,差异有统计学意义(P<0.05)。两组患者性别比、不同年龄、不同肿瘤直径、是否伴有肝硬化复发、是否伴有乙型肝炎、不同AFP 水平、是否伴有门脉癌栓比较,差异无统计学意义(P>0.05)。见表1。

表1 两组患者临床病理特征比较 例
2.3 血清miR-150水平与PHC患者预后的关系
高表达组与低表达组患者3年累积生存率分别为62.50%和21.88%,经Log-rank χ2检验,差异有统计学意义(χ2=15.946,P=0.000),低表达组较高表达组低。低表达组、高表达组中位生存时间分别为19.4 个月、29.0 个月。见图1。

图1 高表达组和低表达组患者的生存曲线
2.4 影响PHC患者3年生存率的Cox回归分析
单因素、多因素Cox 回归模型分析结果显示,miR-150 低表达、肿瘤直径≥5 cm、TNM 分期Ⅲ期和Ⅳ期、肝硬化、转移、AFP ≥25 ng/ml 及伴有门脉癌栓是影响PHC 患者3年生存率的独立因素(P<0.05)。见表2、3。
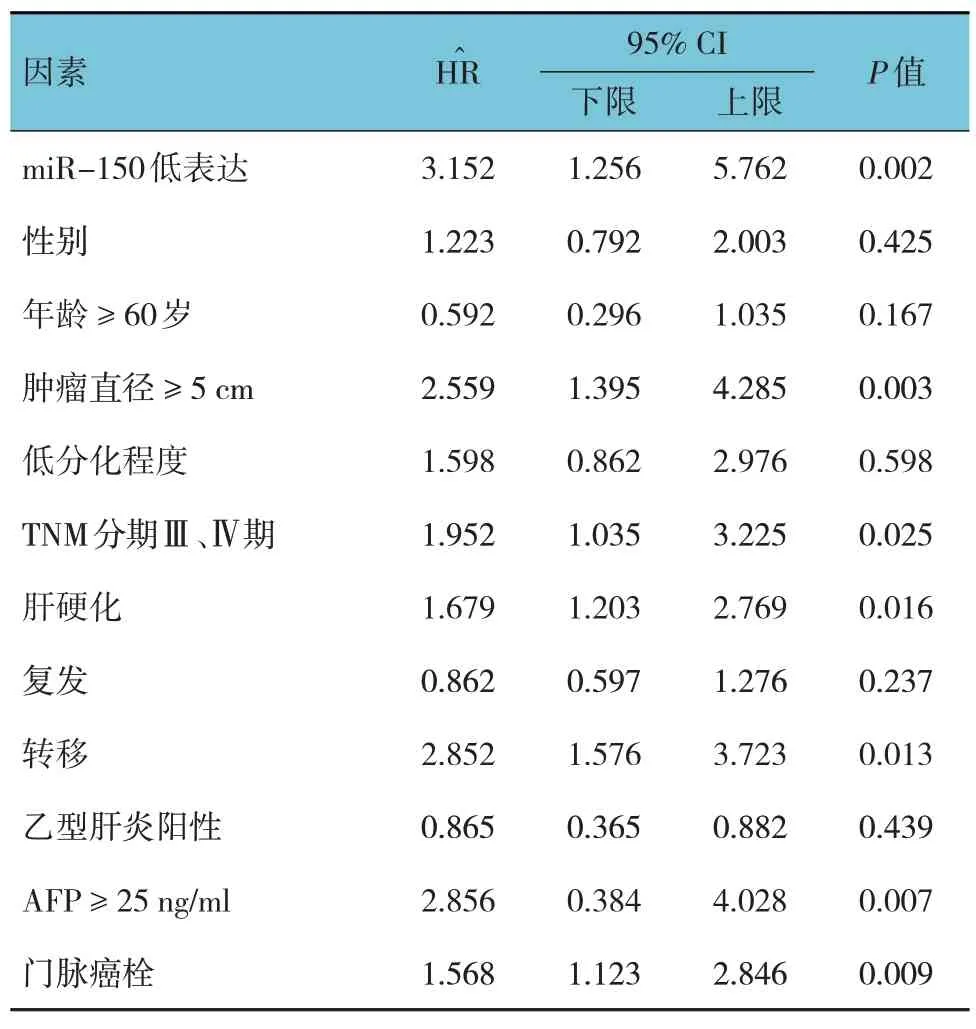
表2 影响PHC患者3年生存率的单因素Cox回归分析参数
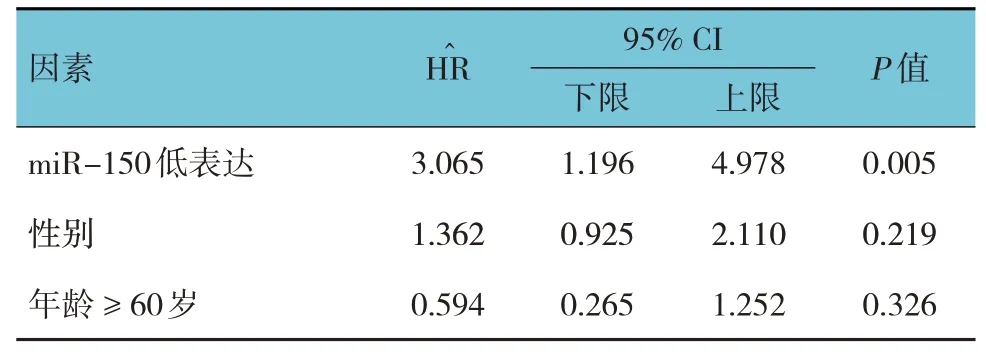
表3 影响PHC患者3年生存率的多因素Cox回归分析参数

续表3
3 讨论
目前,临床关于PHC 的具体发病机制尚未完全阐明,但多认为与乙型肝炎病毒和丙型肝炎病毒感染、吸烟、环境污染等因素相关[11]。现代研究表明,肿瘤的发生、发展属于分子调控失控过程,涉及诸多环节,包括抑癌基因失活、癌基因激活、细胞基质间黏附障碍及细胞信号传导异常等[12]。但对PHC的病理、生理认知仍存在一定不足,深入分析其发病机制及防治靶点,尤其是借助测序技术、分子生物学等手段探索评估预后的新型标志物,对改善PHC 预后尤为重要。
miRNA 属于一类内源性的具有调控功能的非编码RNA,由22 个核苷酸构成,长度18~25 nt,其与下游多个靶基因结合后可抑制、降解转录后基因水平,调节靶基因蛋白和mRNA 表达,进而调控细胞细胞分化、凋亡及增殖的诸多生物学特性,同时参与调控肿瘤干细胞、调节肿瘤微生物及肿瘤的迁移、侵袭等过程[13]。ZHANG 等[14]研究发现,miR-150 在结直肠癌组织中低表达,且可能通过抑制高迁移率族蛋白A2阻断细胞增殖,下调Cyclin A表达阻滞细胞周期。JIANG 等[15]研究报道,miR-150 在非小细胞肺癌细胞中显著上调,其可能通过SIRT2/JMJD2A 信号通路对细胞活力及迁移产生调节作用。乔恩奇等[16]研究发现,miR-150在乳腺癌中高表达,干扰miR-150表达可促进细胞凋亡及抑制细胞增殖,其作用机制可能与调控PI3K/Akt 信号、上调Leaved Caspase 等有关。以上研究证实,miR-150 在不同环境及疾病中可发挥一定的抑癌或促癌因子作用,但其在PHC 中是否发挥同样作用及具体的机制尚未完全阐明。ZHANG 等[17]研究发现,miR-150 在原发性肝细胞癌中呈低表达,且可能通过下调靶标c-Myb 参与肝脏干细胞自我更新。YU 等[18]研究报道,肝细胞癌患者血清miR-150水平比健康对照者低,术后miR-150水平升高,肿瘤复发后降低,诊断慢性乙型肝炎病毒感染相关肝细胞癌的AUC 为0.931,敏感性为82.5%,特异性为83.7%,Kaplan-Meier曲线分析显示,miR-150水平较低的患者总生存期更短。
本研究结果发现,miR-150 表达可能与PHC 患者组织分化程度、TNM 分期、是否伴有肝硬化及转移相关,提示miR-150 水平与PHC 患者发生、发展关系密切,miR-150高表达可能对抑制癌转移、减轻病情有一定作用。其原因可能在于miR-150过表达可能抑制癌细胞血管生成及转移能力,而下调miR-150表达可加速肿瘤细胞转移、侵袭,增强肿瘤血管生成能力,故miR-150 在PHC 患者中发挥抑癌作用。多因素Cox 回归模型分析发现,miR-150 低表达、肿瘤直径≥5 cm、TNM 分期为Ⅲ期和Ⅳ期、肝硬化、转移、高AFP水平及伴有门脉癌栓是影响PHC患者3年生存率的独立因素。
综上所述,miR-150 在PHC 患者中低表达,与患者预后、组织分化程度、TNM 分期等关系密切,有望成为评估PHC 患者预后的新型分子标志物。但因本研究存在观察时间短、样本量少、样本来源单一等局限性,有待延长观察时间、扩大样本量及范围进一步探讨。

