超声引导下射频消融术与微创切除术治疗小肝癌的远期预后比较*
王超,郑柏,桂茂崇,陈小鹏,江元勋,纪杏怡
(海南省中医院超声科,海南海口570203)
目前临床上小肝癌的定义尚无统一标准,多指单个癌结节最大直径或2个癌结节直径之和≤3 cm的肝癌[1]。该病好发于中老年男性群体,多由肝脏的慢性损伤引发,如肝硬化、乙型肝炎、丙型肝炎等[2]。近年来,随着人们生活节奏的加快、饮食结构的改变,小肝癌的发病率呈逐年递增的趋势[3]。以往临床治疗小肝癌,多以手术切除为主,效果较好,多数患者术后可长期生存,但对机体的损伤较大[4]。近年来,随着消融技术的成熟,微波消融、射频消融等新型技术逐渐应用于肝癌患者的治疗,射频消融是将电极刺入肿瘤,通过发射频波,使局部温度升高从而促使肿瘤细胞变性坏死,达到杀死肿瘤细胞的目的[5]。有研究证实,射频消融术治疗肝癌有效且安全,可减轻对肝脏功能的损伤。但也有部分研究指出,射频消融术治疗肝癌术后复发风险较高[6]。故目前对小肝癌治疗方案的选择,仍存在一定争议。基于此本研究将80 例小肝癌患者分组治疗,比较超声引导下射频消融术与微创切除术治疗小肝癌的远期预后。
1 资料与方法
1.1 一般资料
选取2015年3月—2018年4月海南省中医院接受治疗的80 例小肝癌患者。根据自愿原则分为消融组和切除组,每组40 例。消融组患者中男性29 例,女性11 例;年龄45~74 岁,平均(57.48±5.29)岁;肿瘤直径1~3 cm,平均(2.13±0.52)cm;Child-Pugh 分级:A 级24 例,B 级16 例;合并肝硬化25 例,乙型肝炎27 例。切除组患者中男性27 例,女性13 例;年龄45~75 岁,平均(56.82±5.18)岁;肿瘤直径1~3 cm,平均(2.05±0.50)cm;Child-Pugh 分级:A 级26 例,B 级14 例;合并肝硬化24 例,乙型肝炎28 例。纳入标准:①符合《原发性肝癌诊疗规范(2011年版)》[7]中原发性肝癌的诊断标准;②首次确诊;③单发肿瘤直径≤3 cm,或2 个癌结节直径之和≤3 cm;④治疗前未接受其他治疗方案;⑤Child-Pugh 分级A 级或B 级。排除标准:①合并其他消化系统严重疾病者;②合并血液系统或免疫系统疾病者;③已发生肝外转移者;④既往接受过腹部手术者。本研究经医院医学伦理委员会批准通过。
1.2 方法
1.2.1 消融组患者接受超声引导下射频消融术治疗,患者取平卧位,麻醉满意后,采用消融穿刺探头消融引导,病灶的位置及范围确定后,引导消融针穿刺至病灶中央部位,根据病灶情况调整电压及消融时间,射频功率130~150 W,温度≤120℃,消融直径3~4 cm,覆盖病灶周围0.5~1 cm,时间15~20 min。对于直径<2 cm 的肿瘤采用一点两处消融,对于直径>2 cm 的肿瘤,采用多点多针消融。治疗结束后采用超声造影观察病灶清除是否彻底,若有残余则立即补充消融。术后常规抗感染治疗。
1.2.2 切除组患者接受微创切除术即腹腔镜肝部分切除术治疗。患者取平卧位,麻醉满意后,建立人工气腹,并对腹腔情况进行探查,进一步明确肿瘤具体位置及范围。采用超声刀将肝脏周围韧带组织分离,在距病灶2 cm 处设置切除线,将病灶所处肝叶及肝段切除,肝断面采用双极电凝止血处理,适当延长切口取出标本,关闭腹腔,结束手术。
1.3 评价指标
1.3.1 肝功能于术前、术后1 个月采集患者空腹静脉血5 ml,分离血清后,采用博科BK-400 全自动生化分析仪(济南欧莱博技术有限公司)测定肝功能指标[谷丙转氨酶(alanine aminotransferase,ALT)、总胆红素(total bilirubin, TBIL)、谷草转氨酶(aspartate aminotransferase,AST)]。
1.3.2 肿瘤标志物于术前、术后1 个月采集患者空腹静脉血5 ml,通过酶联免疫吸附试验测定两组肿瘤标志物[癌胚抗原(carcinoembryonic antigen,CEA)、磷脂酰肌醇蛋白聚糖3(Glypican 3, GPC3)、甲胎蛋白(alpha-fetal protein,AFP)]水平。
1.3.3 循环肿瘤细胞(circulating tumor cell, CTC)和肝细胞生长因子(hepatocyte growth factor, HGF)于术前、术后1 个月采集患者空腹静脉血5 ml,采用双抗体夹心法测定HGF 水平。通过化学发光微粒子免疫分析法富集肿瘤细胞,采用荧光原位杂交技术原理鉴别肿瘤细胞,从而测定外周血中CTC水平。
1.3.4 并发症比较两组患者并发症总发生率,包括肝区疼痛、消化道出血、肝衰竭、胸腔积液、发热等。
1.3.5 远期预后患者均获随访,开始时间为患者出院后,截止时间为患者死亡或出院后3年。比较两组术后3年复发及生存情况。
1.4 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以率(%)表示,比较用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者手术前后肝功能比较
两组患者术前ALT、AST、TBIL 水平比较,差异无统计学意义(P>0.05)。两组患者术后ALT、AST、TBIL 水平比较,差异有统计学意义(P<0.05),消融组低于切除组。见表1。
表1 两组患者手术前后肝功能比较 (n=40,±s)
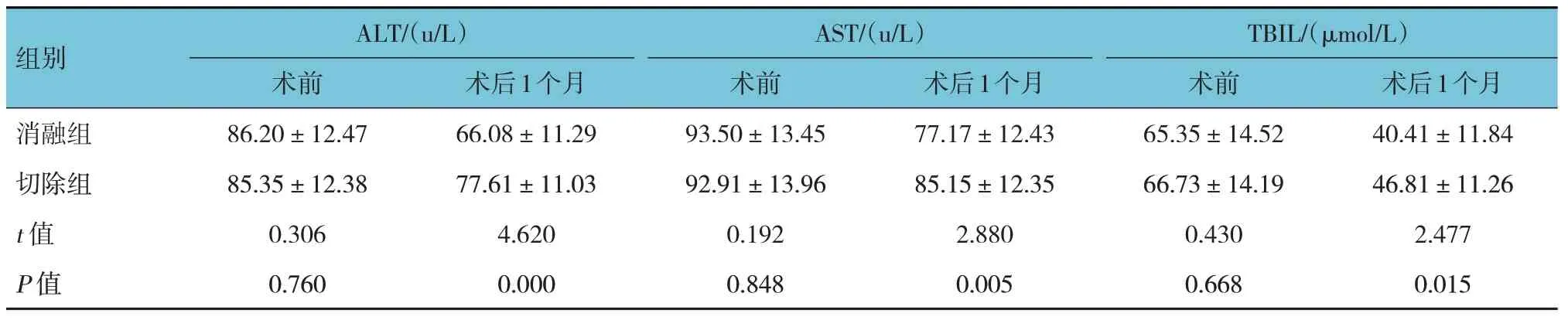
表1 两组患者手术前后肝功能比较 (n=40,±s)
组别术后1个月77.17±12.43消融组ALT/(u/L)术前86.20±12.47 AST/(u/L)术前93.50±13.45术后1个月66.08±11.29 TBIL/(μmol/L)术前65.35±14.52术后1个月40.41±11.84 85.15±12.35 2.880 0.005切除组t 值P 值85.35±12.38 0.306 0.760 92.91±13.96 0.192 0.848 77.61±11.03 4.620 0.000 66.73±14.19 0.430 0.668 46.81±11.26 2.477 0.015
2.2 两组患者手术前后肿瘤标志物比较
两组患者手术前和手术后CEA、GPC3、AFP 水平比较,差异无统计学意义(P>0.05)。见表2。
表2 两组患者手术前后肿瘤标志物比较 (n=40,±s)

表2 两组患者手术前后肿瘤标志物比较 (n=40,±s)
组别术后1个月79.53±21.61消融组CEA/(μg/L)术前22.16±5.29 GPC3/(ng/L)术前240.46±38.32术后1个月8.13±3.64 AFP/(μg/L)术前248.90±43.81术后1个月71.35±16.34 80.24±20.93 0.149 0.882切除组t 值P 值21.87±5.37 0.243 0.809 238.43±40.02 0.232 0.817 8.30±3.55 0.211 0.833 251.73±42.90 0.292 0.771 73.20±15.59 0.518 0.606
2.3 两组患者手术前后HGF、CTC比较
两组患者术前HGF、CTC 水平比较,差异无统计学意义(P>0.05)。两组患者术后HGF、CTC 水平比较,差异有统计学意义(P<0.05),消融组低于切除组。见表3。
表3 两组患者手术前后HGF、CTC比较 (n=40,±s)

表3 两组患者手术前后HGF、CTC比较 (n=40,±s)
组别HGF/(ng/L)术前0.62±0.14消融组术后1个月0.41±0.13 CTC/(个/ml)术前8.13±1.09术后1个月3.72±0.67 0.60±0.16 0.595 0.554切除组t 值P 值0.49±0.15 2.549 0.013 8.02±1.01 0.468 0.641 4.21±0.78 3.014 0.003
2.4 两组患者术后并发症比较
两组患者术后并发症发生率比较,差异有统计学意义(χ2=4.114,P=0.043),消融组低于切除组。见表4。

表4 两组患者术后并发症比较 [n=40,例(%)]
2.5 两组患者远期预后比较
消融组患者术后3年复发率为15.0%(6/40),术后3年总生存率为92.5%(37/40);切除组患者术后3年复发率为17.5%(7/40),术后3年总生存率为90.0%(36/40)。两组患者术后3年总生存率、术后3年复发率比较,差异无统计学意义(χ2=0.092 和0.157,P=0.762 和0.692)。
3 讨论
肝癌早期症状不明显,少数有腹部胀痛、体重骤减、发热等症状,若未及时治疗,则可能威胁患者生命[8]。肝癌多继发于肝硬化、肝炎等基础疾病,故对患者肝功能的影响较大,在临床中不仅要保证病灶的清除效率,而且要尽可能减少对肝功能的损伤[9]。目前临床治疗肝癌的方案较多,如腹腔镜肝切除术、肝移植、微波消融术、射频消融术、放疗、化疗等,效果不一,对于治疗方案的选择仍存在一定争议。以往研究将肝切除术作为治疗肝癌的金标准,但切除术对机体损伤较大,且术后并发症较多,加上部分患者肝功能、肝储备功能较差,已无法耐受手术切除,故临床接受手术切除的肝癌患者<30%[10-11]。
射频消融是新型物理消融技术,利用物理方法产生热能,进而使肿瘤细胞灭活,其原理是通过在机体局部形成电流回路,促使肿瘤病灶及周围组织中的极性大分子和离子高速震荡,从而摩擦产生热量,促使局部温度升高,甚至可高达120℃,而温度>42℃肿瘤细胞就开始死亡,从而达到根除肿瘤细胞的目的[12-13]。局部高温也可激活机体免疫功能,进一步加强其对肿瘤细胞的抑制[14]。另外,高温下肿瘤供血血管也遭到破坏,进而切断肿瘤细胞营养供应[15]。本研究结果显示,消融组术后CEA、GPC3、AFP 水平与切除组比较无差异,提示超声引导下射频消融与微创切除术在杀伤肿瘤细胞上具有相似的效果。本研究结果显示,消融组术后ALT、AST、TBIL 均低于切除组,提示相比腹腔镜肝切除术,射频消融可减少对肝功能的损伤。究其原因在于射频消融操作简单便捷,无需切除肝脏,避免手术切除对肝脏的不必要损伤。同时,在超声引导下可对肿瘤位置、深度、宽度精准定位,使消融针穿刺至最满意的位置,达到最佳消融效果[16-17]。
CTC 是指从肿瘤上脱落并进入人体外周血的肿瘤细胞,该类细胞与肿瘤细胞同样具有高度异质性。部分CTC 可产生新的肿瘤,表现出癌症干细胞的特性,部分则无病灶转移风险,因此,CTC 在一定程度上可提示肿瘤病灶转移、复发风险,远端是否有肿瘤存在[18]。HGF 是一种多功能因子,对多种细胞生长、运动、形态具有一定的调节作用,可刺激肝细胞的增殖分化。同时,HGF 还可促使干细胞及其他细胞的生长,对各类肿瘤的侵袭转移具有诱导作用[19-20]。本研究结果显示,消融组术后HGF、CTC水平均低于切除组,提示超声引导下射频消融治疗小肝癌可在一定程度上降低血清HGF、CTC 水平,超声引导下射频消融在减少术后复发转移方面具有一定优势。究其原因可能与以下几点有关:①在腹腔镜肝部分切除过程中,可能由于各种原因导致肿瘤细胞脱落,细胞腹腔种植或进入循环系统;②射频消融术后经影像学检查若有残余,还可立即再次消融,甚至多次消融;③本研究中射频消融范围尽可能覆盖病灶周围1 cm,保证足够消融范围,保证消融的彻底性;④在超声引导下可有效降低肿瘤破裂风险,并避免消融导致的肿瘤扩散[21-22]。但本研究结果显示,两组术后3年复发率无差异,可能与本研究样本数量过少、随访时间过短等自身因素有关,仍需进一步研究论证。
综上所述,与微创切除术相比,超声引导下射频消融治疗小肝癌在减少肝功能损伤及术后并发症方面具有一定优势,且可在一定程度上降低HGF 和CTC水平,但两者具有相似的远期预后效果。

