转录组分析布鲁氏杆菌患者外周血免疫基因的表达情况
白贺霞,左明明,盘晓芳,赵新芳,韩璇雪
布鲁氏杆菌病是世界上最常见的人兽共患传染病之一,每年有 50多万人感染布鲁氏杆菌病。尽管人们已经努力尝试控制布鲁氏杆菌病的传播,但它仍然世界上大多数地方流行,特别是在发展中国家[1-3]。布鲁氏杆菌病是由布鲁氏杆菌引起的[4-6],人类是这种细菌的随机宿主。我国所有省市自治区均有人感染布鲁氏杆菌的病例报告,但发病人群仍以牧民为主。近些年来,新疆地区人和家畜的布鲁氏杆菌病发病率均呈急速的高发病趋势,据不完全统计每年新疆因布鲁氏杆菌病导致的直接经济损失可达上亿元。
人类免疫系统与布鲁氏杆菌之间的相互作用对于病原体的清除或存活是必不可少的[7-8]。先天免疫和适应性免疫反应都参与了对布鲁氏杆菌感染的防控,这主要依赖于细胞介导的免疫反应。因此,抗原提呈细胞(巨噬细胞和树突状细胞)的贡献以及CD4和CD8T淋巴细胞的诱导在这些免疫反应中起着至关重要的作用。大量证据及经验表明,复杂疾病的特征受到多个基因相互作用的共同影响[9-12]。而目前对布鲁氏杆菌病的免疫分子失调机制仍然未达成共识。需要更深入的研究来探讨布鲁氏杆菌感染过程中的免疫分子失调以及潜在的调控机制。
本文从GEO数据库中获取布鲁氏杆菌病患者和对照组的基因表达谱数据,整合了对布鲁氏杆菌病患者和健康人的外周血的免疫相关差异表达基因。通过生物信息学分析方法探讨布鲁氏杆菌病的关键失调免疫基因和分子机制。
1 材料与方法
1.1 数据来源 从美国国家生物信息中心(NCBI,https://www.ncbi.nlm.nih.gov/)GEO公共数据库调取GSE69597获取布鲁氏杆菌病人及健康对照的全血转录组表达数据。
1.2 差异免疫基因的鉴定 使用R语言DESeq2对布鲁氏杆菌病患者和对照之间的基因表达进行差异分析,设置筛选条件P<0.05鉴定差异表达基因(DEGs)。使用immport数据库调取差异表达基因中免疫相关的基因集(immune-DEGs)。
1.3 免疫基因集GO和KEGG富集分析 使用Enrichr(http://amp.pharm.mssm.edu/Enrichr/)在线富集工具对鉴定到的immune-DEGs进行生物功能(GO)和KEGG信号途径分析。P<0.05为富集有统计学意义。
1.4 免疫基因集蛋白网络互作分析(PPI)及核心(hub)调控基因的鉴定 我们将immune-DEGs上传到STRING数据库,并筛选综合得分>0.4的蛋白质-蛋白质互作(PPI)网络。用Cytoscape软件(3.8.0版)鉴定PPI网络中连接度最高的前10个基因为核心(hub)基因。
1.5 ROC曲线 我们使用SPSS 24.0对hub基因进行受试者工作特征(Receiver Operating Characteristic,ROC)曲线分析。曲线下面积越大,则基因的诊断能力越强。
1.6 样本收集 各收集10例急性期首次确诊的布鲁氏杆菌患者及健康对照的外周血样本。所有的样本均获得了患者的知情同意并获得了昌吉市人民医院的伦理委员会批准。
1.7 实时定量PCR(qRTPCR)检测TNF和IFNG的mRNA水平 利用Trizol(Invitrogen)制备20例外周血样本的总RNA。根据制造商的说明利用PrimescriptTMRT Reagent Kit(TaKaRa)逆转录为cDNA。用SYBR Premix Ex TaqTM(TaKaRa)试剂盒进行qRTPCR反应。以GAPDH 为内参基因,使用2-ΔΔCT的方法进行数据分析。所有的实验均进行了3次重复。
1.8 单样本基因集富集分析(ssGSEA) 我们使用ssGSEA算法来评估布鲁氏杆菌患者及对照的全血中28种免疫细胞的免疫评分。P<0.05表明布鲁氏杆菌患者与对照组之间的免疫细胞含量差异有统计学意义。
1.9 流式细胞术检测Th1/Th2/Th17细胞和Treg细胞比例 取5例布鲁氏杆菌患者和5例健康对照的100 μL EDTA抗凝外周血加入流式管中,分别加入5 μL流式抗体CD4-PECY7、CD25-BB515和CD127-PE用作Treg细胞的检测;CD4-FITC、CD183-PECY5和CD196-PE用作Th1/Th2/Th17细胞的检测,抗体均购自美国BD公司,混匀室温避光孵育15 min后,加入溶血素2 mL。室温孵育5 min后,1 500 r/min离心5 min,PBS洗1遍后,加入300 μL PBS重悬上流式机(美国贝克曼,DXflex)检测。
2 结 果
2.1 差异免疫基因的鉴定 我们共鉴定到布鲁氏杆菌病患者与对照之间的差异表达的基因(P<0.05)有4 924个,其中上调表达基因2 510个,下调基因2 414个。通过immport数据库筛选出免疫相关的差异表达基因共390个,上调基因208个,下调基因182个。见表1,展示了上调和下调变化倍数最大的前十个差异表达基因。
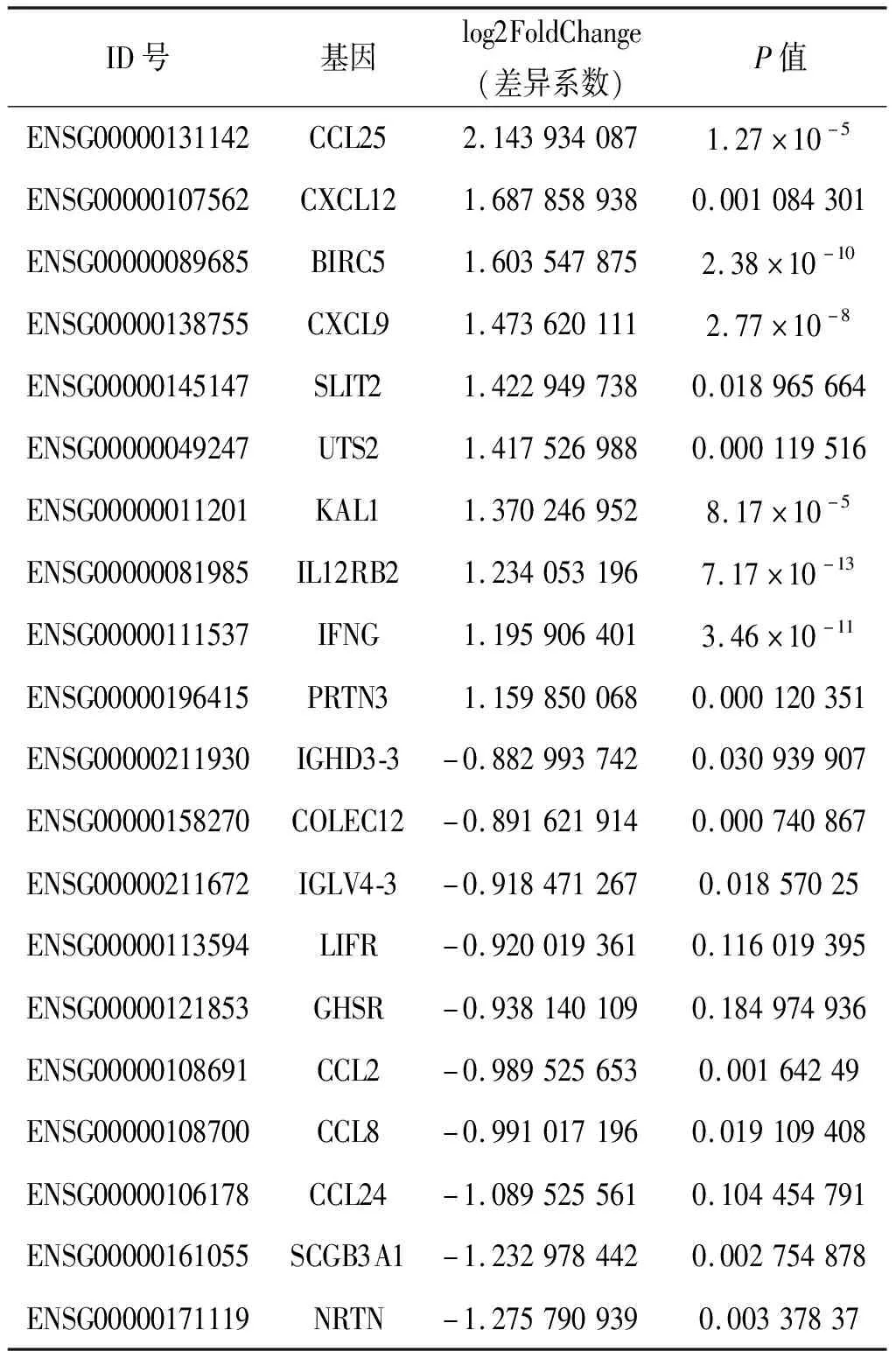
表1 差异表达基因
2.2 免疫基因的GO和KEGG富集分析 GO功能注释分析结果表明,对于390个 免疫相关mRNAs的靶点,生物过程(BP)最丰富的术语是“cytokine-mediated signaling pathway(细胞因子介导的信号通路)”(图1A)和“cellular response to cytokine stimulus(细胞对细胞因子刺激的反应)”,细胞组分(CC)中的“integral component of plasma membrane(质膜的组成部分)”和“T cell receptor complex(T细胞受体复合物)”(图1B),以及分子功能(MF)中的“cytokine receptor activity(细胞因子受体活性)”和“protein tyrosine kinase activity(蛋白酪氨酸激酶活性)”(图1C)。KEGG途径分析结果表明,富集最高的几条通路是T cell receptor signaling pathway(T细胞受体信号通路),B cell re-ceptor signaling pathway(B细胞受体信号通路),Th17 cell differentiation(Th17细胞分化)(图1D)。

注:A差异基因参与的生物学进程;B差异基因参与的细胞成分;C差异基因参与的分子功能;D差异基因参与的信号通路
2.3 免疫基因集PPI和hub基因的鉴定 为了在上述390个免疫相关差异表达基因中识别hub基因,我们筛选了在PPI网络中连接度最大的前10个基因(图2A)。包括TNF、IL6、AKT1、IL4、TLR4、CTLA4、IFNG、STAT1、TLR2和CD86。与正常对照(Control)组相比,IFNG、STAT1、CTLA4和TNF在布鲁氏杆菌患者组中显著高表达,其余的则是低表达(图2B)。
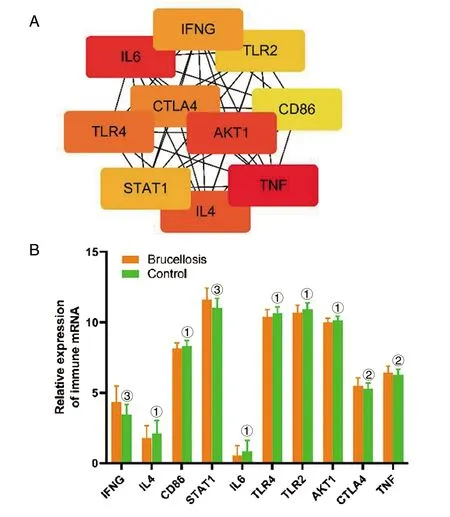
A:预测到的hub基因;B:预测的hub基因mRNA表达水平柱状图;①:P<0.05;②:P<0.01;③:P<0.001。
2.4hub基因的ROC曲线 ROC曲线结果显示,IFNG的曲线下面积大于0.7,说明其对布鲁氏杆菌病具有良好的诊断意义,其余基因的曲线下面积均小于0.7,见图3。
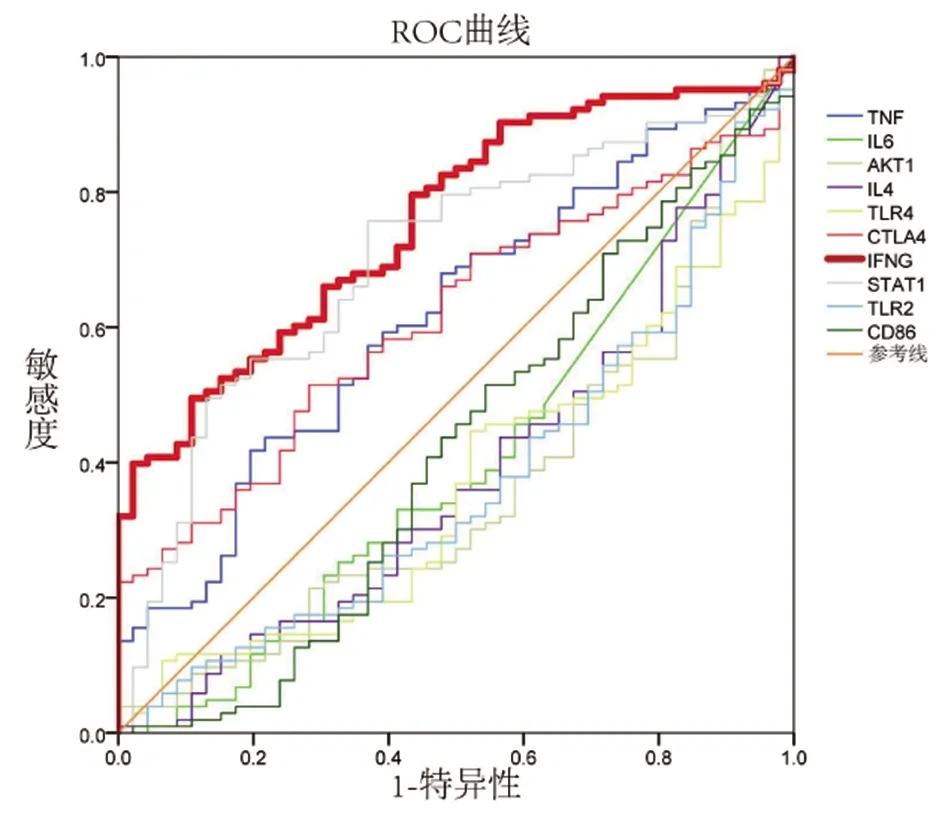
图3 hub基因ROC曲线
2.5 关键基因的验证 收集布鲁氏杆菌病患者和健康对照的外周血样本,利用qRTPCR的实验方法检测IFNG和TNF的mRNA水平。结果发现,与对照组比较,IFNG和TNF在布鲁氏杆菌病患者中表达上调有统计学意义(P<0.05)(图4)。进一步说明他们对布鲁氏杆菌病具有良好的诊断意义。

①:P<0.001
2.6 单样本基因集富集分析(ssGSEA) 单样本基因集富集分析结果显示全血中与control(对照组)组相比Activated CD4T(活化型CD4T细胞)、Effector memeory CD4T(效应型CD4T细胞)、Effector memeory CD8T(效应记忆型CD8T细胞)、Type 2 T helper(2型T辅助细胞因子-Th2)在布鲁氏杆菌病患者组有显著上升;而效应型B细胞(Activated B)、嗜酸性粒细胞(Eosinophil)、未成熟B(Immature B)、巨噬细胞(Macrophage)、记忆B(Memory B)、自然杀伤T细胞(Natural killer T,NKT)、中性粒细胞(Neutrophil)、浆细胞树突状细胞(Plasmacytoid dendritic)、调节性T细胞-Treg(Regulatory T)则下降,见图5。

①:P<0.05;②:P<0.01;③:P<0.001;ns:无差别
2.7 流式细胞术验证Th1/Th2/Th17细胞和Treg细胞比例 流式结果显示,与健康对照组相比,布鲁氏杆菌病患者外周血中Th2和Th17细胞比例增高,而Th1细胞和Treg细胞比例则降低,见图6。

A:Th1/Th2/Th17细胞比例;B:Treg细胞比例
3 讨 论
随着全球对布鲁氏杆菌病研究的深入,发现免疫损伤在该病的发生发展,尤其是慢性化中起重要作用[13]。宿主免疫反应在功能上分为先天性和适应性免疫。而布鲁氏杆菌为胞内寄生菌,故以适应性细胞免疫为主[14]。而适应性免疫由T淋巴细胞(细胞免疫)以及B淋巴细胞(体液免疫)组成[15]。我们的分析结果发现,活化和未成熟型B细胞在布鲁氏杆菌患者显著低表达,而活化的CD4+T细胞和CD8+T细胞均在人布鲁氏杆菌病患者中显著高表达。布鲁氏杆菌感染宿主后,人体对病原学的清除,主要是T淋巴细胞在其中发挥了关键作用。T淋巴细胞由不同的细胞亚群组成,各亚群T细胞通过分泌动态平衡的多种不同细胞因子来维持人体正常的免疫功能,一旦这种平衡被打破就可以导致机体内免疫紊乱[16]。作为适应性免疫应答的一部分,CD8+T细胞通过鉴定和杀死受损宿主细胞来控制细胞内感染[17-18]。CD4+T细胞在外来抗原作用下分化为各种效应T细胞参与免疫应答。Zheng等[19]研究发现,与健康受试者个体相比,人布鲁氏杆菌病患者中CD4+T细胞和CD8+T细胞的比例显著升高。因此,我们认为人布鲁氏杆菌病患者存在T淋巴细胞免疫功能异常,CD4+T和CD8+T细胞可能是影响布鲁氏杆菌病进展的重要因素。
另一方面,本研究通过PPI网络鉴定了10个hub基因。其中,IFN-γ和TNF在布鲁氏菌病患者中显著高表达,TNF在PPI网络中处于最核心的调控地位。当人体感染病原体后,在不同的细胞因子和环境作用下,CD4+T细胞可以分化成不同类型细胞,如Thl,Th2,Thl7,Treg等细胞亚群释放IFN、TNF、IL-4等细胞因子,进一步诱导细胞免疫或体液免疫应答[20]。在Mosmann描述Th1/Th2“二分法”概念中,布鲁氏杆菌病再次被用作感染与干扰素-γ(IFN-γ)产生相关的模型[21]。因此,细胞免疫和Th1细胞因子(IFN-γ,肿瘤坏死因子α)在布鲁氏杆菌感染结果中的关键作用得到了证实。而本研究通过ROC曲线同样验证了这一结果。
在KEGG富集结果中鉴定了T 细胞受体信号通路和Th17细胞分化的显著富集。CD4+T细胞的三个亚群,Th1、Th2和Th17,是细胞内细菌免疫反应的中心参与者。IL-17A是Th17细胞产生的标志性细胞因子[22-25]。虽然Th1细胞在布鲁氏杆菌病中的保护作用已被证明,但确定Th17细胞在布鲁氏杆菌免疫中的确切作用正在成为一个活跃的研究领域。而我们的数据分析显示,Th17信号通路与布鲁氏杆菌病的发生发展有着密切关系。
综上所述,为了能更好的明确布鲁氏杆菌感染后宿主体内的免疫调控,为今后患者的有效诊治提供可靠的理论依据。我们通过生物信息学分析了布鲁氏杆菌感染对免疫的影响。鉴于宿主对布鲁氏杆菌的应答主要由免疫细胞介导,因此阐明感染患者体内免疫细胞的调控机制,以及明确调控宿主体内免疫细胞的靶点,可以为将来设计针对布鲁氏杆菌的药物和疫苗提供是至关重要的理论基础。
利益冲突:无

