DNA甲基化抑制剂在恶性淋巴瘤中的研究进展*
张新远 禇俊峰 严正 姚书娜 姚志华 刘艳艳
表观遗传学是一种在不改变基因序列的情况下,在细胞增殖和发育过程中发生的稳定变化,与基因表达潜能相关。DNA 甲基化是表观遗传事件之一,其是在DNA 碱基的碳5 位置上插入1 个CH3基团,导致转录抑制,进一步阻止抑癌基因的表达,促进肿瘤细胞的生长[1]。DNA 甲基转移酶(DNA methyltransferase,DNMTs)在此过程中发挥关键作用。当DNMT 作用于基因中富含双核苷酸“CG”的区域(称为“CpG 岛”)时,会发生CpG 岛的高甲基化,而高甲基化与许多淋巴造血系统疾病的发生密切相关[2]。与传统的化疗方案相比,DNA 甲基化抑制剂(DNA methyltransferase inhibitors,DNMTI)能够通过重新编码基因表达过程影响多种细胞的潜力,同时与其他药物存在协同作用,也能激活机体免疫反应[3-5]。
1 地西他滨治疗恶性淋巴瘤的进展
1.1 地西他滨治疗恶性淋巴瘤的基础研究进展
地西他滨(decitabine,DAC)以磷酸盐的形式与DNA 整合抑制DNA 甲基转移酶的活性,诱导肿瘤细胞凋亡[6],已被美国和欧洲批准用于治疗骨髓增生异常综合征(myelodysplastic syndromes,MDS)。DAC对不同亚型的恶性淋巴瘤调控的基因及机制不同。Jiang 等[7]指出,DAC 联合组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACI)可以通过上调抑癌基因PU.1 和KLF4 的表达来协同诱导霍奇金淋巴瘤(Hodgkin's lymphoma,HL)细胞的凋亡。Liu 等[8]在急性淋巴母细胞白血病的研究中发现,DAC 能使癌细胞的细胞周期阻滞在G0/G1 期,并上调抑癌基因LTF 和凋亡相关蛋白caspase-3 和caspase-9 的表达,促进癌细胞凋亡。
相比于单药治疗,地西他滨与不同类型化疗药物联合后能显著抑制肿瘤细胞生长。Swerev 等[9]研究发现,DAC 与Bcl-2、JAK-STAT、AKT 和NF-κB 抑制剂对HL 细胞具有协同抑制作用。Jain 等[10]在皮肤T 细胞淋巴瘤的研究中指出,地西他滨与MUC 1-C抑制剂Go-203 联用后能够促进活性氧的生成,抑制DNA 甲基化转移酶,导致淋巴瘤细胞的凋亡。Li等[11]研究发现,DAC 联合嵌合抗原受体T 细胞免疫疗法(chimeric antigen receptor T-cell immunotherapy,CAR-T)治疗能够上调淋巴瘤细胞表面抗原CD19 的表达,增强淋巴瘤细胞体外杀伤活性。张静楠等[12]报道,相比于单药DAC,DAC 联合硼替佐米能显著抑制套细胞淋巴瘤细胞的生长(P<0.01)。周怡等[13]研究指出,靶向药物索拉菲尼与DAC 能够协同抑制PI3KAKT 信号通路,调控凋亡相关指标P53、BAX/BCL2等的表达,显著拮抗弥漫性大B 细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)。
1.2 DAC 治疗恶性淋巴瘤的临床研究进展
HL 通过标准放化疗的方法可以使多数患者得到治愈,但仍有20%~30%的患者治疗失败,二线尽管采用挽救化疗联合自体干细胞移植,45%~55%的患者仍存在疾病复发或进展的风险[14]。Nie 等[15]进行的一项评估程序性死亡受体1(programmed cell death protein 1,PD-1)抑制剂卡瑞丽珠单抗(camrelizumab)对比联合地西他滨的安全性和有效性的Ⅱ期研究纳入86例复发难治性HL 患者,按照1︰2 的比例随机分入camrelizumab单药组或联合DAC 组,每21 天为1 个疗程。既往PD-1 抑制剂治疗失败者被分入联合治疗组。结果显示,86例患者均可评估疗效,中位随访为14.9 个月。PD-1 抑制剂初治患者中,单药组和联合组的完全缓解(complete response,CR)率分别为32%(6/19)和71%(30/42),P=0.003。6 个月持续缓解率分别为76%和100%。既往PD-1 抑制剂单药治疗失败的患者中(n=25)应用DAC 联合卡瑞丽珠单抗组的CR 为28%,部分缓解(partial response,PR)率为24%;其中10例持续缓解时间超过6 个月,治疗有效的患者1年后的缓解率(CR+PR)仍有81%。最常见的不良事件为毛细血管增生症和白细胞减少,且均为自限性。该研究提示DAC 联合PD-1 抑制剂治疗复发难治性HL 具有显著的有效性和耐受性,为挽救方案提供了新的选择。
NK/T 细胞淋巴瘤(NK/T cell lymphoma)患者的预后因SMILE、P-GEMOX 方案的出现有所好转,而将近50%的患者在一线方案治疗后仍出现复发。刘晓等[16]开展的一项Ⅱ期临床试验纳入40例急性白血病合并T/NK 细胞淋巴瘤患者,研究组(n=20)在含有阿糖胞苷+阿克拉霉素的方案中加入DAC。结果显示,研究组患者的有效率(CR+PR) 优于对照组(85.0%vs.55.0%,P<0.05),且研究组非血液学不良反应发生率、血液学感染概率以及凝血功能情况均好于对照组。该研究说明,DAC 联合方案明显降低了相关不良反应的发生率且疗效显著。
急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)的化疗方案研究通常着力于减少患者的不良反应。Cui 等[17]对12例造血干细胞移植后复发的急性淋巴细胞白血病患者分别给予联合方案(9例)及DAC 单药(3例)的治疗,其中10例达到CR,中位生存期(median overall survival,mOS)为11.2(3.8~34.0)个月,1、2年生存率分别为50%和25%,且费城染色体阳性者(5例)生存率高于阴性者(3例)(57.1%vs.20.0%),所有患者均未发生治疗相关性不良反应,均对DAC 具有耐受性。
2 阿扎胞苷治疗恶性淋巴瘤的进展
2.1 阿扎胞苷治疗恶性淋巴瘤的基础研究进展
阿扎胞苷(5-azacitidine,AZA)已被国外批准作为骨髓增生异常综合征和急/慢性髓系白血病的治疗药物。与地西他滨的区别在于,AZA 具有核糖糖环(地西他滨以脱氧核糖作为糖基),是一种与RNA 结合的核糖结构,其需要通过核糖核苷酸还原酶(ribonucleotide reductas,RNR)的活性进入DNA 发挥去甲基化作用,且发挥相同作用时,AZA 的药物浓度比地西他滨大10 倍[18-19]。最新的体外研究表明,AZA能诱导肿瘤抑制基因(protein tyrosine phosphataselike 1,PTPL1)[20]的去甲基化抑制非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)细胞的生长。传统的化疗药物三氧化二砷与AZA 在治疗套细胞淋巴瘤中具有协同抑制DNMT 的作用[21],也表现出DNMTIs的活性。
2.2 AZA 治疗恶性淋巴瘤的临床研究进展
DLBCL 是一组最常见的、具有高度异质性的恶性肿瘤,标准化疗能使超过半数的患者获得长期生存或治愈,但是复发或难治性患者仍具有较大的挑战。Clozel 等[22]对12例DLBCL 患者在开始R-CHOP 方案前给予AZA 治疗,结果有92%(11/12)的患者达CR,在mOS 为13 个月的随访中,10例患者处于缓解状态。Martin 等[23]将AZA 联合R-CHOP 用于33例DLBCL 和滤泡型淋巴瘤(follicular lymphoma,FL)患者,97%(32/33)患者获得缓解,且IPI 评分较高的与IPI 评分较低的患者有相近的无进展生存期(prog ression-free survival,PFS)(84%vs.89%),所有患者均出现3 级或4 级中性粒细胞减少症。上述2 项研究结果提示,AZA 联合R-CHOP 方案能有效改善DLBCL 患者的不良预后。Pera 等[24]开展了AZA 与HDACI 联合治疗复发难治性DLBCL 患者的Ⅰb 期临床试验,该研究纳入18例患者,其中5例剂量耐受性差,17例出现疾病进展,因此该试验提前结束。提示AZA 与药物联用时要加以选择。
大剂量的化疗联合自体干细胞移植为部分复发NHL 和HL 的标准治疗方案,但这种方案存在许多不良反应,部分患者的预后较差。因此,亟需开展临床试验探索新的治疗模式。本研究在前期的体外研究中发现HDACI 和DNA 甲基化抑制剂可协同诱导肿瘤细胞凋亡。在此基础上,Nieto 等[25]对60例复发/高风险的淋巴瘤患者(其中DLBCL 26例,HL 21例,T 细胞淋巴瘤8例,其他B 细胞淋巴瘤5例)开展了AZA 与伏立诺他(HDAC 抑制剂)联合吉西他滨、美法仑、白消安和利妥昔单抗的试验性治疗,在mOS 为15 个月的随访中,DLBCL 患者的无事件生存率(event-free survival,EFS)和总生存率(overall survival,OS)分别为65% 和77%,其在HL 患者中的比例分别为76%和95%。在T 细胞淋巴瘤患者中,两者的比例均为88%,仅2例患者死于治疗并发证(呼吸道合胞病毒肺炎和脓毒症),黏膜炎和皮炎这2 个药物不良反应是可控的。该方案证实了双表观遗传药物联合对于复发难治性淋巴瘤的有效性及安全性。
血管免疫母T 细胞淋巴瘤(angioimmunoblastic T-cell lymphoma,AITL)是一种预后较差的外周T 细胞淋巴瘤(peripheral T-cell lymphoma,PTCL),其5年无失败生存率(failure-free survival,FFS)不足20%[26],至今标准的化疗方案仍未达成共识。Lem onnier 等[27]对12例接受AZA 单药治疗(75 mg/m2)的AITL 患者进行了回顾性分析,中位治疗周期为5.50(3.75~17.00)天,客观缓解率(objective response rate,ORR)为75%(9/12),其中CR 为50%(6/12),PR为25%(3/12),不良反应为神经病变(1例)、腹泻(1例)和贫血(3例),未出现发热性中性粒细胞减少和治疗相关死亡。此方案具有较高的有效性和安全性,但入组病例数较少。 PTCL 为一组罕见的具有不良预后的恶性疾病,其5年OS 约为30%,以CHOP(E)方案为一线方案的治疗仍使其有很高的复发率。O'Connor 等[28]对31例淋巴瘤患者给予AZA 联合罗米地辛(HDACI)。结果显示,外周T 细胞淋巴瘤患者的ORR 和CR 为73%(8/11)和55%(6/11),显著高于非T 细胞淋巴瘤患者的10%(2/10)和5%(1/20),且中位FPS(median PFS,mPFS)较非T 细胞淋巴瘤患者长。该方案治疗PTCL 具有较高的敏感性和特异性,但鉴于该类淋巴瘤易复发的特点,需要进行随访观察其长期效果,见表1。
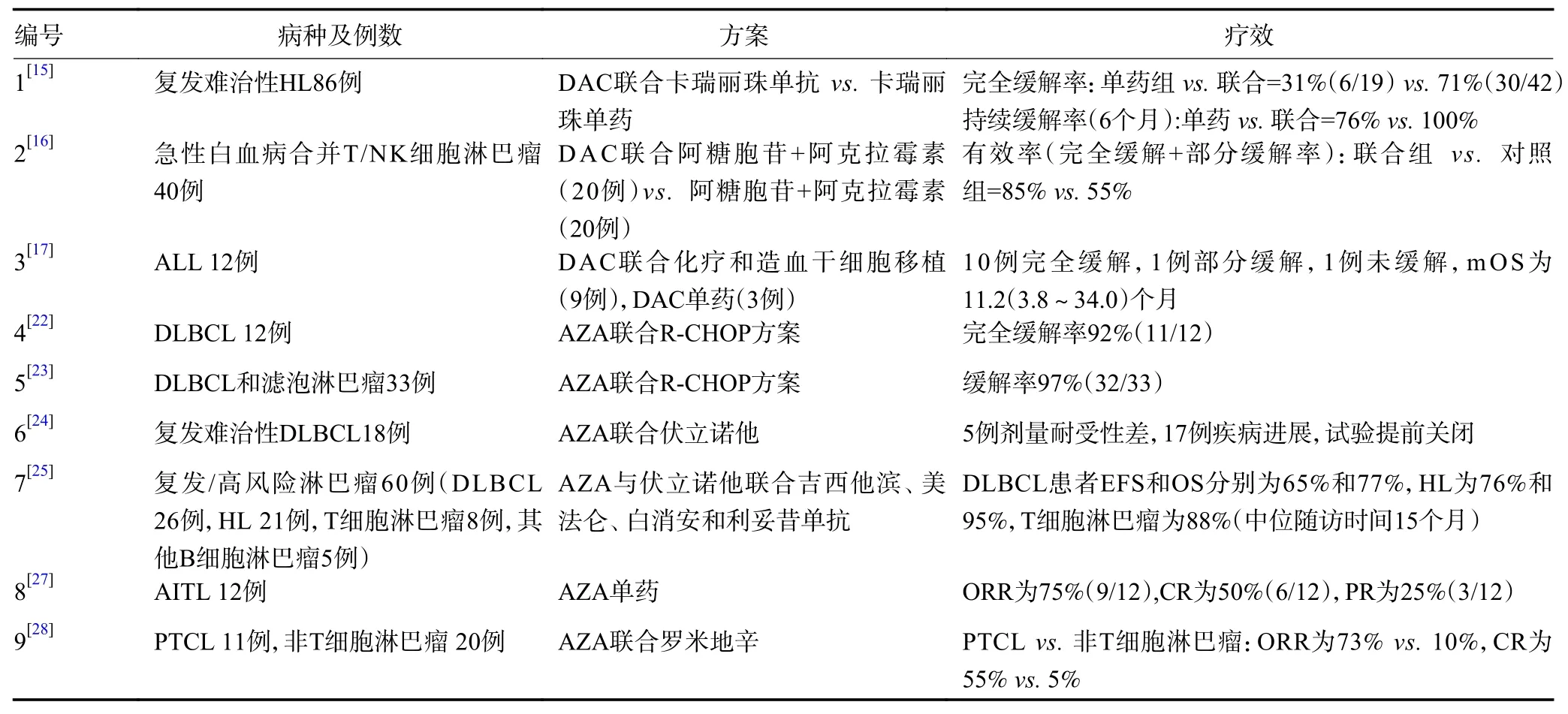
表1 DNA 甲基化抑制剂在恶性淋巴瘤中的临床研究
3 其他DNMTIs
DNA 甲基化抑制剂泽布拉林(zebularine)不仅能抑制DNA 甲基转移酶,而且能够抑制拮抗核苷类DNMTI 的胞苷脱氨酶(cytidine deaminase,CDA),相比于DAC 和AZA 具有更显著的稳定性和安全性[29]。第二代DNMTI 瓜地西他滨(guadecitabine,SGI-110)由DAC 和脱氧鸟苷组成,其中的磷酸二酯键导致成分中DAC 的释放速度更慢,使其具有更长的半衰周期,与DAC 相比能显著提高疾病的疗效和安全性[30]。近年来有关两者在恶性淋巴瘤的研究数量有限,需要进行大量的对比和探究性试验验证其效果。
4 结语
以AZA 和DAC 为代表的DNA 甲基化抑制剂在恶性淋巴瘤的治疗中具有显著作用。新的去甲基化位点及机制的探索将成为相关临床研究的重要前提。新一代DNMTI 所表现出的稳定性和安全性将明显改善患者的预后。目前,亟需解决下述问题:1)DNA 甲基化抑制剂在临床试验中所纳入的病例数较少,部分亚型的淋巴瘤仍缺乏研究来证实其治疗效果,有必要开展大样本的Ⅱ、Ⅲ期研究评估药物和方案的稳定性;2)第二代DNMTI 需要设计与DAC 和AZA 的对照试验来证实其优越性;3)DNA 甲基化抑制剂对于肿瘤免疫微环境的调控也是其作用方式之一。新的临床试验仍在进行中,如DAC 联合CHOP 治疗外周T 细胞淋巴瘤(clinicalTrials.gov Identifier:NCT03553537),AZA 联合R-ICE 方案(利妥昔单抗、依托泊苷、卡铂和异环磷酰胺)治疗复发/难治弥漫性DLBCL(NCT03450343),AZA 联合西达本胺治疗PTCL(NCT04480125)等。通过更多的Ⅱ、Ⅲ期临床试验,其治疗的最佳剂量、效果和不良反应均得到证实。随着相关研究的深入探索,DNA 甲基化抑制剂必将成为治疗恶性淋巴瘤的新选择。

