内镜黏膜下剥离术及全层切除术治疗胃黏膜下肿瘤的临床效果分析
徐兆军 张予蜀 张振玉
消化道黏膜下肿瘤是指起源于消化道黏膜肌层、黏膜下层或固有肌层的隆起性病变[1],以胃黏膜下肿瘤最常见。既往针对此类病变采取内镜治疗较困难,容易发生出血、穿孔等严重并发症,多采用外科开腹手术或腹腔镜手术切除。近几年,随着内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)及内镜全层切除术(endoscopic full-thickness resection,EFR)等新型内镜手术方式的出现,使得消化道黏膜下肿瘤内镜切除在大型内镜中心逐渐普及。本研究回顾分析南京医科大学附属南京医院近年来开展的ESD 及EFR 治疗胃黏膜下瘤病例,探讨ESD 及EFR 技术的疗效和安全性。
1 材料与方法
1.1 病例资料
收集2015年1月至2019年12月在南京医科大学附属南京医院住院采用ESD 及EFR 两种内镜切除术的胃黏膜下肿瘤病例。病例内镜手术纳入标准:1)患者年龄≥18 岁;2)术前经胃镜、超声内镜及CT检查诊断肿瘤起源于胃黏膜肌层、黏膜下层、肌层,肿瘤直径小于5 cm。排除标准:1)肿瘤直径超过5 cm;2)患者有严重心肺脑血管疾病;3)凝血功能异常;4)肿瘤发生淋巴结或腹腔、肝脏等转移。术前超声内镜或CT 检查提示肿瘤突向胃壁外生长的或术中肿瘤发现紧贴浆膜或与浆膜层粘连者采取EFR,对于起源于黏膜肌层、黏膜下层或肌层较浅的病变采取ESD。最后共有109例病例纳入研究,ESD 组62例患者,其中男性22例,女性40例;EFR 组47例患者,其中男1 性4例,女性33例(表1)。所有患者入院后均完善检查,术前充分沟通,签署内镜手术同意书。
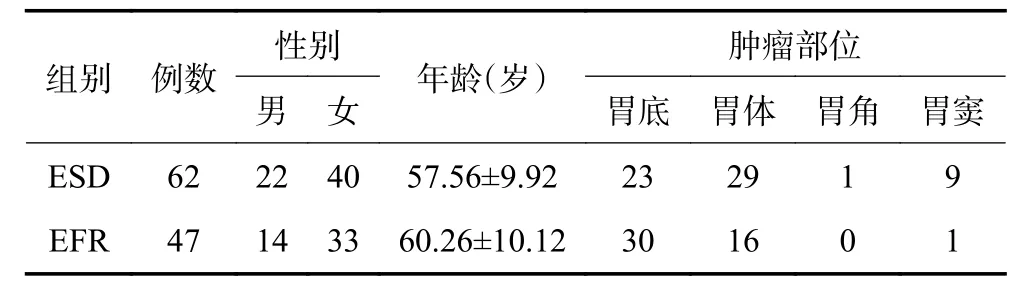
表1 EFR 组及ESD 组胃黏膜下肿瘤患者基线资料
1.2 方法
1.2.1 内镜设备和器械 EG29-i10 内镜、3 870 纵轴超声内镜购自日本Pentax 公司,GIF-Q260J 内镜、内镜下注射针(NM-4L-1)、 IT 刀(KD-611L)、Dual 刀、热止血钳(FD- 410LR)、止血夹(HX-600-90)购自日本Olympus 公司,超声小探头SP702 购自日本富士公司,高频电刀JSDD-Y3、AGS CR4500 型内镜用CO2送气装置购自重庆金山公司,和谐夹购自南京微创公司。
1.2.2 手术过程 ESD:1)所有手术均安排在手术室全麻气管插管下进行,术前8 小时禁食禁饮,患者取左侧卧位,胃镜头端预置透明帽, 插镜入胃腔后,大量生理盐水、链霉蛋白酶、西甲硅油冲洗胃腔;2)观察到病变后,黏膜下注射靛胭脂、肾上腺素、生理盐水混合溶液, 使黏膜隆起;3)Dual 刀沿病灶周围切开黏膜,剥离黏膜下层;4)暴露黏膜下肿瘤,沿肿瘤周缘及基底剥离,完整切除肿瘤,将瘤体带出体外,观察腹部体征判断有无穿孔,若有穿孔,在右下腹麦氏点用20 mL 空针腹腔穿刺排气;5)热止血钳处理创面出血部位及裸露血管,根据病变剥离深浅及肌层损伤程度,决定是否封闭创面,闭合创面或穿孔可采用金属夹夹闭或金属夹联合尼龙绳荷包缝合两种方案之一,部分患者留置鼻胃管,后结束手术;6)测量肿瘤大小, 切除肿瘤标本送病理及免疫组化明确诊断。
EFR:前3 步和第6 步同ESD;4)Dual 刀联合IT-2 行病灶环周全层切除,切除时尽量保持肿瘤瘤体包膜完整,避免切除病变掉入腹腔,术中随时吸出冲洗胃腔液体,尽量避免或减少冲洗液流入腹腔,将瘤体带出体外,观察腹腔积气情况,在右下腹麦氏点用20 mL空针腹腔穿刺排气;5)热止血钳电凝处理出血部位及裸露血管,仔细观察无出血后,采用金属夹夹闭或金属夹联合尼龙绳荷包缝合两种方案之一,缝合封闭穿孔,观察创面无漏气,所有患者均留置鼻胃管,结束手术。ESD 及EFR 手术过程(图1)。
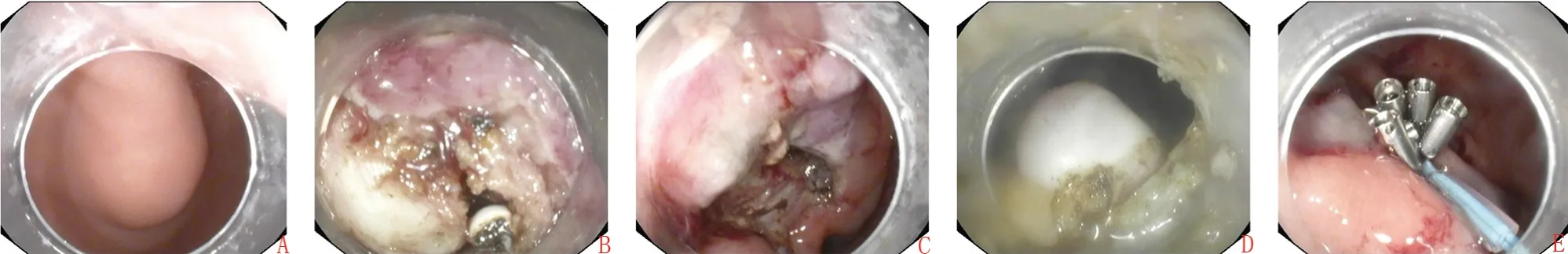
图1 ESD、EFR 内镜手术图片
1.2.3 术后处理 术后禁食3 天、卧床、吸氧、监护,观察患者症状体征,有无腹痛、呕血、黑便、胸闷、胸痛、呼吸困难,以及皮下气肿、发热等。若有腹痛、胸闷、呼吸困难等,及时行腹部CT 排除消化道穿孔,常规予抑酸、补液、营养支持等治疗,发生穿孔的加用抗生素。
1.2.4 观察指标及术后随访 记录2 组患者手术时间、术中出血量、创面或穿孔的处理方式、术后住院时间、术后肿瘤大小、病理结果。术后密切随访,术后3、6、12、24 个月复查胃镜,观察肿瘤有无残留及复发情况。
1.3 统计学分析
采用SSPS 21.0 软件进行统计学分析,计量资料采用x±s表示。
2 结果
2.1 围手术期情况
ESD 组61例完成手术,完整切除肿瘤,EFR 组46例完成手术,完整切除肿瘤。两组各有1例因肿瘤过大切除困难,术中转外科腹腔镜手术。ESD 组中7例术中发生穿孔,采用金属夹+尼龙绳闭合穿孔,缝合创面,ESD 组1例因肿瘤过大,无法通过贲门,用圈套器未通电情况下将肿瘤冷切为两块病灶取出。在术后并发症方面,ESD 组5例发热,EFR 组有4例发热,ESD 组2例术后第2 天迟发性出血,EFR 组中1例术后第二天发生迟发性出血,均再次予内镜下金属夹止血成功。ESD 组中2例金属夹封闭创面的术后24 h后发生迟发性穿孔,再次内镜下金属夹+尼龙绳封闭穿孔。ESD 组术后有5例并发轻度腹膜炎,EFR 组有3例轻度腹膜炎,予积极抗感染治疗,1~5 天症状均消失(表2,3)。

表2 EFR 组及ESD 组胃黏膜下肿瘤患者手术情况

表3 EFR 组及ESD 组胃黏膜下肿瘤患者术后情况
2.2 术后病理情况
术后病理及免疫组织化学诊断:EFR 组病理有间质瘤、平滑肌瘤、脂肪瘤、异位胰腺、钙化性纤维性假瘤、神经鞘瘤,ESD 组有间质瘤、平滑肌瘤、脂肪瘤、异位胰腺、炎性纤维母细胞瘤、神经鞘瘤、异位胆总管、深在性囊性胃炎。两组均以间质瘤最多见,其次为平滑肌瘤(表4)。
2.3 术后随访情况
所有患者术后按组3、6、12、24 个月进行随访复查胃镜,随访时间6~24 个月,胃镜复查均示切口愈合, 原病变处无残留及复发,两组无相关死亡病例。
3 讨论
随着内镜检查的普及,胃黏膜下肿瘤检出率大大提高[2]。胃黏膜下肿瘤大多无特异性症状,其中具有恶性潜能的胃黏膜下肿瘤,如间质瘤,随着肿瘤体积增大可能会出现腹痛,甚至肿瘤破溃出现呕血、黑便等消化道出血症状[3]。既往针对直径小于2cm 的胃黏膜下肿瘤一般建议定期内镜复查随访[3]。但部分胃黏膜下肿瘤具有恶变风险,定期内镜复查也给患者带来了经济负担及巨大的精神压力[4]。传统上外科腹腔镜或开腹手术是胃黏膜下肿瘤首选治疗方法,但外科手术通常需要扩大切除病灶,会切除额外正常胃组织,如靠近贲门或幽门的病变需要切除贲门、幽门重新吻合,术后易出现反流、狭窄等并发症,严重影响患者生存质量,若肿瘤较小,或病灶位于后壁或靠近贲门,术中也难以找到病变,需要术中内镜配合[5-6]。而内镜切除对较小的胃黏膜下肿瘤不存在无法定位问题,可以减少正常胃组织的切除[7]。近几年内镜切除技术快速进展,出现了ESD 及其衍生技术,使胃黏膜下肿瘤通过内镜安全切除成为可能。杨文娟等[8]认为,与传统外科手术比较,内镜手术有着很大的微创优势,且可达到与开放手术相同的根治效果。2007年,周平红等[9]首次采用ESD 治疗上消化道黏膜下肿瘤。随着内镜缝合技术的进步,周平红等[10]又在ESD 的基础上,提出无腹腔镜辅助的EFR 治疗胃黏膜下肿瘤。2018年《中国消化道黏膜下肿瘤内镜诊治专家共识》提出对于黏膜下肿瘤,在内镜切除技术允许的前提下,可考虑行内镜切除[11]。近几年不论是医生还是患者,也逐渐接受了采用内镜微创手术切除此类肿瘤[12]。超声内镜检查可以判断胃黏膜下肿瘤位于胃壁层次,且可穿刺获取病理,但对于有恶变潜能的间质瘤会增加肿瘤种植播散及出血风险,需手术治疗的一般不建议常规穿刺活检[13]。术前常规行超声内镜及CT 检查,判断肿瘤是否紧贴浆膜层及是否向胃壁外生长,为ESD 或EFR 手术方式选择做准备。对于不规则病变,如呈哑铃状或蟹足样生长的肿瘤,超声内镜对病灶大小不能准确判断,有两例患者术中发现肿瘤明显偏大,无法切除,中转外科。内镜切除胃黏膜下肿瘤常见并发症为出血、穿孔、腹腔感染。出血分为术中出血及术后迟发性出血。内镜手术中基本上都是极少量或轻度出血,内镜手术中可以精准创面及血管,及时处理凝固血管,预防出血,术中发现出血,均予电凝成功止血,术后EFR 及ESD 分别有1例及2例迟发性出血,均经再次内镜下金属夹止血,出血控制,说明EFR 及ESD 术中及术后出血是可控的,预防出血关键是术中黏膜切开及剥离时发现血管及时处理,病灶切除后创面血管残端充分处理,电凝效果不确切的,可以通过金属夹夹闭。术中穿孔或术后迟发性穿孔,若未能及时有效处理,可能会引起严重后果。2004年,日本学者使用尼龙绳和钛夹联合用于闭合消化道全层缺损缝合获得成功,而后金属夹联合尼龙绳缝合辅助的ESD 技术被国内外医疗专家证实能有效缝合创面,为胃黏膜下肿瘤的治疗提供了新的思路[14]。本研究采用ESD 术中有7例发生被动穿孔,而EFR 术中需要主动穿孔完整切除肿瘤。早期封闭穿孔多采用尼龙绳加金属夹的荷包缝合技术,随着内镜技术的不断提高熟练,单用金属夹封闭穿孔的比例明显超过荷包缝合法。而对于术中未发生穿孔的ESD 较大创面采用金属夹夹闭或金属夹+尼龙绳的荷包缝合也可预防迟发性出血及穿孔,荷包缝合相较于金属夹封闭可能安全系数更高,本组研究ESD 组中2例术中采用金属夹封闭创面,术后次日发生迟发性穿孔,再次内镜下行荷包缝合,未需外科手术干预,术后经积极抗感染治疗,未出现严重腹腔感染。内镜手术难度与肿瘤大小有关,超过一定直径肿瘤无法经口取出。有学者指出,胃黏膜下肿瘤,特别是间质瘤的直径超过 3.5 cm 不适宜行内镜下治疗,建议外科手术或腹腔镜治疗[15]。本研究手术成功的患者肿瘤最大直径4.0 cm,共5例,其中4例顺利通过贲门、食管入口取出,而另一例无法通过贲门,用圈套器未通电切割成两块后分别取出,避免了术后病理切缘评估困难[16]。术后随访复查,肿瘤分块取出患者并未出现复发、转移。但仍建议内镜切除胃黏膜下肿瘤最好不要超过4.0 cm。术中尽量保持瘤体包膜完整,特别是间质瘤,尽量避免肿瘤破溃及掉入腹腔,以免引起肿瘤种植转移。随着内镜技术发展提高,各种创面缝合封闭技术的日益完善成熟,EFR 术中胃肠道内容物进入腹腔引起严重腹腔内感染的风险越来越少[17]。为减少穿孔发生率及控制穿孔创面大小,术中均采用CO2气泵,CO2可以很快被组织吸收,减少术后患者腹痛腹胀等不适[18]。在内镜术前常规冲洗胃腔,术中及时及尽量吸尽胃内液体,结合体位变换,术后予禁食、留置胃管行胃肠减压,加用质子泵抑制剂及抗生素。采取上述措施后,腹膜炎、腹腔感染等并发症的发生较少,而且均为轻症,予抗感染治疗很快好转,无需外科干预。本组研究术后病理类型较多,包括间质瘤、平滑肌瘤、脂肪瘤、异位胰腺、神经鞘瘤、钙化性纤维性假瘤、炎性纤维母细胞瘤、异位胆总管、深在性囊性胃炎。最常见的是间质瘤、平滑肌瘤,且基本位于胃底、胃体,与齐志鹏等报道一致[19]。

表4 EFR 组及ESD 组胃黏膜下肿瘤患者病理资料
综上所述,ESD 及EFR 治疗胃黏膜下肿瘤,特别是小于4.0 cm 肿瘤安全、有效,相较于外科开腹手术或腹腔镜明显具有创伤小、并发症少等优点,患者病情恢复快、住院时间短,值得临床推广应用。

