巨大多房前列腺囊腺瘤18F-FDG PET/CT显像一例
苑克慧 胡蓉 蓉 姚树林 符珍敏 施 彦坤 黄江山 杨超 王 卉
1解放军总医院海南医院核医学科,三亚 572000;2解放军总医院第一医学中心核医学科,北京 100853
前列腺囊腺瘤(prostatic cystadenoma,PC)是一种前列腺来源的罕见的良性肿瘤,主要由前列腺上皮过度增生、腺管梗阻和分泌液潴留所致[1-2]。笔者报道了1例巨大多房PC患者的18F-FDG PET/CT影像学特点及诊断过程,并与其他男性盆腔的囊性疾病相鉴别,旨在为临床诊疗提供参考。
1 患者资料
患者男性,38岁,因“尿潴留2 d”于解放军总医院海南医院就诊,既往偶有血精2年余,接受抗炎治疗未见明显好转,患者10岁时曾因左侧先天性输尿管狭窄行输尿管成形术,过程不详,术后一般情况可。体格检查结果为膀胱区膨隆、压痛,未扪及包块。直肠指检结果为前列腺体积轻度增大、无结节、质地韧,其余部位无异常体征。血、尿、便常规以及肿瘤标志物检查结果均无异常。超声结果显示膀胱后方囊性肿块,大小为10.8 cm×10.0 cm×9.8 cm,边界清,内见多条薄厚不均的线状分隔,未见明显血流信号。CT平扫结果显示,膀胱直肠间隙有一团块状低密度影,内见线状分隔(图1A),增强扫描后线状分隔稍强化(图1B)。MRI结果显示,平扫时见盆腔囊性薄壁肿块,T1加权成像呈混杂等、高信号,T2加权成像呈高信号,扩散加权成像无明显高信号(图1C~E),增强后囊壁及分隔中度强化,囊内容物未见明显强化(图1F~H)。18F-FDG PET/CT结果显示,膀胱直肠间隙内见类圆形囊性肿块,呈膨胀性生长,膀胱和直肠受压,与前列腺和双侧精囊腺关系密切,边界尚清,内见线状分隔,囊壁及分隔放射性摄取轻度增高(图1I~K)。患者行全身麻醉腹腔镜下切除术,术后大体描述为灰白间灰红色囊壁样组织,大小为10.5 cm×9.0 cm×2.0 cm,切面呈多房囊性,囊内含清亮液体,内壁呈灰白色,光滑,壁厚0.2~0.4 cm。组织病理学检查结果显示,盆腔纤维囊壁样组织增生,局部衬覆柱状上皮,部分上皮增生,局部鳞状上皮化生,考虑为PC(图1L)。免疫组织化学检查结果为前列腺特异抗原(PSA)(+)、α甲酰基辅酶A消旋酶(P504S)(−)、p53(+)、增殖细胞核抗原Ki-67<1%。术后6个月无复发。
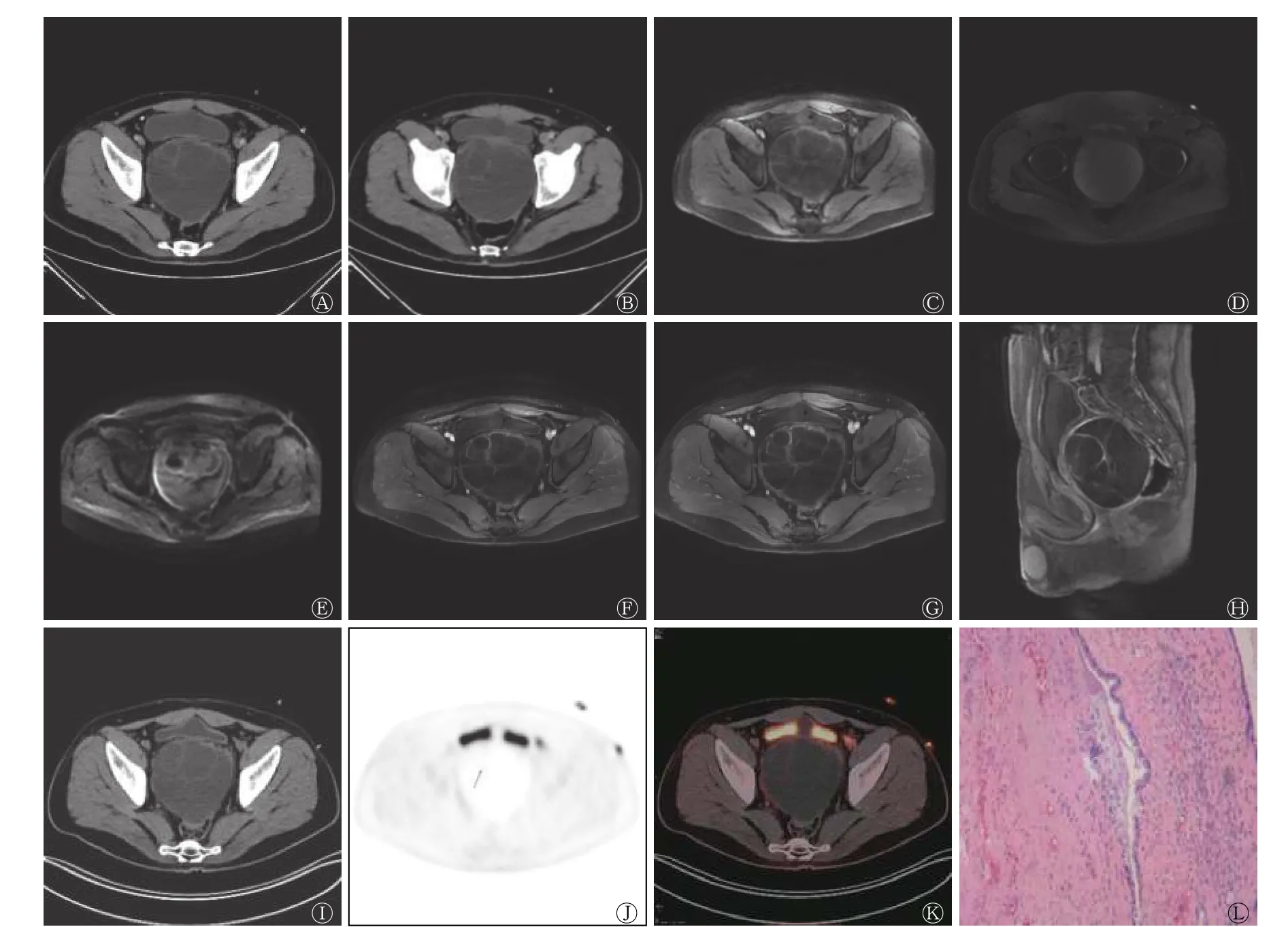
图1 巨大多房前列腺囊腺瘤患者(男性,38岁)的CT、MRI、18F-FDG PET/CT和组织病理学检查图(苏木精-伊红染色,×200)A为CT平扫图,膀胱直肠间隙可见一团块状低密度影,大小为10.7 cm×11.2 cm×11.4 cm,内见线状分隔,CT值=2 HU;B为增强CT扫描图,线状分隔稍强化,病灶与前列腺分界不清,前列腺受压,形态欠规整;C为平扫MRI的T1加权成像图,盆腔囊性薄壁肿块大小为10.7 cm×10.6 cm×11.0 cm,呈混杂等、高信号;D为平扫MRI的T2加权成像图,病灶呈高信号,病灶内液-液平面及线状分隔等信号;E为平扫MRI的扩散加权成像图,未见明显高信号;F、G、H分别为增强MRI的动脉期横断面、延迟期横断面、延迟期矢状面扫描图,显示囊壁及分隔中度强化,囊内容物未见明显强化,肿块边界清,与前列腺关系密切,邻近组织受压改变,双侧精囊腺显示不清,病灶与膀胱、直肠分界尚清,膀胱受压前移;I、J、K分别为CT、PET、PET/CT融合图,显示膀胱直肠间隙内类圆形囊性肿块,大小为10.9 cm×10.4 cm×10.6 cm,边界尚清,内见分隔,分隔及囊壁放射性摄取轻度增高,摄取程度与前列腺实质相同或稍低,SUVmax=1.6~2.8,病灶与双侧精囊腺和前列腺关系密切,左侧输尿管扩张,长径为1.1 cm;L为组织病理学检查图,显示灰白间灰红色囊壁样组织,大小为10.5 cm×9.0 cm×2.0 cm,切面呈多房囊性,囊内含清亮液体,内壁呈灰白色,光滑,壁厚0.2~0.4 cm,盆腔纤维囊壁样组织增生,局部衬覆柱状上皮,部分上皮增生,局部鳞状上皮化生。CT为计算机体层摄影术;MRI为磁共振成像;FDG为氟脱氧葡萄糖;PET为正电子发射断层显像术;SUVmax为最大标准化摄取值Figure 1 CT,MRI,18F-FDG PET/CT and histopathological examination images of the patient with giant multilocular prostatic cystadenoma(male,38 years old)
2 讨论
PC是一种前列腺来源的罕见的良性肿瘤,巨大多房PC更为少见[1]。其发病无明显的年龄倾向,常起源于前列腺移行带,多为慢性起病,早期可伴有非特异的症状,在肿瘤压迫邻近组织和脏器时可出现相应症状(如下腹疼痛、尿频和尿潴留等),当起源于前列腺中央带的肿瘤体积巨大以致压迫精囊腺,或肿瘤与精囊腺部分融合、与输精管位置关系极为密切时,患者可伴有血精、无精[3-4]。
典型PC在CT中的主要表现多为膀胱直肠间隙内多房囊性肿块,巨大肿块长径多为7.5~20.0 cm,囊内分隔较厚,增强扫描后实性成分和分隔强化,囊性成分不强化[5];MRI主要表现为:(1)形态结构上,体积较大,呈膨胀性生长,多为多房囊实性结构,囊性为主,呈囊性或囊实混杂性信号,T1加权成像呈等、稍低信号,T2加权成像呈高信号,扩散加权成像的扩散受限不明显,实性成分考虑为增生的腺体,囊性成分由腺管阻塞和分泌液潴留所致[6-7];(2)常有包膜,T1、T2加权成像均呈低信号;(3)毗邻关系上,与周围组织分界清晰,且边缘可见双低信号包膜;(4)强化方式上,实性成分、包膜及分隔明显强化,囊性成分不强化[5,8-9]。目前,PC在18F-FDG PET/CT中的影像学特征尚无文献报道,就本病例而言,18F-FDG PET/CT对鉴别诊断有一定帮助,其18F-FDG PET/CT结果显示膀胱直肠间隙内见多房囊性薄壁肿块,巨大肿块长径为10.9 cm,囊内可见线状分隔,分隔壁不厚,边界清,肿块脂肪间隙存在,与前列腺、精囊腺关系密切,未侵及尿生殖膈,囊壁及分隔放射性摄取轻度增高,SUVmax=1.6~2.8,放射性摄取程度等于或略低于残存的前列腺实质,囊性成分无摄取。根据18F-FDG PET/CT的影像学表现,首先可排除低分化恶性的可能。本病例在18F-FDG PET/CT中的影像学表现与文献报道中其他部位的囊腺瘤一致(摄取程度等于或略低于腺体)[10],考虑与以下因素有关:18F-FDG为葡萄糖的类似物,可被细胞摄取,在细胞内被己糖激酶磷酸化为18F-FDG-6-磷酸并滞留其中,从而可通过PET/CT进行显像[11];18F-FDG局部高摄取可由肿瘤的异质性引起,增殖细胞核抗原Ki-67与葡萄糖转运蛋白1的表达水平正相关[12];本病例的增殖细胞核抗原Ki-67<1%,未见明显异常的细胞增殖;潴留液为分泌液,不含上皮细胞,无法摄取18F-FDG;且瘤内多条分隔为扩张的腺管、受压的腺体及结缔组织,葡萄糖转运蛋白相对缺乏,放射性摄取未明显增高,这与国内研究者的研究结果一致[13]。因PC较为罕见,样本量较小,需进行大样本量的研究加以证实,但仍可预见,18F-FDG PET/CT对PC的临床诊断有一定帮助。
在影像学上,PC主要与以下几种男性盆腔的囊性疾病相鉴别(本病例在18F-FDG PET/CT中具有异病同征的特点,即放射性摄取程度等于或略低于前列腺实质),鉴别特点如下。(1)精囊腺囊腺瘤:部分患者在大体描述、影像学和组织病理学上均难以与PC相鉴别,精囊腺囊腺瘤有时可见相对完整的前列腺组织,免疫组织化学检查可鉴别两者,精囊腺囊腺瘤为前列腺特异抗原(PSA)(−)和前列腺酸性磷酸酶(PAP)(+),而PC为前列腺特异抗原(PSA)(+)和前列腺酸性磷酸酶(PAP)(−)[2,13];(2)苗勒管囊肿:其多伴有尿潴留和尿路感染等症状,病变起源于苗勒管的残余,位于前列腺尿道后上方的中线处,呈膨胀性生长,矢状位呈单房囊性结构,呈圆形、椭圆形或水滴状,增强CT扫描后未强化,免疫组织化学结果为前列腺特异抗原(PSA)(−);而PC为多房囊性肿块,且囊壁较厚,增强CT扫描后囊壁及分隔强化[14];(3)前列腺囊肿:其与前列腺炎或前列腺增生引起的腺管外口阻塞有关,婴儿和青年患者多见,常合并睾丸下降不全,位于前列腺中线区,一般体积较小且为单囊,无明显实性成分,增强CT扫描后囊壁一般无强化[4]。(4)前列腺囊腺癌:其CT平扫表现为膀胱直肠间隙内巨大多囊性病变,内见不规则的较厚分隔,部分可见壁结节,延展至盆腔外间隙,增强CT扫描后囊壁及分隔强化,MRI的T1加权成像呈等、低混杂信号,T2加权成像囊内呈不均匀性高信号,分隔及囊壁成分呈等信号,扩散加权成像显示肿块分隔及囊壁弥散受限呈高信号,囊内弥散不受限呈低信号,增强后分隔及囊壁明显强化,囊内不强化,动态增强曲线呈上升平台型,在18F-FDG PET/CT中表现为放射性摄取中度增高[4-5,15-17]。
总之,当行18F-FDG PET/CT发现男性患者盆腔巨大囊实性肿块,囊壁及分隔低摄取时,应考虑其患有巨大多房PC的可能。
利益冲突本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明苑克慧负责资料的收集、论文的撰写与修订;胡蓉蓉负责放射性药物的制备;姚树林负责资料的收集与整理、论文的审阅与修订;符珍敏负责病例的筛选;施彦坤、黄江山负责图像的筛选与导出;杨超负责药物的注射、文献的收集与整理;王卉负责命题的设计、结果的审核、论文的修订。

