动态基质固相分散-离子液体双水相微萃取结合高效液相色谱法检测粮谷中的三嗪类除草剂
徐尉力,朱 清,王秀娟,李吉龙,冯 吉,毕金龙,王志兵
(长春工业大学化学与生命科学学院,吉林 长春 130012)
以三嗪为母体结构的三嗪类除草剂,自上世纪50年代起被广泛用于粮谷类作物田间杂草的防治[1],因其使用时间长、范围广、结构稳定[2],易在大豆[3]、玉米[4]等粮谷作物中产生残留,继而对人体健康产生潜在的不利影响。GB/T 23816—2009《大豆中三嗪类除草剂残留量的测定》[5]规定,原料大豆中的三嗪类除草剂的限量标准(maximum residue limits,MRLs)为0.05 mg/kg。因此,建立一种高效、灵敏和安全检测粮谷中三嗪类除草剂的方法具有重要意义。
目前,对于植物源性食品中三嗪类除草剂的检测方法主要有高效液相色谱法[6-7]、推扫胶束电动毛细管色谱法[8-9]、超快速液相色谱-串联质谱法[4]和气相色谱法[10-11]等。其中,高效液相色谱法因具有灵敏度高、分析速率快、分离效能高等优点,已成为具有普适性的检测方法。
对于粮谷中三嗪类除草剂,其常见前处理方法主要有QuEChERS法[12]、固相萃取法[1,13]、液液萃取法[14]和基质固相分散法[15]等。其中,基质固相分散法是一种用于固体或半固体样品的新型样品前处理方法,该法集样品破碎、混合、提取、净化于一体[16],操作简单方便。但在样品处理过程中,常用挥发性有机试剂作为洗脱剂,其用量较大,导致洗脱和浓缩过程耗时、费力、污染大。离子液体是由有机阳离子和有机或无机阴离子组成的一种低熔点的熔融盐[17],其具有熔点低、不挥发、热稳定性高、绿色安全和可设计性等优点[18],已成为传统有机试剂的一种优良替代品,常用于提取大豆中的三嗪类除草剂[13]以及酸奶中的三嗪和苯脲类除草剂[18],其检出限可达0.5~1.1 µg/kg和0.23~1.01 µg/L。但由于大部分咪唑基离子液体黏度较大[19],对固体样品进行萃取时,易残留在固体样品表面[20],固液分离较困难。因此,需要一种简单、快速的方法减少离子液体在样品上的附着,同时又能保证快速富集离子液体。
离子液体-阴离子表面活性剂双水相体系是在传统有机溶剂/盐双水相体系的基础上发展起来的一种新型、绿色的双水相体系[21],通过向离子液体溶液中加入适宜的离子表面活性剂,诱导离子液体发生自聚集,形成囊泡结构,使原本混溶的离子液体-水溶液发生相分离,形成稳定的双水相体系[22]。由离子液体和阴离子表面活性剂组成的双水相体系可实现目标物的快速分离富集。本实验双水相体系的成相速度比刘娇娇等[23]实验的对应速度快5 倍左右,且本法测得目标物检出限最高值0.76 µg/kg低于刘娇娇等[23]测得目标物检出限最低值0.94 µg/kg,本法检出限更低、灵敏度更高。
因此,本研究在传统基质固相分散的基础上结合离子液体双水相体系建立一种粮谷中三嗪类除草剂的萃取方法,并通过高效液相色谱法对目标物进行测定。该法采用蠕动泵的推送方式控制洗脱液流速和体积[24-26],与传统的重力洗脱相比[27-28],洗脱时间缩短6~30 倍;同泵抽方式相比,推送方式可以实现连续洗脱,无需手动加样,避免洗脱后样液在软管内损失;同手动挤压式推送相比[29],该法可提供均匀的压力和流速,保证实验过程均一、稳定。同时,该法有效解决由于离子液体的高黏度而引起的传质阻力大、洗脱速率慢、目标物洗脱不彻底的问题,与Zhang Liyuan等[30]的研究相比,该法对大豆中三嗪类除草剂的检出限提高3~10 倍,且萃取剂安全、无污染。此外,本法以离子液体溶液作为洗脱剂,不仅可以调节洗脱剂的极性,降低离子液体的黏度,又能避免后续的旋蒸、氮吹[31]等浓缩步骤,通过离子液体-阴离子表面活性剂双水相体系可以实现洗脱液中离子液体和目标分析物的快速分离富集。
1 材料与方法
1.1 材料与试剂
不同种类的市售粮谷样品,包括黄豆、绿豆、玉米、大米、小米和黑米(依次编号为样品1~6),吉林长春市购。
十二烷基苯硫酸钠(sodium dodecyl benzene sulfonate,SDBS)、1-丁基-3-甲基咪唑四氟硼酸盐(1-butyl-3-methylimidazolium tetrafluoroborate,[C4mim]BF4)上海成捷化学有限公司;硅胶、硅藻土、酸性氧化铝、中性氧化铝、碱性氧化铝(均为200~300 目),弗罗里硅土(60~100 目) 中国医药及生物制品研究所;乙腈、甲醇(均为色谱纯) 科隆化学品有限公司;丙酮(分析纯) 北京化工厂;西玛通、莠去通、特丁通、特丁津、异丙净标准品(纯度均不小于99%,5 种标准品结构见图1) 国药集团化学试剂有限公司。
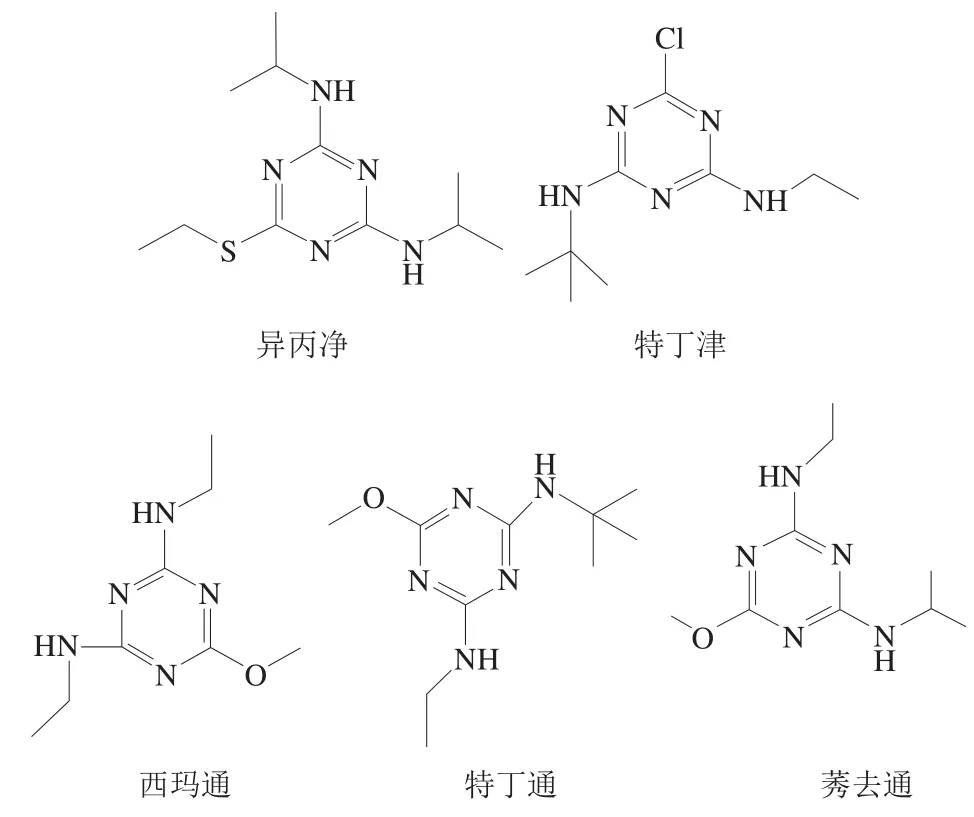
图1 三嗪类除草剂的化学结构Fig. 1 Chemical structures of triazine pesticides
1.2 仪器与设备
1100型高效液相色谱仪(配有二极管阵列检测器)、Zorbax SB-C18色谱柱(150 mm×4.6 mm,3.5 μm)、C18预柱(7.5 mm×2.1 mm,5 μm) 美国Agilent公司;AG 5428型台式高速冷冻离心机 德国Eppendorf公司;KQ-100DE超声波清洗器 江苏昆山市超声仪器有限公司。
1.3 方法
1.3.1 标准溶液配制
准确称取5 种三嗪类标准品0.50 mg于5 mL棕色容量瓶中,用乙腈溶解并定容至刻度,配制成每种目标物质量浓度均为100.00 µg/mL的标准储备液,在4 ℃避光保存。分别取5 种标准储备液各1 mL于10 mL棕色容量瓶中,用乙腈定容至刻度,配制成质量浓度为10.00 µg/mL的混合工作标准溶液。其他工作溶液均由混合工作标准溶液经乙腈稀释后得到。
1.3.2 样品的制备
样品制备:将样品1~6分别用粉碎机粉碎、装袋、命名,密封后保存于-20 ℃冰箱环境中。
加标样品制备:取5.00 g粉碎后粮谷类样品(样品1~6)室温解冻,按照50.00 µg/kg的加标量,将25.00 μL的混合工作标准溶液加入到粮谷类样品中,并加入10.00 mL体积分数99.5%的丙酮溶液,在室温、600 r/min搅拌12 h,待混合均匀后,氮吹挥去多余溶剂,即获得加标样品,于4 ℃冰箱中保存,备用。单因素优化、Box-Behnken优化以及部分方法学等数据均是以样品1为代表样品进行,而实际样品分析是将样品2~6按照1.3.2节制备的样品进行加标所测得结果。
1.3.3 动态基质固相分散-离子液体双水相微萃取
实验流程如图2所示。首先,准确称取0.30 g加标样品和0.90 g中性氧化铝置于玛瑙研钵中,均匀研磨4 min,混合均匀后,将其转移到底部铺有脱脂棉的自制基质固相分散萃取小柱中,并在上方用脱脂棉轻轻压实,随后用20%离子液体溶液(V/V)淋洗萃取柱,通过蠕动泵控制洗脱流速为10 mL/min,以便将目标物从萃取小柱中充分洗脱,由于洗脱过程均一、稳定且时间较快,故不需要封口膜密封离心管,实验环境也不会对洗脱剂洗脱效果产生影响,洗脱完毕后定量收集洗脱液2.70 mL于离心管中。随后,向离心管中加入0.90 g SDBS,手动振摇10 s后形成不透明的浑浊液,于室温、8 000 r/min离心5 min后,形成双水相体系,取100.00 μL上相溶液于离心管中,用100.00 μL的微量乙腈(体积分数99.95%)稀释,过0.45 μm有机系滤膜,进行色谱分析。
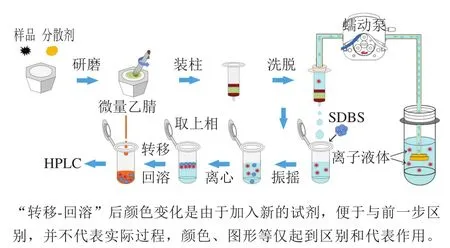
图2 动态基质固相分散离子液体双水相微萃取流程图Fig. 2 Flow chart of dynamic matrix solid phase dispersion-ionic liquid-based aqueous two-phase microextraction
1.3.4 色谱条件
流动相由水(A)和乙腈(B)组成,洗脱梯度为:0~3 min,75% A、25% B;3~5 min,75%~70% A、25%~30% B;5~10 min,70%~60% A、30%~40% B;10~18 min,52%~50% A、48%~50% B;18~20 min,50%~35% A、50%~65% B;20~27 min,35%~30% A、65%~70% B;27~35 min,30%~75% A、70%~25% B;35~40 min,75% A、25% B。流速:0.5 mL/min;进样体积:10 μL;柱温:35 ℃;检测波长:228 nm。
1.3.5 萃取条件优化
1.3.5.1 Plackett-Burman试验设计
在预实验的基础上,通过Design-Expert V 8.0.6.1软件中的Plackett-Burman设计对离子液体体积分数、洗脱液收集体积、SDBS用量、样品与分散剂质量比、洗脱剂pH值和洗脱速率进行主因素筛选。设计时以因素显著性最大化为原则选择因子取值范围,并消除无关变量影响,以5 种目标物回收率的平均值作为响应值,平行试验3 次,采用方差分析评估作用效果,并以95%的置信区间确定统计学意义。对于无法进行Plackett-Burman试验优化的因素将进行单因素优化。
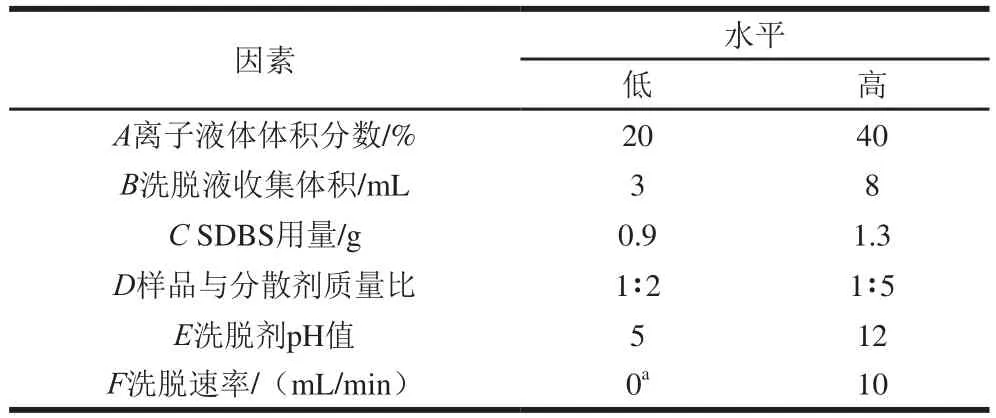
表1Plackett-Burman试验设计因素及水平Table 1 Factors and levels used for Plackett-Burman design
1.3.5.2 Box-Behnken试验设计
在Plackett-Burman试验设计结果的基础上,采用Box-Behnken对3 个显著性因素进行响应面优化,以确定因素间交互影响对目标物回收率的影响,试验因素包括离子液体体积分数、洗脱液收集体积和SDBS用量,因子取值范围以Plackett-Burman试验结果的最高值为中心值两侧适当延伸取值,若受现实实验条件限制无法确定中心值,则单侧取值,一侧适当延伸。3因素3水平的Box-Behnken试验结果如表2所示,共计17 组实验,其中5 组为中心点,每组实验平行测定3 次。
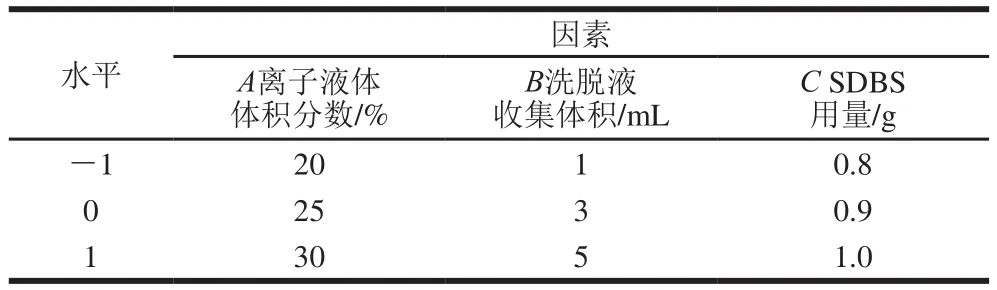
表2Box-Behnken试验因素与水平Table 2 Factors and levels used for Box-Behnken design
1.4 数据分析
通过Excel软件对实验数据进行统计分析,采用Origin 8.0软件进行单因素作图分析,采用Design-Expert V 8.0.6.1软件进行Box-Behnken作图和方差分析。
2 结果与分析
2.1 Plackett-Burman试验设计及结果
如图3所示,在选定的取值范围内,目标物回收率会不同程度下降,黄色柱表示积极影响,因素数值增加,目标物回收率也增加,蓝色柱反之。其中,t值代表差异发生的概率,t值高于对应的极限值(2.570 58),表明其置信程度大于95%,此参数被认为对响应值具有显著影响,反之则影响不显著[32]。结果表明,在设定的取值范围内,6 个因素的显著性大小关系为A>B>C>E>F>D,因此A、B、C属于显著性因素。其中,动态基质固相分散的流速对目标物回收率平均值的影响最小,表明利用蠕动泵代替重力洗脱可以节约大量时间,且不会对目标物回收率产生明显的影响。
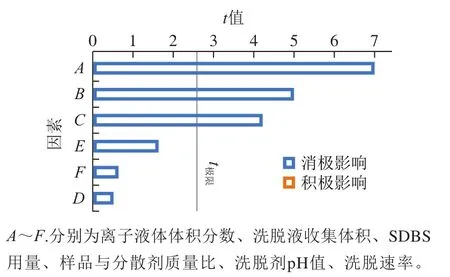
图3 标准帕累托图Fig. 3 Pareto diagram showing the effects of six variables on the average recovery of analytes investigated in the Plackett-Burman design
2.2 Box-Behnken试验设计及结果
2.2.1 回归模型建立及方差分析
在最优的萃取条件和色谱条件,按表2的因素水平进行试验,以5 种目标物回收率平均值为响应值,得到17 组数据如表3所示,对模型进行多元二次回归拟合分析,确定自变量与因变量的回归方程为Y=80.9-14.67A-3.56B-1.22C+0.21AB+0.03AC-0.63BC+6.95A2-12.87B2-5.91C2。由表4可知,回归模型具有显著性(P<0.000 1),且失拟项均不显著(P=0.371 6),校正相关系数R2=0.998 5,说明该模型对现实实验规律具有良好的拟合效果,且对试验结果可以产生准确的预判。
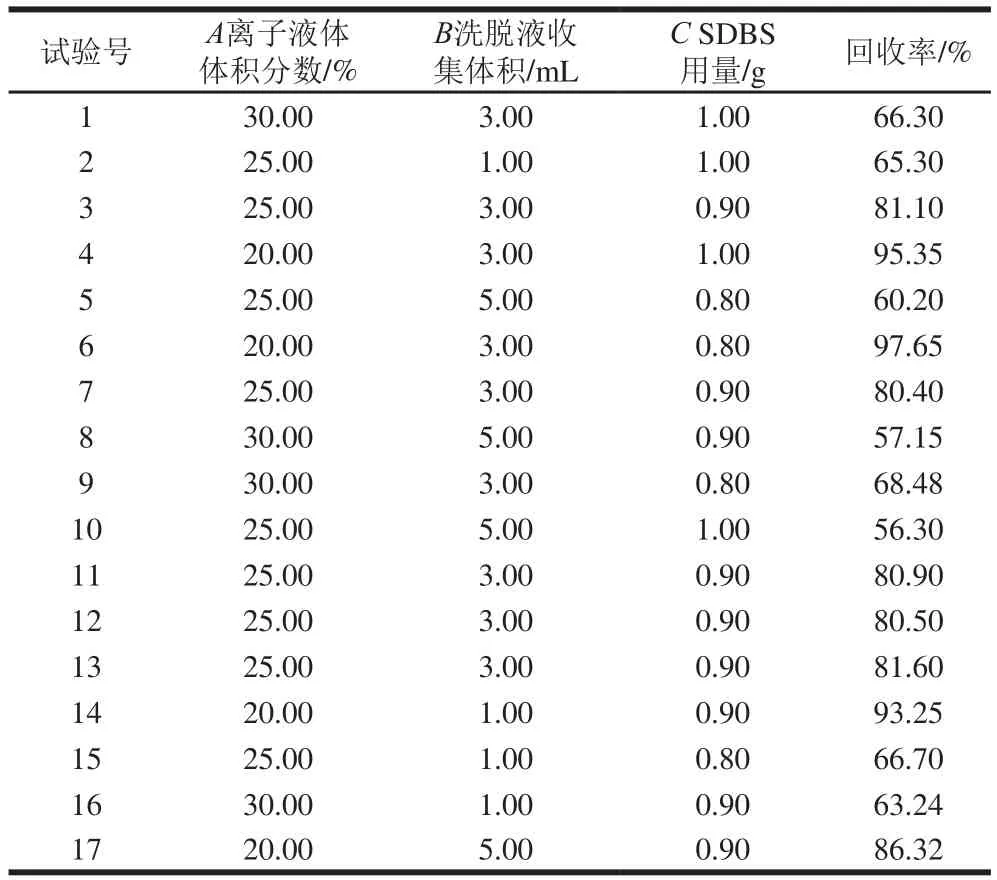
表3 响应面试验设计及结果Table 3 Experimental results for response surface analysis
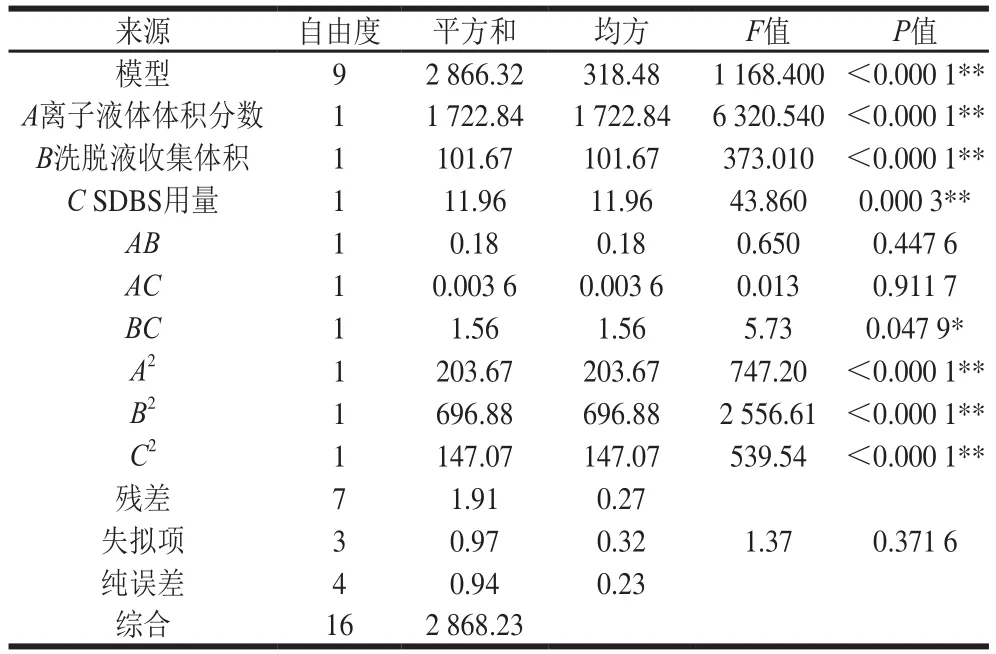
表4 响应面二次模型的方差分析Table 4 Analysis of variance of response surface quadratic model
2.2.2 响应面分析
在拟合结果的基础上对因素间的交互影响进行响应面分析,可以更好地判断不同因素对目标物回收率变化趋势的影响[33]。如图4a、b所示,当固定洗脱液收集体积和SDBS用量,变化离子液体体积分数时,目标物回收率横跨多条等高线,表明在设定的取值范围内,离子液体体积分数对目标物回收率平均值的影响比洗脱液收集体积、SDBS用量的影响更大。造成这种现象的原因为离子液体溶液既是基质固相分散的重要组成部分,也是影响离子液体双水相体系形成的关键因素。离子液体溶液作为基质固相分散的洗脱剂,其浓度决定了洗脱剂的极性,影响目标物的洗脱效果;对离子液体双水相体系而言,离子液体体积分数达到双水相形成的临界胶束浓度时,可以产生两相体系,对离子液体和目标物进行富集,而浓度过高时,富集效果急剧下降,回收率降低。
如图4c所示,洗脱液收集体积和SDBS用量间的交互影响类似,其二维等高线图可以看出,等高线分布大致为圆形,说明洗脱液收集体积和SDBS用量变化时,目标物回收率平均值的变化差异不明显,但由方差分析结果可以看出,洗脱液收集体积的F值高于SDBS用量,表明洗脱液收集体积对目标物回收率变化的影响要高于SDBS用量。这可能是由于洗脱液收集体积决定了离子液体相的体积和对目标物的萃取量,对双水相形成和萃取效果具有重要影响,而在成相条件的SDBS用量只对离子液体相体积有一定的影响。
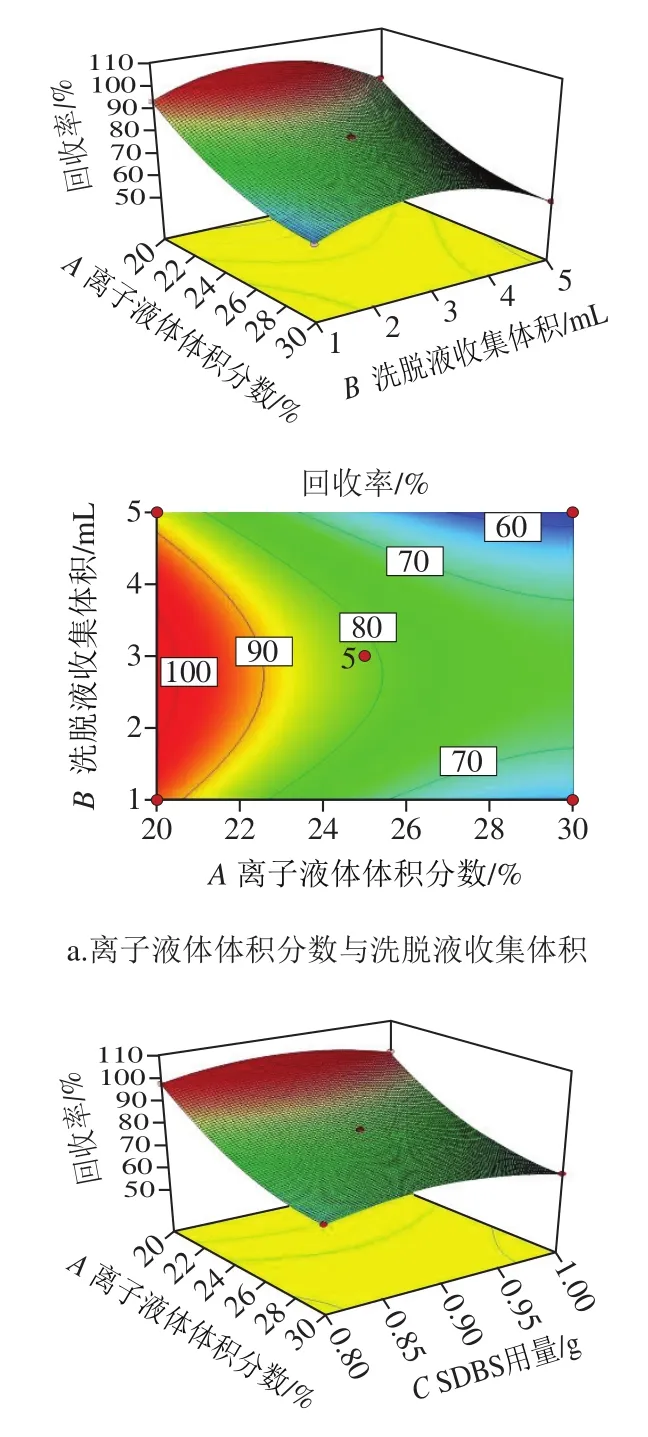
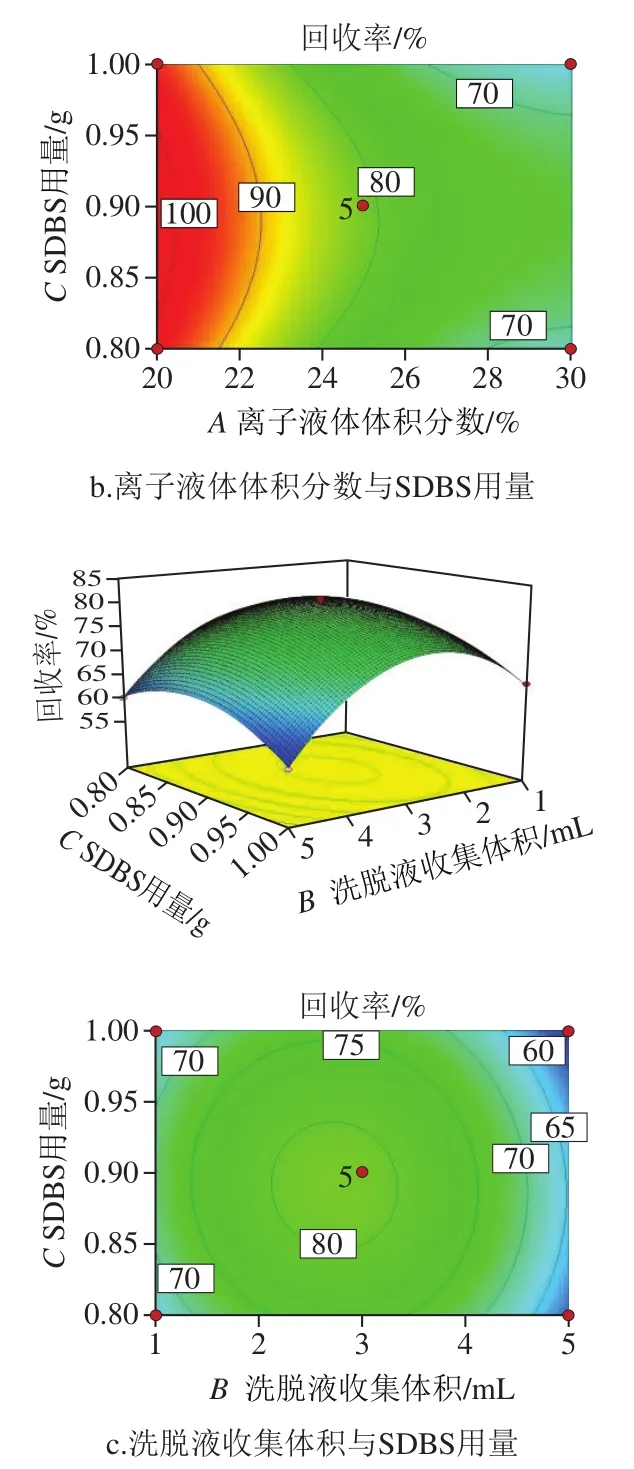
图4 各因素相互作用对回收率影响的响应面及等高线Fig. 4 Response surface and contour plots showing the interactive effect of factors on the average recovery of analytes
2.2.3 最优条件确定及回归模型验证
在本研究中,双相体系的形成受离子液体体积分数影响较大,当离子液体体积分数低于20%时,无法形成有效的双水相体系,在拟合最佳实验条件时,需将离子液体体积分数的最小值固定为20%,通过软件拟合后,得到的最佳萃取条件为离子液体体积分数20%、洗脱液收集体积2.71 mL、SDBS用量0.89 g,此时目标物回收率为102.86%。结合现实操作需求,将最佳萃取条件定为离子液体体积分数20%,洗脱液收集体积2.70 mL,SDBS用量0.90 g,并在此条件进行6 次验证实验,得到5 种三嗪类除草剂回收率的平均值为99.11%。结果表明,本法建立的二次多元回归方程可以很好地拟合实验结果,对实验结果具有一定的预测性。
2.3 单因素试验优化结果
2.3.1 分散剂种类对目标物回收的影响
基质固相分散常被用于固体、高黏度样品的前处理,其中分散剂不仅是一种吸附分离材料,也是分散和固定样品的载体,对分散效果具有重要影响。本研究考察了硅胶、硅藻土、弗罗里硅土、酸性氧化铝、中性氧化铝和碱性氧化铝作分散剂时对目标物回收率的影响。如图5所示,中性氧化铝和碱性氧化铝作分散剂时,目标物回收率远高于其余4 种分散剂,其中,中性氧化铝作分散剂时,莠去通、异丙净和特丁津的回收率最高。这可能是由于硅胶、硅藻土和弗罗里硅土属于多孔结构的硅酸盐,表面具有较多的羟基结构,与目标物的氢键作用较强,吸附效果明显,洗脱困难;而酸性氧化铝具有酸性离子交换性能,对弱碱性三嗪类化合物的交换性能较差,不利于目标分析物的交换和洗脱。因此,本研究选用中性氧化铝为分散剂。
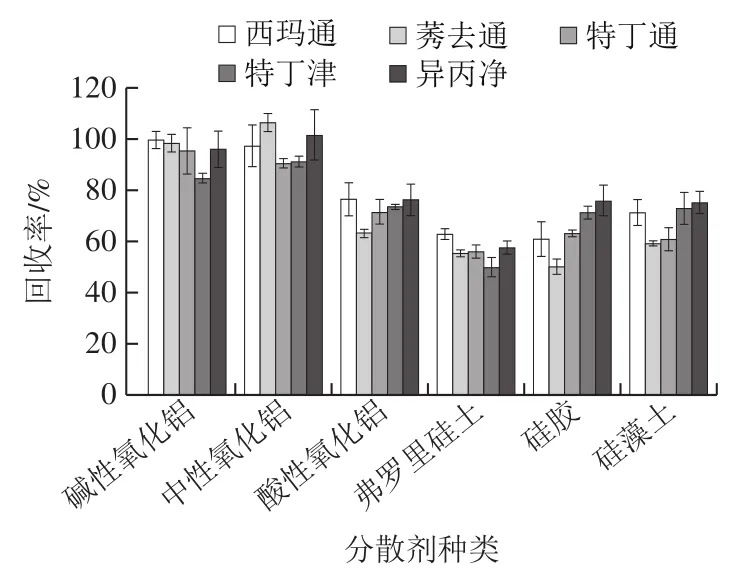
图5 分散剂种类对目标物回收率的影响Fig. 5 Effect of dispersant type on recoveries of target analytes
2.3.2 离子液体体积分数对提取率和相比的影响
双水相体系作为富集目标分析物的重要方式,可以快速、有效地将离子液体从洗脱液中分离出来,达到富集离子液体和目标物的目的[34],对收集相同体积洗脱液所用时间进行比较,双水相体系对离子液体的富集速率是传统旋蒸法的10 倍左右。同时,2.1节结果表明,离子液体体积分数对目标物回收率具有消极影响,这是由于离子液体双水相的富集效果受相比的影响,因此需要对离子液体双水相的相比进行探究。由于收集的一定体积洗脱液中目标物总量一定,当离子液体体积分数为20%时,可以形成双水相,且此时单位体积的离子液体相中目标物含量最高,当离子液体的体积分数从20%逐渐增加至30%时,双水相相比逐渐增加,上相体积增大,对目标物起到稀释作用,导致目标物回收率下降,结果如图4a所示。同时,离子液体的体积分数过高会导致成相速率变慢,相界面不稳定,易发生混溶,但离子液体相中目标物浓度受分配系数的影响,相比随离子液体的体积分数增加而增加,上相中目标物含量增加,提取率逐渐上升,结果如图6所示。因此,为了获得最佳的检测效果和稳定的双水相体系,本研究选用20%(V/V)的离子液体溶液作基质固相分散的洗脱剂。
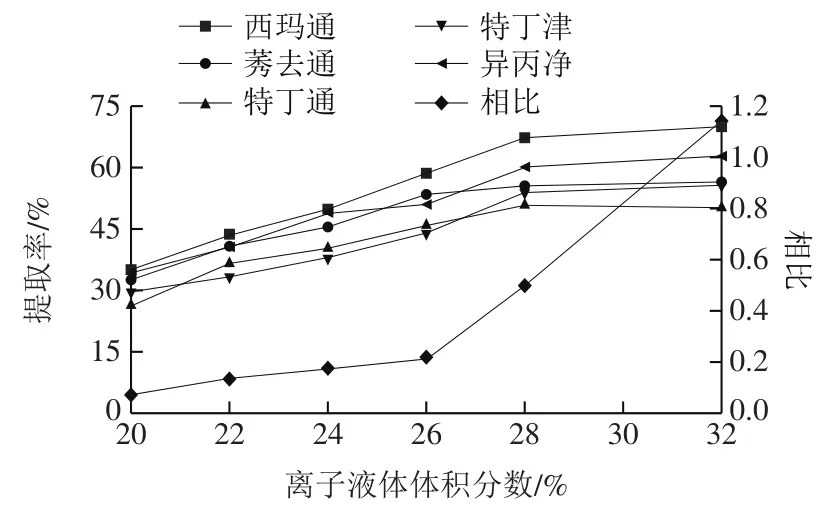
图6 离子液体体积分数对目标物萃取率和相比的影响Fig. 6 Effect of ionic liquid concentration on recoveries of target analytes and phase ratio
2.4 方法学评价
2.4.1 线性关系、定量限和检出限
通过混合、稀释原标准储备液对空白大豆样品进行加标,得到不同加标量(5.00、10.00、20.00、30.00、50.00、100.00 µg/kg)的空白加标样品,以目标物峰面积(A)为纵坐标,加标量(c)为横坐标绘制工作曲线,得到二元回归方程和相关系数;配制质量浓度分别为0.1、0.5、1.0、2.0、4.0、8.0 µg/mL的混合工作标准溶液,以目标物峰面积(A)为纵坐标,目标物浓度(c)为横坐标绘制标准曲线。检出限和定量限分别为3 倍和10 倍的11 组低浓度空白加标大豆样品测得峰面积的标准差比上所对应目标物工作曲线的斜率的值。如表5所示,各个目标物工作曲线和标准曲线的回归方程的最小相关系数分别为r=0.996 9和r=0.999 9,工作曲线下各目标物的检出限和定量限分别为0.62~0.76 µg/kg和2.06~2.53 µg/kg。
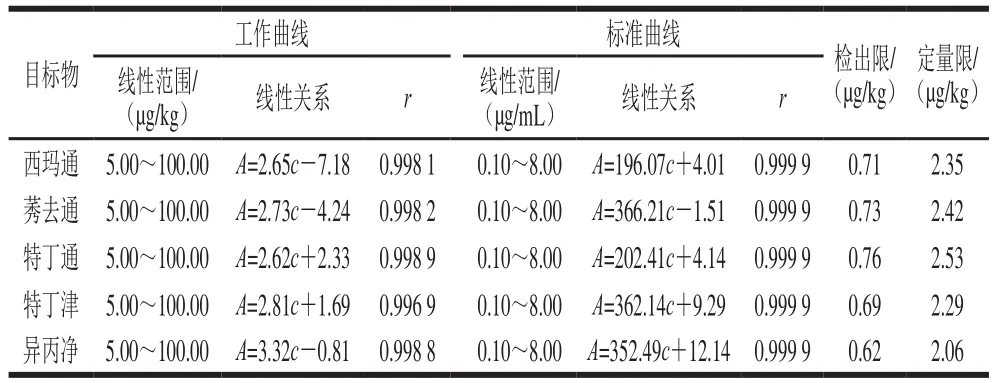
表5 目标分析物的线性关系、定量限、检出限(n=3)Table 5 Calibration equations, limits of detection and limits of quantitation for the analytes (n = 3)
2.4.2 精密度
对大豆样品进行加标处理,分别在加标量5.00、50.00、100.00 µg/kg测定日内和日间精密度,通过1 d内对加标样品平行分析6 次,测得回收率的相对标准偏差(relative standard deviation,RSD)为方法的日内精密度,通过每天分析2 次,连续分析3 d测得回收率的RSD为方法的日间精密度。如表6所示,该方法的日内和日间精密度分别为0.91%~5.85%和1.90%~7.70%,说明该实验方法具有良好的重复性。
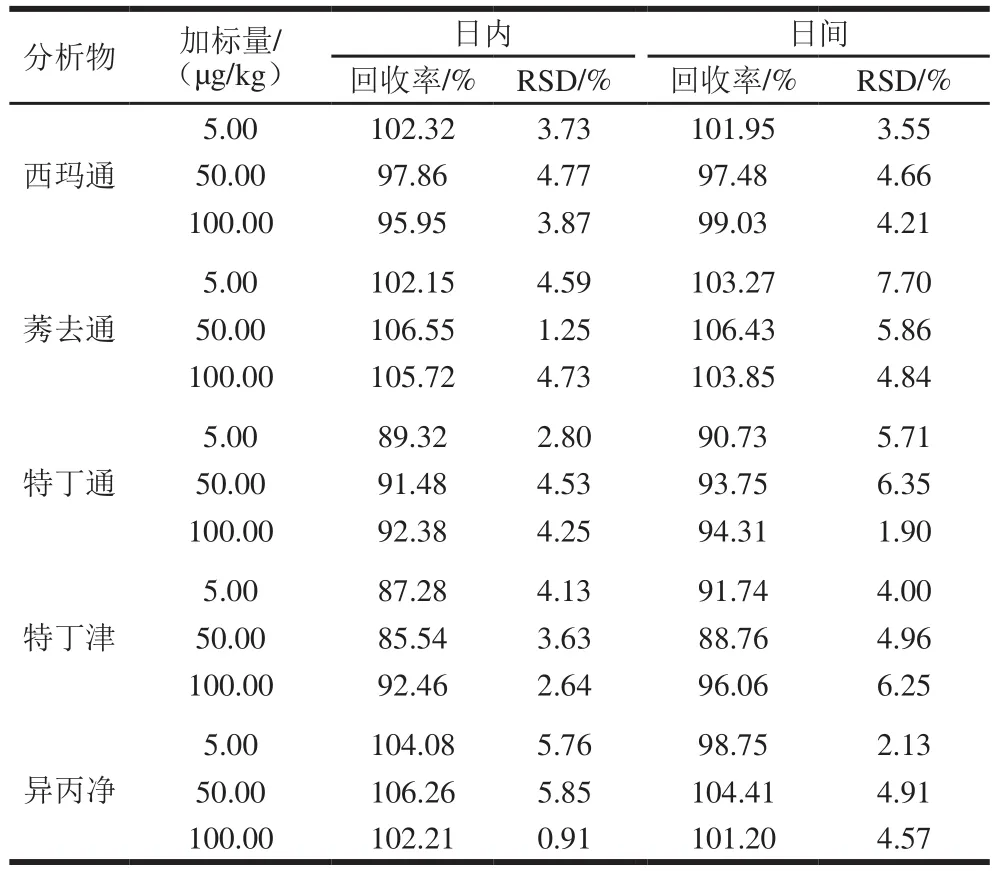
表6 目标分析物的日内和日间精密度(n=6)Table 6 Intra-day and inter-day precision for the analytes (n = 6)
2.4.3 稳定性
为了考察萃取分析过程中三嗪类除草剂受温度、光照、氧气、pH值、样品基质等因素变化时的稳定性,本研究选用2 组加标量分别为5.00、50.00 µg/kg的大豆样品作为分析对象,在最佳萃取条件和色谱条件对2 组加标样品进行分析,每隔1 周分析1 次,连续分析4 周。实验结果如表7所示,各目标物的回收率在85.40%~104.93%之间,RSD为0.86%~7.82%。这说明大豆中的三嗪类化合物在避光保存时至少在28 d内是稳定的。
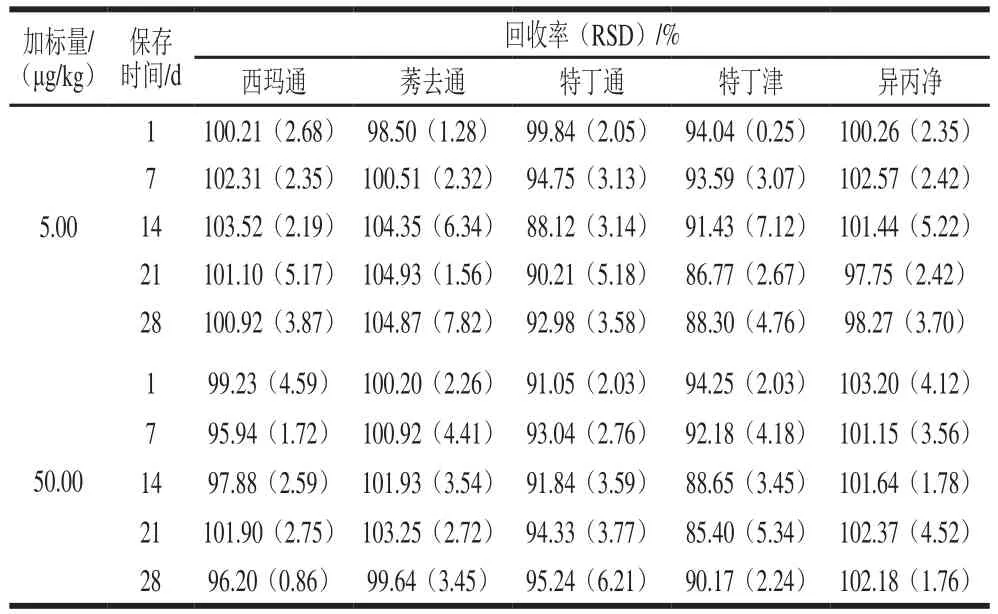
表7 目标分析物的稳定性(n=3)Table 7 Stability of the analytes (n = 3)
2.4.4 实际样品分析
为了评估方法的适用性,在最优萃取和色谱条件对黄豆、绿豆、玉米、大米、小米和黑米共6 种粮谷类基质进行空白样品分析和加标分析。如表8所示,6 种基质样品的回收率为82.92%~106.98%,其RSD为0.27%~8.22%,所有空白样品中均为检测到阳性样品。实验结果表明,本法具有较好的回收率和适用性,可用于粮谷中三嗪类除草剂的提取分析。大豆基质的色谱图如图7所示,图中可以看出目标物保留时间内无明显干扰,空白样品中无相关除草剂残留。
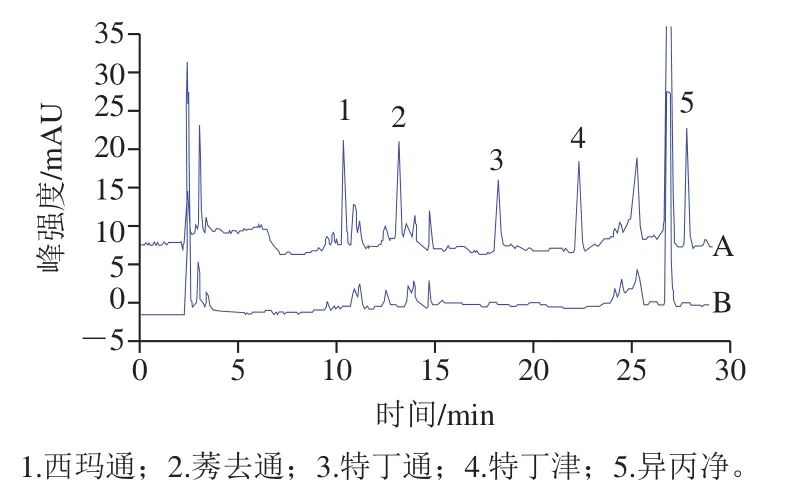
图7 加标样品(A)和空白样品(B)色谱图Fig. 7 Chromatograms of spiked sample (A) and blank sample (B)
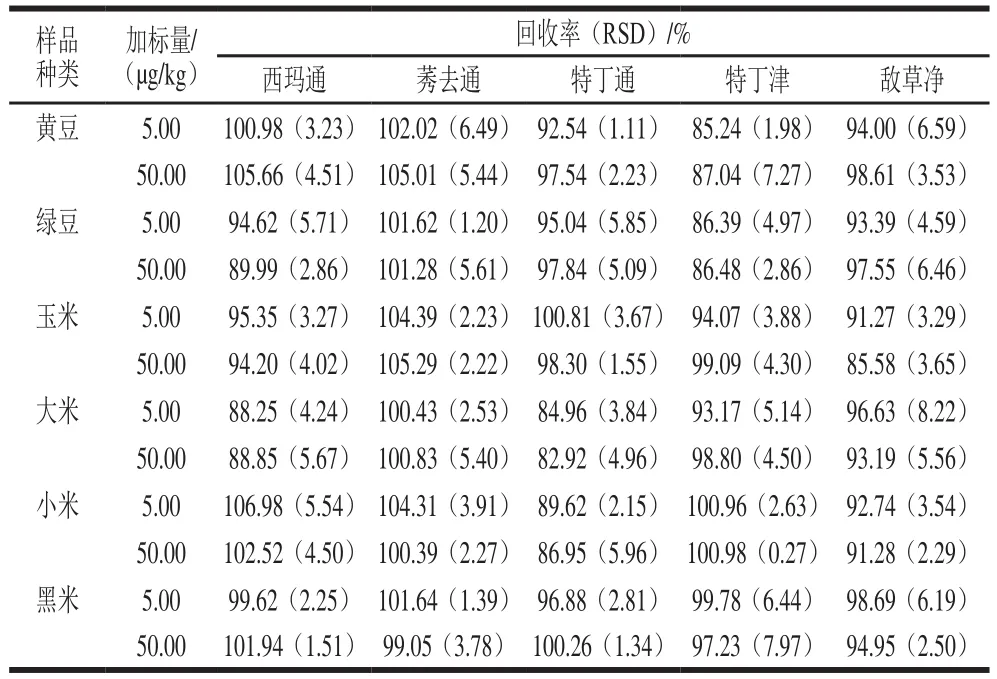
表8 实际样品分析Table 8 Results of analysis of actual samples by the proposed method
2.4.5 方法比较
与乙腈萃取法、固相净化萃取法和QuEChERS法相比,本法用离子液体溶液代替乙腈作萃取剂,试剂绿色、安全且用量仅为正常剂量的3%~15%,检出限为0.62~0.76 µg/kg,明显低于上述方法。相比于其他基质固相分散法和离子液体双水相法,该方法结合了两者的优势,基质固相分散法能够破碎样品基质,对杂质产生一定的吸附作用,降低了基质效应,提高了检测的灵敏度,使该法检出限比上述方法单独使用时减少93.8%~97.5%;同时,离子液体双水相对基质固相分散洗脱液中的目标物进一步富集,提高了目标分析物的富集倍数,保障了目标物的回收率,使本法的回收率比上述2 种方法更接近100%;与基质固相分散-磁性离子液体双水相液液微萃取相比,本法的检出限更低,仅约为上述方法的30%~50%;相比较于QuEChER法,本法试剂用量减少85%,但检出限减少69.0%~97.5%。因此,相较于参考文献中的方法,本法试剂用量少,操作简单、安全、检出限低,可用于粮谷中三嗪类除草剂的提取与测定。方法比较结果如表9所示。
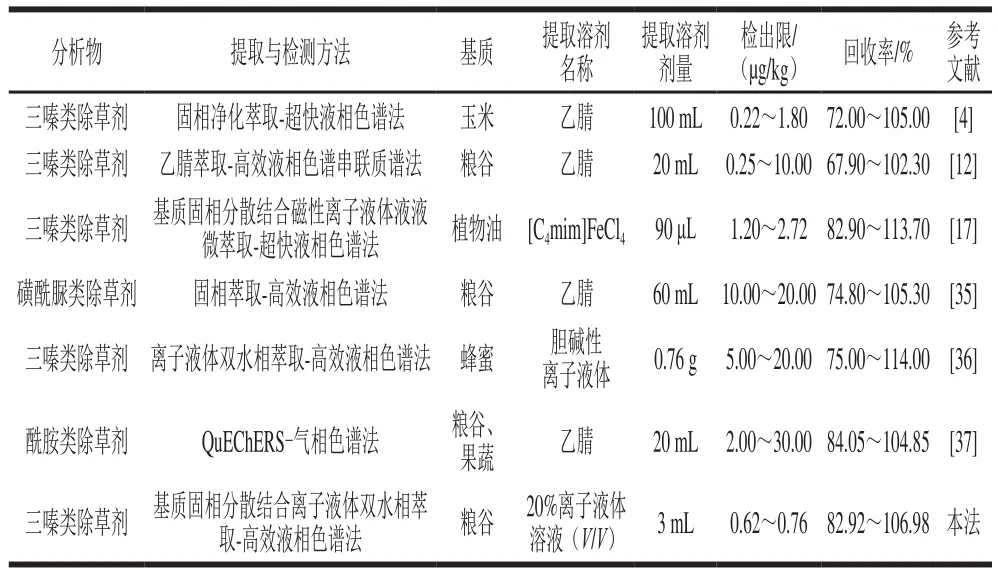
表9 本法与其他方法参数的比较Table 9 Comparison of parameters between the developed method and other methods
3 结 论
本实验在传统基质固相分散的基础上结合双水相体系对粮谷中的三嗪类除草剂进行提取、富集,并通过高效液相色谱法进行测定。通过蠕动泵控制流速代替重力洗脱,采用离子液体双水相体系代替旋蒸浓缩方式富集目标物,可以有效解决传统基质固相分散法溶剂用量大、洗脱流速不稳定、洗脱液浓缩费力耗时等缺点。同时,本研究采用离子液体溶液作为洗脱剂,更加绿色、环保,有效减少传统有机溶剂对实验人员身体健康的危害。本法具有溶剂用量少、萃取时间短、操作简单、绿色环保等优点,可用于粮谷中三嗪类农药残留的分析与检测。

