食品级κ-卡拉胶对肥胖小鼠致结肠炎风险 及体脂蓄积的影响
张 慧,杨瑞利,刘 芳,周赛楠,卢 娜,唐庆娟*
(中国海洋大学食品科学与工程学院,山东 青岛 266000)
卡拉胶又名角叉菜胶,是一种从鹿角菜、石花菜和麒麟菜等红藻中提取出的天然多糖类植物胶体[1]。 卡拉胶由半乳糖和3,6-脱水半乳糖构成重复二糖单位,并由α-1,3-和β-1,4-糖苷键交替连接而成碳骨架。根据其糖单位的硫酸化程度和位置,卡拉胶可主要分为κ-、ι-、λ- 3 种亚型[2-3]。卡拉胶分子质量巨大,天然卡拉胶的分子质量可达到1.5×106~2×107Da;食品级卡拉胶分子质量略低,约100 000~800 000 Da或200 000~400 000 Da。卡拉胶经酸降解得到的小分子质量寡聚糖片段,被称为降解卡拉胶,其分子质量约为20 000~40 000 Da[2,4]。2003年欧盟委员会[5]及2007年食品添加剂联合专家委员会[6]均规定,食品级卡拉胶中检出分子质量小于50 000 Da的寡糖相对含量不得超过5%。天然卡拉胶和食品级卡拉胶由于独特的结构和较高的分子质量而具有特殊的理化性质(如胶凝性、稳定性和蛋白反应性)。这些性质使得高分子质量卡拉胶广泛应用于食品行业,如作为增稠剂、乳化剂和稳定剂等食品添加剂来改善食品的感官性能[1,7]。
然而,近几十年来,有研究人员发现天然卡拉胶或食品级卡拉胶能够诱发或促进肠道炎症的发生或发展。如Borthakur等[8]发现3 种亚型的未降解卡拉胶均能诱发正常人肠道上皮细胞释放白细胞介素-8并产生炎症反应;Wu Wei等[9]的研究表明卡拉胶预处理能够加剧脂多糖诱发的结肠炎症。但是也有研究表明,高分子质量卡拉胶不会对肠道产生明显的毒性效应。Weiner等[10]使用分子质量范围为196 000~257 000 Da的卡拉胶对大鼠干预90 d,实验结束后大鼠肠道正常。由此可以看出,对于卡拉胶是否具有致结肠炎性的争议一直存在。有研究人员指出,该争议的产生不仅归因于不同实验中采用的卡拉胶特征不同,还可能是实验动物的机体状态不同导致的[11]。 而肥胖作为一种慢性炎症的机体状态,处于该状态下卡拉胶的摄入是否更易诱发结肠炎症则鲜被探究或证实。因此本实验以肥胖小鼠为模型,探究不同剂量食品级κ-卡拉胶致结肠炎的可能性。此外,Bhattacharyya等[12]的研究表明卡拉胶能够加剧肥胖诱发的系统炎症,如导致更严重的葡萄糖(glucose,Glu)不耐受和胰岛素抵抗等,说明卡拉胶对于营养素的消化吸收,如糖类和脂类的代谢也有一定程度的影响。因此本实验将同时探讨食品级κ-卡拉胶的摄入对肥胖小鼠脂质代谢的影响。
随着社会经济的发展,人们的生活水平和生活习惯发生了巨大的改变,高热量摄入的饮食结构和低能量 消耗的工作方式使得肥胖症的发生率越来越高。据报道, 至2016年,成年肥胖患者约为6.71×108人[13];而中国肥胖人群比例在2013年已超过美国,位居世界首位[14]。随着肥胖人群数量的增多,针对其精准营养及个性化干预治疗也成为食品等行业的发展趋势和研究热点所在。因此,本实验在前期研究基础上,分析不同剂量的食品级κ-卡拉胶对肥胖机体的影响,包括其对结肠健康及脂质代谢等的影响,旨在进一步探究卡拉胶在肥胖机体内的安全性,为卡拉胶加工食品研究提供数据。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性C57BL/6Cnc小鼠(生产许可证号:SCΧK(京)2016-0006),6 周龄,体质量17~19 g 北京维通利华实验动物技术有限公司。
10%低脂对照饲料(TP23302)、60%高脂对照饲料(TP23300)及其受试物添加饲料 南通特洛菲科技有限公司。
食品级κ-卡拉胶 石家庄春信生物科技有限公司;便隐血检测试剂盒(胶体金法) 艾博生物医药有限公司; 酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)试剂盒 上海艾莱萨生物科技有限 公司;TRIzol试剂 美国Thermo Fisher Scientific公司;5Χ All-In-One RT MasterMix反转录试剂盒、EvaGreen 2Χ qPCR MasterMix定量试剂盒 加拿大ABM生物科技有限公司;苏木精-伊红(hematoxylin-eosin,HE)染液、油红O染液 武汉赛维尔生物科技有限公司;总胆固醇(total cholesterol,TC)测定试剂盒、Glu测定试剂盒、甘油三酯(triglyceride,TG)测定试剂盒 中生北控生物科技股份有限公司;基因引物由生工生物工程(上海)股份有限公司合成。
1.2 仪器与设备
电动荧光显微镜 日本尼康公司;SPARK 10M酶 标仪 瑞士Tecan公司;Nanodrop 2000/2000C分光光 度计 美国Thermo Scientific公司;Χ960全自动医用聚合酶链式反应(polymerase chain reaction,PCR)分析 系统 力康生物医疗科技控股有限公司;Bioprep-24生物样品均质仪 杭州奥盛仪器有限公司。
1.3 方法
1.3.1 卡拉胶特征及剂量确定
本课题组前期测定了卡拉胶亚型和分子质量,确定其为κ-型,平均分子质量为300 400 Da,不含有低分子质量(<50 kDa)片段,分散性良好[15],符合食品级卡拉胶要求[4]。根据美国食品药品监督管理局推荐的人和小鼠之间有效剂量换算公式[16],确定卡拉胶实验剂量。
1.3.2 实验动物分组及处理
动物实验经中国海洋大学食品科学与工程学院动物伦理委员会批准后进行(编号SPΧY2019042001)。将77 只雄性C57BL/6Cnc小鼠适应性喂养1 周,之后随机分为2 组,低脂对照组(NC,11 只)饲喂10%低脂饲料(包含7%蔗糖,脂肪提供10%能量)、高脂饲料组(66 只)饲喂60%高脂饲料(包含7%蔗糖,脂肪提供60%能量)[17-18]; 5 周后,高脂饲料组小鼠的平均体质量(30.91 g)高于低脂饲料组小鼠(25.33 g)22%,肥胖模型构建成功。将66 只肥胖小鼠再随机分为6 组,每组11 只,包括高脂模型组(HFD,继续饲喂高脂饲料)以及不同剂量卡拉胶的高脂实验组(H0.05%、H0.5%、H1%、H2.5%、H5%,即将不同比例的卡拉胶掺入高脂饲料中饲喂小鼠)。受试物干预小鼠6 周后处死,实验周期共12 周。饲养温度23~25 ℃、相对湿度40%~55%,通风良好,昼夜各12 h,小鼠自由饮水和进食。实验设计流程如图1所示。
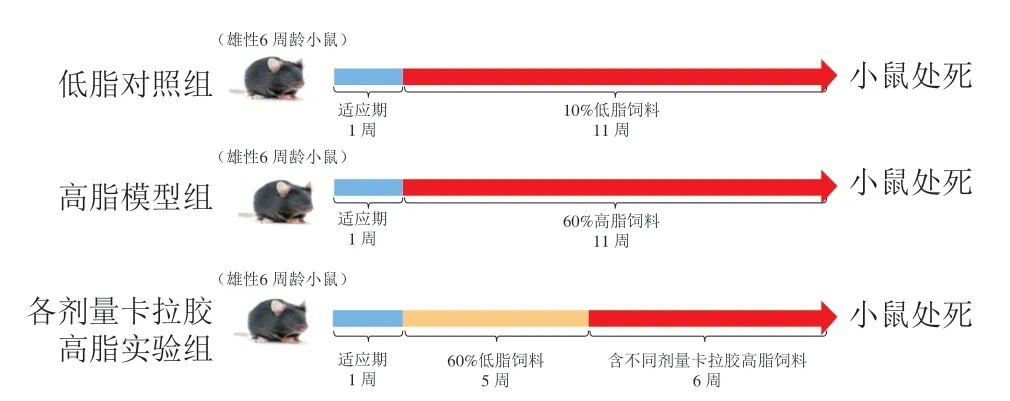
图1 动物实验设计流程Fig.1 Timeline flowchart for animal experiments
1.3.3 摄食量及疾病活动指数测定
小鼠饲养期间,每2 d称量摄食量;每3 周测定小鼠体质量,观察小鼠粪便性状,并通过试剂盒测定小鼠粪便隐血情况,并对体质量降低率、粪便性状、粪便隐血情况进行评分,按照式(1)计算疾病活动指数(disease activity index,DAI),DAI相关指标评分标准见表1[19]。


表1 DAI相关指标评分标准[19]Table 1 Relative evaluation criteria for DAI[19]
1.3.4 炎症介质蛋白和炎症因子基因的表达分析
采用ELISA法测定小鼠结肠中炎症介质的蛋白表达量。小鼠处死后取结肠约1 cm,用生理盐水将其制备成质量分数为10%的组织匀浆并按照4 ℃、7 500 r/min的条件离心5 min取上清液,通过ELISA试剂盒测定上清液中髓过氧化物酶(myeloperoxidase,MPO)活力及前列腺素E2(prostaglandin E2,PGE2)质量浓度[20-21],检测时严格按照试剂盒说明书进行操作,使用酶标仪在450 nm波长处测定各样品吸光度。
采用反转录(reverse transcription,RT)-PCR测定小鼠结肠中卡拉胶受体和炎症因子mRNA表达量。取结肠约1 cm,通过TRIzol法提取组织总RNA,利用Nanodrop 2000/2000C测定RNA质量浓度及纯度,琼脂糖凝胶电泳测定其完整性;采用5Χ All-In-One RT MasterMix反转录试剂盒将RNA反转录为cDNA;之后采用EvaGreen 2Χ qPCR MasterMix定量试剂盒进行定量PCR并按照ΔΔCT法计算Toll样受体4(Toll-like receptor 4,TLR4)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的基因相对表达量[9]。基因相关引物如表2[22]所示,以β-actin作为内参基因。PCR循环条件严格按照试剂盒说明书进行。
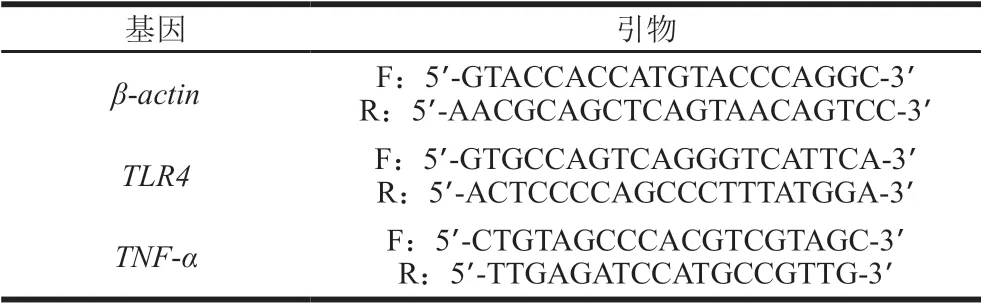
表2 RT-PCR引物[22]Table 2 Primers for RT-PCR used in this study[22]
1.3.5 组织病理学分析
每只小鼠均固定选取远端结肠约1 cm,立即放入质量分数4%多聚甲醛组织固定液中进行固定,以便后续制作切片。结肠组织进行石蜡包埋并切成4 μm切片,进行HE染色,使用电动荧光显微镜观察结肠健康状况,包括肠壁形态、肠黏膜结构、炎症浸润情况等[23]。按照式(2)计算组织学活动性指数(histologic activity index,HAI),以判断结肠炎发生情况,HAI相关指标评分标准如表3所示;同时采用ImageJ软件测量小鼠结肠隐窝深度,各组随机选定2 个切片,每个切片随机选取8~10 个视野,统计各组隐窝深度平均值。


表3 结肠炎症HAI相关指标评分标准[9]Table 3 Relative evaluation criteria for histological activity index of colonic inflammation[9]
1.3.6 体质量及体脂率测定
小鼠处死前测定最终体质量;小鼠处死后分别剥离皮下脂肪、附睾脂肪和肾周脂肪,称质量并按式(3)计算体脂率。

1.3.7 血清生化指标测定
小鼠经乙醚麻醉后,摘眼球取血于灭菌离心管中,15 000 r/min离心10 min后取上清液,按照试剂盒说明书测定血清中的TG、TC和Glu浓度,使用酶标仪在505 nm波长处测定血清吸光度。
1.3.8 脂质沉积测定
小鼠处死后取肝脏和附睾脂肪各约0.1 g,立即放入质量分数4%多聚甲醛组织固定液中进行固定,以便后续制作切片。脂肪组织进行石蜡包埋并切成4 μm厚切片,分别进行油红O染色和HE染色,使用电动荧光显微镜观察肝脏细胞和脂肪细胞的形态,并统计脂肪细胞大小。脂肪细胞采用荧光显微镜测量功能测量其半径,各组均随机选取3 个切片,每个切片随机选取4 个视野,每个视野随机选取20 个细胞。
1.4 数据处理与分析
采用GraphPad Prism 7.0软件作图,采用SPSS 19.0软件分析数据,数据均以平均值±标准差表示,组间采用单因素方差分析法分析。以P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 不同剂量卡拉胶对小鼠摄食量及DAI的影响
卡拉胶干预前后,各组小鼠摄食量均正常,实验结束后统计各组小鼠平均摄食量,结果表明摄食量在各组间无显著差异(P>0.05)(图2A)。实验过程中,小鼠DAI在各组间无显著差异(P>0.05)(图2B):各组小鼠体质量无减轻,卡拉胶高剂量组小鼠粪便较软,各组小鼠粪便隐血基本呈阳性。

图2 卡拉胶剂量对小鼠摄食量和DAI的影响 Fig.2 Effect of carrageenan dosage on food intake and DAI of mice
2.2 不同剂量卡拉胶对小鼠结肠中炎症介质和炎症因子表达的影响
如图3A所示,各组小鼠结肠中MPO活力无显著差异(P>0.05);如图3B所示,H1%(271.93 pg/mL)、 H2.5%(250.42 pg/mL)组PGE2分泌量显著低于HFD组(315.98 pg/mL),分别下降了13.94%(P<0.05)和20.75%(P<0.001);此外,H2.5%组PGE2分泌量与H0.05%(294.89 pg/mL)和H0.5%(310.05 pg/mL)组相比也分别下降了15.08%(P<0.05)和19.23% (P<0.001),表明2.5%的卡拉胶具有一定程度的抑制PGE2分泌的能力。

图3 卡拉胶剂量对小鼠结肠中炎症介质蛋白表达和炎症因子 mRNA表达的影响Fig.3 Effect of carrageenan dosage on protein expression of inflammatory mediators and mRNA expression of inflammatory factors in the colon of mice
持有“卡拉胶具有致结肠炎性”观点的研究者认为,卡拉胶在结肠中会被TLR4识别并结合,进而诱发结肠炎[8];而TNF-α是炎症发生过程中最初始和最重要的细胞因子,其调节并促进了其他细胞因子的释放[24]。因此本实验测定了TLR4和TNF-α基因在结肠中的表达量。如 图3C、D所示,各组小鼠结肠中卡拉胶的受体TLR4及促炎因子TNF-α的mRNA相对表达量之间均无显著差异 (P>0.05),说明剂量高达5%的食品级κ-卡拉胶无致结肠炎风险。
2.3 不同剂量卡拉胶对小鼠结肠病理学的影响
如图4所示,分别采用40×和200×显微镜对小鼠结肠进行观察,发现各组中大部分小鼠均结肠肠壁完整,厚度正常;肠黏膜结构比较完整,无明显炎症浸润[23],隐窝完整且排列有序,杯状细胞无明显减少,排列有序致密(图4)。各组小鼠结肠HAI及隐窝深度之间均无显著差异(P>0.05)(表4),进一步表明食品级κ-卡拉胶不会导致肥胖小鼠结肠炎症。
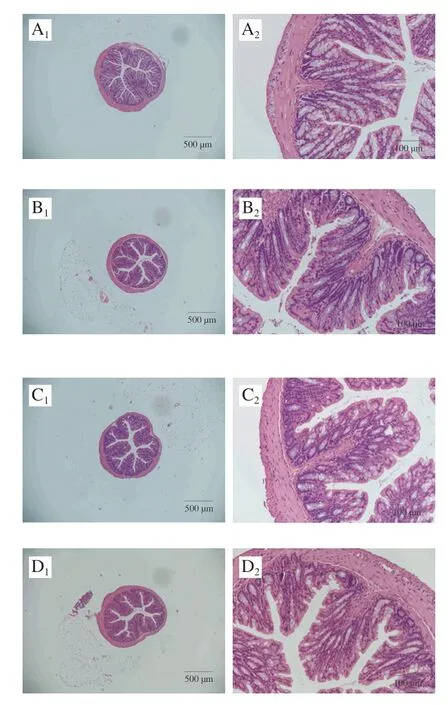
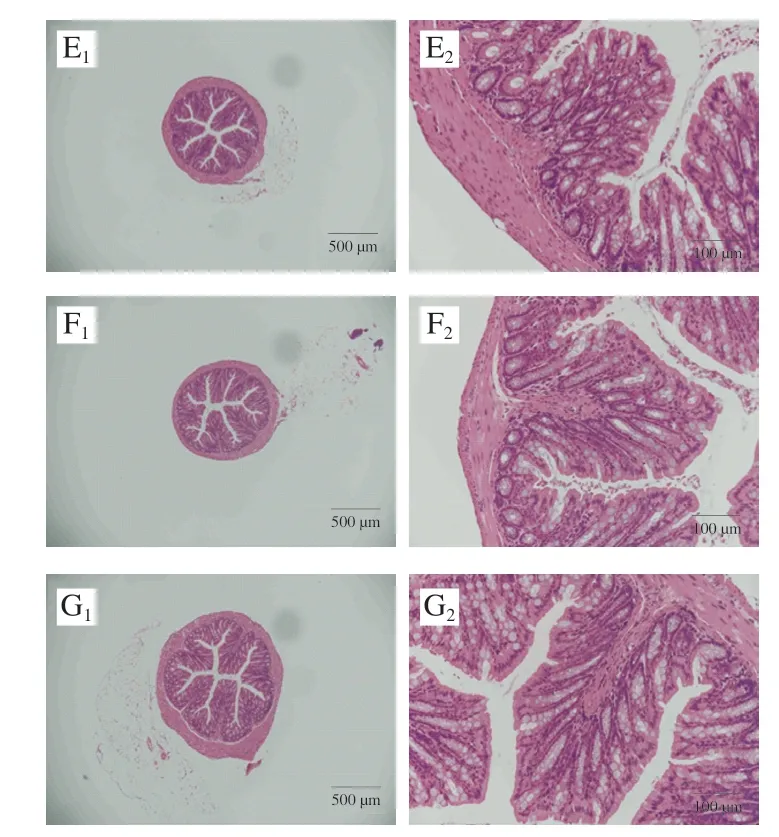
图4 小鼠结肠HE染色切片图Fig.4 Hematoxylin-eosin staining section of the colon of mice

表4 卡拉胶剂量对小鼠结肠结构的影响Table 4 Effect of carrageenan dosage on colonic structure of mice
2.4 不同剂量卡拉胶对小鼠体脂率的影响
根据动物肥胖模型构建标准,将模型组体质量相较于对照组上升超过20%定义为造模成功[25]。如图5所示,实验结束后,与NC组(体质量26.59 g、体脂率2.77%)相比,HFD组体质量(35.76 g)和体脂率(9.08%)显著升高,体质量增加34.49%(P<0.001);而与HFD组相比,H5%组(体质量32.00 g、体脂率5.66%)小鼠体质量和体脂率显著降低,二者分别下降了10.51%(P<0.05)和37.67%(P<0.001),说明5%卡拉胶对肥胖小鼠具有降脂减重的作用。
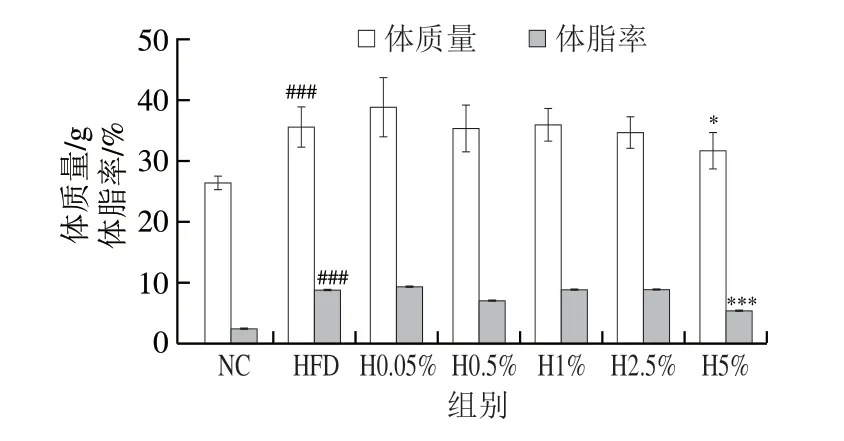
图5 卡拉胶剂量对小鼠体质量及体脂率的影响Fig.5 Effect of carrageenan dosage on body mass and body fat percentage of mice
2.5 不同剂量卡拉胶对小鼠血清生化指标的影响
如图6所示,与NC组(Glu浓度5.90 mmol/L、TC浓度3.64 mmol/L)相比,HFD组小鼠血清中Glu浓度(8.24 mmol/L)和TC浓度(4.85 mmol/L)显著 升高(P<0.05),分别上升了39.66%和33.24%。而H5%组具有一定的降低肥胖小鼠血清Glu、TG和TC浓度的作用(P>0.05)。

图6 卡拉胶剂量对小鼠血糖血脂水平的影响 Fig.6 Effect of carrageenan dosage on glucose and lipid levels in serum of mice
2.6 不同剂量卡拉胶对小鼠脂质沉积的影响
如图7所示,与NC组(28.86 μm)相比,HFD组(53.15 μm)附睾脂肪细胞半径高度显著增大 (P<0.001)。高剂量卡拉胶(H1%、H2.5%和H5%)高度显著减小了附睾脂肪细胞尺寸,H1%组(47.09 μm)小鼠附睾脂肪细胞半径与HFD组相比下降了11.40%,H2.5%组(45.56 μm)和H5%组(36.36 μm)与HFD组相比分别下降了14.28%和31.59%(P<0.001), 其中H5%组的效果最为明显。上述结果进一步说明剂量为5%的食品级κ-卡拉胶掺入饲料中对肥胖小鼠具有减少脂质蓄积的作用。

图7 卡拉胶剂量对小鼠附睾脂肪细胞半径的影响Fig.7 Effect of carrageenan dosage on epididymal adipocyte radius of mice
如图8肝脏油红O染色切片图所示,与NC组相比,HFD组和H0.5%组小鼠肝脏脂质沉积明显加剧,而高剂量卡拉胶具有减少脂质沉积的作用,进一步印证了上文中结论,即高剂量卡拉胶,尤其是剂量为5%的卡拉胶具有改善肥胖小鼠体脂蓄积的作用。


图8 小鼠肝脏油红O染色切片图(100×)Fig.8 Oil red O stained sections of the liver of mice (100 ×)
3 讨 论
本研究结果表明,0.05%~5%的食品级κ-卡拉胶掺入高脂饲料中饲喂小鼠6 周后,其结肠炎症相关指标(DAI、结肠中MPO活力及炎症因子mRNA相对表达量)以及结肠结构(隐窝深度、HAI)与HFD组相比并没有发生显著变化(P>0.05),说明剂量高达5%的食品级κ-卡拉胶不会诱发肥胖小鼠结肠炎症。该结论与大多数研究中高分子质量卡拉胶不会诱发肠道毒性的结论[10,26]一致。事实上,对于卡拉胶能否诱发肠道炎症的争议,一定程度上源于一些研究人员及普通民众对卡拉胶及降解卡拉胶概念上的混淆[4]。很多有关卡拉胶安全性报道中的结论未考虑卡拉胶的特征,尤其是分子质量,从而导致错误的结论或者读者的误解。如Myers[27]和Borthakur[28]等利用卡拉胶探究炎症机制时,直接采用“carrageenan”的说法而未提及其分子质量,读者因此直接默认“卡拉胶”具有致炎性,公众由此对卡拉胶的安全性产生疑虑和恐慌。因此,卡拉胶本身的特征,如分子质量及分布、亚型及纯度等的鉴定及辨别对卡拉胶安全性的结论和解释是极其重要的。本研究采用的食品级κ-卡拉胶,平均分子质量为300 400 Da,分散性良好,且不含有低于50 kDa的低分子质量片段,这是其未导致机体结肠炎症的重要原因。同时,卡拉胶的蛋白反应性使其与饲料中的蛋白质相结合,从而减少了游离卡拉胶在肠道中的直接暴露[11],这也是高分子质量卡拉胶作为添加剂不会诱发机体肠道炎症的原因之一。此外,本研究发现1%和2.5%的卡拉胶还具有降低肥胖小鼠结肠中PGE2分泌量的作用,且H2.5%组与HFD组相比PGE2分泌量降低20.75%(P<0.001),该现象是否表明一定剂量的 食品级κ-卡拉胶具有肠道保健作用,还需后续实验进一步探究。
卡拉胶降脂减重的作用已经被很多研究所证明。如Chin等[29]的研究表明5%卡拉胶通过上调脂肪降解相关基因的表达而起到减缓脂质沉积和肥胖相关代谢综合征的作用。本研究结果同样表明5%食品级κ-卡拉胶具有显著降低肥胖小鼠体质量(10.51%)、体脂率(37.67%)和脂肪细胞半径(31.59%)的作用(P<0.05);此外,5%卡拉胶对于肥胖小鼠血糖血脂水平也具有一定的降低作用,但影响并不显著(P>0.05),该结果与Chin等[29]的研究结果具有一致性。然而,也有研究表明,卡拉胶摄入能够抑制胃蛋白酶的活性并降低多种食物蛋白的酶解效率,这是卡拉胶的蛋白反应性导致蛋白质、多肽以及氨基酸的生物利用度降低造成的[30]。这也可能是卡拉胶导致食物营养素吸收不良,从而造成小鼠糖脂代谢减缓、体质量减轻的原因之一。因此,对于高剂量卡拉胶的降脂减重作用究竟通过何种机制,对机体是有益的或不利的,还需要后续研究进一步论证。
综上,本研究表明,剂量高达5%的食品级κ-卡拉胶对小鼠进行膳食干预不会诱发肥胖小鼠结肠炎症,且5%卡拉胶具有降脂减重的作用,但其机制还需进行深入研究。本实验可为卡拉胶安全性研究提供新思路。

