庚醛与亚硫酸氢钠加成反应动力学研究
袁慎峰,万周娜,陈志荣,尹红
(浙江大学化学工程与生物工程学院,浙江省化工高效制造技术重点实验室,浙江杭州 310027)
引 言
煤间接液化中,费托合成的工业应用规模最大[1]。费托合成产物经进一步工艺处理可以得到混合醇,其中高碳醇可用作增塑剂或洗涤剂,具有良好的应用前景[2]。然而费托合成产物中还存在脂肪醛,其沸点与醇烃混合物接近,采用普通精馏或萃取手段难以分离。生物油的生产中会副产醛,这些醛具有较高的反应活性,增大了生物油在运输过程中的不稳定性[3-4]。此外,许多合成反应中有时会用到过量的醛[5-7],这些醛难以从反应产物中分离,制约了产物纯度的提高。为了得到高纯度的高碳醇,或是提高生物油的稳定性,亦或是制备一些高纯度的产物,需要研究高效除醛的方案。
目前分离醛酮等羰基化合物的方法主要有反应萃取法[8-10]、固体吸附法[11-13]以及催化加氢法[14-15]。其中固体吸附法操作复杂,而催化加氢法依赖于催化剂的性能和寿命,需进一步研究高活性和高稳定性的催化剂。相比之下,反应萃取法更容易操作且适用性强。反应萃取法是利用亚硫酸氢钠与醛反应生成溶于水而不溶于有机溶剂的加成物的特点,将化学反应与溶剂萃取结合,除去混合物中的醛。Boucher等[9]和Furigay等[10]利用亚硫酸氢钠与醛快速反应的性质,结合溶剂萃取,去除底物中的醛,以丁酸苄酯和茴香醛为原料,考察了多种溶剂和萃取剂对醛去除率的影响,发现最佳条件下醛的去除率可达99%。
研究反应萃取需要明确醛与亚硫酸氢钠加成反应的动力学。目前关于醛酮与亚硫酸氢钠反应动力学的研究多集中于低碳醛或芳香醛,如甲醛、乙醛、异丁醛、苯甲醛及其衍生物等,分析方法则采用碘量滴定法[16-17]或紫外分光光度法[18-20]等。
碘量滴定法假定碘的存在不会影响加成物的分解过程,在溶液加入一定量的加成物和碘溶液,根据碘的消耗量计算分解产生的亚硫酸氢钠浓度,由此测定分解反应的平衡常数和速率常数,间接计算得到加成反应的速率常数。
实际上,许多研究指出[21-22],碘量滴定法中,碘的加入会导致加成物磺酸钠快速分解,而得出错误的结论。Sousa等[22]采用紫外分光光度法重测了α-羟基苯甲基磺酸钠在水中的分解平衡常数,结果比Stewart等[16]由碘量法测定的值小一个数量级。
紫外分光光度法需要制备空白溶液,操作较为复杂,且亚硫酸氢钠和α-羟基磺酸钠会干扰醛类的紫外吸收。此外,碘量法和紫外分光光度法等离线方法,在取样之后需要先终止反应,常采用外加冷冻酸性碘液的方法,可能会导致加成物分解而产生误差。
近年来,在线红外技术已广泛应用于反应机理和动力学等方面的研究[23-26]。相比其他分析手段,在线红外技术无须取样和制备样品,扫描速率快、分辨率高,可用于分析不易取样或速度很快的反应[27]。Rao等[28]通过在线红外技术对酮的烯醇化和甲基化过程进行研究,根据二阶微分处理后酮羰基吸收峰的峰高和反应物浓度间的对应关系,构建了单变量定量模型,据此确定起始材料的消耗率,通过对红外谱图的整体分析,结合离线HPLC数据,构建多变量定量模型,据此预测不同立体异构体的相对数量。Deng等[29]通过在线红外技术监测了四氢呋喃的开环聚合过程,根据特征峰的吸光度确定线性聚合物和环状单体的瞬时浓度,进一步研究聚合的热力学和动力学,求得反应的平衡常数和速率常数。
费托合成得到的高碳醇烃混合物中含有少量不同碳数的醛,本文以庚醛作为代表,采用在线红外法,对庚醛与亚硫酸氢钠的反应动力学进行研究。
1 实验试剂与方法
1.1 试剂与仪器
正庚醛[CH3(CH2)5CHO),纯度97%],亚硫酸氢钠(NaHSO3,纯度99.9%)、四氢呋喃(THF,纯度≥99.5%,GC),上海麦克林生化科技有限公司。
W2-100SP型恒温浴锅,上海申生科技有限公司;DWFY-5L/30低温恒温反应浴、GS12-2型电子恒速搅拌器,台州市信力电子设备有限公司;ReactIR 702L型在线红外光谱仪、XS4002S型分析天平、ML303型分析天平,梅特勒-托利多仪器(上海)有限公司。
庚醛与亚硫酸氢钠的加成反应研究在ReactIR 702L型在线红外光谱仪上进行,该仪器主要由主机以及光纤探头组成,探头顶端为金刚石材料制作的ATR元件,检测范围为3000~650 cm-1,分辨率为8 cm-1,配备ICIR 7.1分析系统,可实时进行红外分析处理。
1.2 实验方法
本文采用四氢呋喃作为助溶剂加入亚硫酸氢钠水溶液中,其性质稳定,在促进庚醛和亚硫酸氢钠水溶液混溶的同时,不会引入其他反应。
动力学实验具体过程为:反应前,将在线红外光谱仪的检测探头置于空气中收集空气背景,然后称取一定量的四氢呋喃、水和亚硫酸氢钠于反应器内并开启加热,将探头浸没在反应液中,开始在线检测,待溶液加热至设定温度,亚硫酸氢钠完全溶解,且基线稳定后,加入一定量庚醛进行反应,每隔一段时间扫描一次样品红外谱图,其间用机械搅拌保持反应液混合均匀。实验装置如图1所示。采用四口烧瓶作为反应器,各支管口分别装备恒速搅拌器、在线红外光纤探头和温度计。

图1 实验装置示意图Fig.1 Schematic diagram of the experimental apparatus
2 实验结果与讨论
2.1 在线红外谱图的分析与定量
图2为不同时刻反应液的红外谱叠加图,左上角为局部放大图。观察可知,随着反应的进行,1728 cm-1处吸收峰的吸光度逐渐减弱,这是醛羰基C O逐渐消耗所致,而1172 cm-1处为α-羟基庚烷基磺酸钠上C—O的伸缩振动吸收峰,随着加成物的生成,其吸光度逐渐增强。

图2 反应过程红外光谱叠加图Fig.2 Overlay of IRspectra of the reaction process
红外光谱经过二阶微分处理,谱带的特征得以进一步强化,可以更有效地消除基线的漂移,克服谱带的重叠。在研究浓度范围内,配制不同浓度的α-羟基庚烷基磺酸钠,检测其在线红外光谱,对红外光谱进行二阶微分处理[图3(a)],建立1172 cm-1吸收峰峰高与α-羟基庚烷基磺酸钠浓度的线性定量关系[图3(b)]。经检验,在研究温度范围内,可以忽略温度对定量关系的影响,采用同一个定量关系,即

图3 浓度与峰高线性定量关系Fig.3 The relationship between concentration and peak height

式中,CC为α-羟基庚烷基磺酸钠的浓度,mol∙L-1,H为二阶微分处理后1172 cm-1处的峰高。定量模型相关性系数R2为0.9999,且各个点重复测量的RSD<2%,偏差较小,方法较为准确可靠。
2.2 模型机理
参考文献[19-21],羟基烷基磺酸盐的形成可能涉及的反应有亚硫酸氢根、羟基烷基磺酸根的电离,醛与亚硫酸氢根、亚硫酸根的加成,以及醛的水合等。
亚硫酸盐与羰基的加成不受一般酸或碱的强烈催化[30],pH<1时,才有明显的酸催化作用。本研究体系无外加酸,溶液pH=3.2~5.1,呈弱酸性,据文献[21]报道,亚硫酸氢根电离常数Ka=6.31×10-8mol·L-1,故溶液中亚硫酸氢根浓度远大于亚硫酸根浓度,可以忽略亚硫酸氢根的电离,而醛加成物阴离子电离常数很小,可以忽略其电离。因此,研究条件下主要反应为醛的水合以及醛与亚硫酸氢根的加成,其中水合反应快速达到平衡,而加成反应为控制步骤。
庚醛与亚硫酸氢钠的加成反应式如下:

初始时刻,有CA0=a,CB0=b,CC0=0。
假设其动力学方程形式为:

反应过程中,游离庚醛(A)与水合庚醛(AH)保持平衡,即

忽略反应过程中的体积变化,由质量守恒:

将式(5)代入式(2)得:
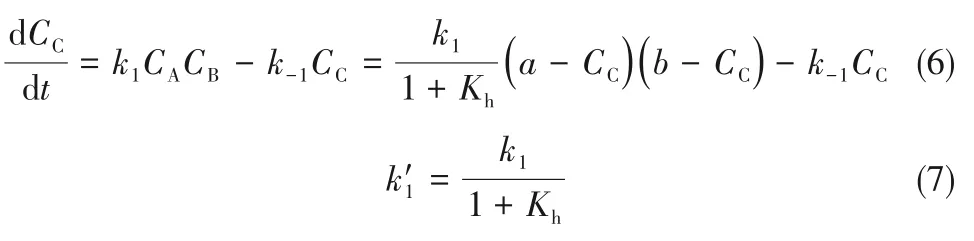
将式(7)代入式(6)得:

2.3 模型参数确定
通过在线红外,监测了283.15~298.15 K四氢呋喃水溶液中庚醛与亚硫酸氢钠的反应过程,得到α-羟基庚烷基磺酸钠浓度随时间的变化,然后通过Matlab程序对模型参数进行估算,采用ode45函数求解式(8),同时采用非线性最小二乘法函数lsqnonlin,以浓度实验值与计算值的残差平方和为最优化目标,拟合得到模型参数k'1和k-1,图4为不同条件下实验值与计算值的对比。观察可知,各组数据拟合良好。模型参数估计结果如表1所示。

图4 不同温度下计算值与实验值的比较Fig.4 Comparison of calculated values with experimental data at different temperatures
283.15~298.15 K下,将庚醛加入四氢呋喃水溶液中,根据初始和平衡时1728 cm-1处吸收峰的峰高,由式(9)计算庚醛的水合常数Kh,结果见表1。据文献[31]报道,293.15 K下,庚醛的水合常数为0.2788,本研究中为0.2748,与文献值相近,结果较为可靠。将Kh、k'1代入式(7),计算得到k1,再根据式(10),可求得庚醛与亚硫酸氢钠加成反应的平衡常数K1,结果见表1。观察可知,随着温度T升高,反应速率常数k1增大而平衡常数K1减小,说明庚醛与亚硫酸氢钠的加成反应为放热过程,随着温度升高,庚醛反应速率增大而平衡转化率减小。

表1 速率常数和平衡常数Table 1 Rate constantsand equilibrium constants

根据Arrhenius方程,分别以lnk1、lnk-1对T-1作图,如图5所示。求得庚醛与亚硫酸氢钠加成反应正反应的活化能Ea1为34.68 kJ∙mol-1,指前因子k1,0为1.369×107L∙mol-1∙min-1;逆反应的活化能Ea-1为94.69 kJ∙mol-1,指前因子k-1,0为2.500×1015min-1。根据van’t Hoff方程,以lnKh、lnK1对T-1作图,如图5所示。求得庚醛的水合反应热为-20.12 kJ∙mol-1,庚醛与亚硫酸氢钠加成反应的反应热ΔH为-60.01 kJ∙mol-1。图5中反应速率常数、平衡常数与温度的相关性良好,能很好地预估不同温度下反应速率常数和平衡常数的变化。

图5 ln k1、ln k-1、ln Kh、ln K1与T-1的关系Fig.5 ln k1,ln k-1,ln Kh,ln K1 versus T-1
羰基化合物与亚硫酸氢钠的加成反应主要受电子效应和位阻效应的影响。表2为庚醛及一些羰基化合物与亚硫酸氢钠加成反应的反应热ΔH与活化能Ea1。其中,丙酮的羰基两边均与供电子的烷基相连,羰基碳正电性最弱,因此反应活性最低;醛类中,芳环的供电子能力比烷基更强,因此芳香醛比脂肪醛的反应活性低,而烷基的碳数越多,供电子能力越强,所以亲核加成反应的活泼性顺序为:丙酮<苯甲醛<庚醛<乙醛<甲醛。此外,从加成产物的空间位阻来看,按上述反应活泼性增加的顺序,空间位阻降低,加成产物的能态也随之降低。因此,庚醛的反应活化能应小于苯甲醛,大于甲醛、乙醛;庚醛的反应热绝对值应大于苯甲醛、丙酮,而小于甲醛、乙醛。由表2可见,实际结果与上述分析相符,因此本文的动力学结果较为合理。

表2 羰基化合物与亚硫酸氢钠加成反应的反应热与活化能Table 2 The reaction heat and activation energy of the reaction between carbonyl compound and NaHSO3
根据文献[35-36],甲醛的水合反应热为-27 kJ∙mol-1,乙醛的水合反应热为-23 kJ∙mol-1,本文求得的庚醛水合反应热为-20.12 kJ∙mol-1,放热值略小于乙醛,较为合理。
3 结 论
通过在线红外光谱可以实时跟踪庚醛与亚硫酸氢钠加成反应过程,开始反应后C O双键吸光强度随时间变化不断减弱,C—O单键吸光强度随时间变化不断增强,反应完成后趋于定值。根据不同α-羟基庚烷基磺酸钠浓度下1172 cm-1吸收峰峰高,建立单变量定量模型,可对反应过程中组分浓度进行计算。
庚醛与亚硫酸氢钠的加成反应为放热过程,随着温度升高,平衡转化率减小,由283.15~298.15 K温度下反应的平衡常数求得庚醛的加成反应热ΔH为-60.01 kJ∙mol-1。假设反应速率对庚醛、亚硫酸氢钠和α-羟基庚烷基磺酸钠均为1级,建立动力学模型,通过Matlab拟合实验数据确定了各动力学模型参数,庚醛与亚硫酸氢钠加成反应的动力学方程可表示为:

符号说明
a——初始庚醛浓度,mol∙L-1
b——初始亚硫酸氢钠浓度,mol∙L-1
Ci——物质i的浓度,mol∙L-1
Ea——活化能,kJ∙mol-1
ΔH——反应热,kJ∙mol-1
Ka——电离常数,mol∙L-1
Kh——水合常数
K1——加成反应平衡常数,L∙mol-1
k1——正反应速率常数,L·mol-1·min-1
k-1——逆反应速率常数,min-1

R——气体常数,8.314 J·mol-1·K-1
ri——反应速率,mol∙L-1∙min-1
T——反应温度,K
t——反应时间,min
下角标
A——庚醛
AH——水合庚醛
B——亚硫酸氢钠
C——α-羟基庚烷基磺酸钠
eq——平衡态
0——初始态

