心内膜室间隔射频消融治疗肥厚型梗阻性心肌病的疗效分析
蔡迟 王靖 楚建民 牛红霞 鄢定红 贾玉和 华伟 张澍
肥厚型心肌病(hypertrophic cardiomyopathy,HCM)是一种常染色体显性遗传的心肌疾病,其病理改变以非对称性室间隔肥厚,心肌细胞肥大、排列紊乱,心肌间质纤维化为主要特征[1]。伴有左室流出道(left ventricular outflow tract,LVOT)梗阻的HCM 称为肥厚型梗阻性心肌病(hypertrophic obstructive cardiomyopathy,HOCM),其 中 约1/2 患者为静息LVOT 梗阻,另有约1/2患者为运动激发LVOT 梗阻[2]。既往研究表明,LVOT 梗阻与HCM 患者不良预后显著相关[3]。肥厚室间隔心肌收缩期凸入LVOT,引起二尖瓣前叶收缩期前向运动(systolic anterior motion,SAM)并与肥厚室间隔接触,导致LVOT 内径狭窄是LVOT 梗阻的主要致病机制[4]。射频消融目前已在临床上广泛用于治疗快速型心律失常。近年来,心内膜室间隔射频消融治疗(endocardial radiofrequency ablation of septal hypertrophy,ERASH)逐渐成为减轻HOCM 患者LVOT 梗阻的新方法[5]。随着心脏三维电解剖标测与心腔内三维超声(intracardiac echocardiography,ICE)技术出现,在其指导下的ERASH 能够清晰定位SAM-室间隔区及心脏传导系统,不仅可精准消融SAM-室间隔区肥厚心肌,而且能够降低消融损伤传导系统发生率,使肥厚室间隔水肿及萎缩,减轻LVOT 梗阻,缓解临床症状及改善临床预后。然而,目前有关ERASH 治疗HOCM 的临床研究较少,其可行性及有效性尚需进一步评价。笔者分析ERASH 治疗国人HOCM 的临床疗效,进一步探讨该技术的可行性及有效性。
1 资料与方法
1.1 病例资料 收集阜外医院2019年9~11月间接受ERASH 治疗的HOCM 患者临床资料。入选标准为:①室间隔呈不对称性肥厚,室间隔厚度与左室后壁厚度之比>1.3,室间隔厚度至少≥15 mm;②SAM 征阳性;③经充分药物治疗后,静息或运动激发左室流出道压差(left ventricular outflow tract gradient,LVOTG)≥50 mm Hg[6];④患者拒绝外科室间隔切除术、经皮室间隔化学消融术(PTSMA)及双腔起搏器等治疗。排除标准为器质性心脏病所致左室肥厚以及肥厚型非梗阻性心肌病。所有患者签署了书面知情同意书。
1.2 基线资料及随访资料 回顾性收集患者的临床资料,包括年龄、性别、体重指数(body mass index,BMI)、NYHA 分级及用药史等。术前、出院时、术后3个月及6个月时进行超声心动图检查,用于评估室间隔厚度、静息和运动激发LVOTG 以及心功能等。
1.3 标测及消融过程 在局麻下穿刺右侧股静脉,置入ICE导管(SOUNDSTAR,美国强生公司)于右室流入道及流出道,结合CARTO3 三维电解剖标测系统(CartoSound 模块,美国强生公司),通过ICE不同左室长轴及短轴超声扇面进行左室腔三维建模,并在CARTO3三维模型上标记出SAM-室间隔区(图1A 和B)。穿刺右侧股动脉经主动脉逆行途径将冷盐水灌注消融导管(THERMOCOOL,美国强生公司)置于SAM-室间隔区,在该区域上标测出His束、左束支、左前分支及左后分支电位分布范围,并分别在CARTO3三维模型上标记取点(图1C和D)。消融靶点定义为消融导管头端无左束支及分支电位的SAM-室间隔区(图1E 和F)。消融过程中ICE导管实时监测消融导管头端运动轨迹,确保其与SAM-室间隔区贴靠良好,避免在消融的过程中导管移位损伤主动脉瓣或者心脏传导系统。消融过程中一旦出现左束支阻滞、房室传导阻滞或交界区心律,应立即停止放电,移动导管位置后可继续消融。以功率控制模式,功率输出30~35 W,盐水流速17 ml/min,温度上限43~45℃。消融终点定义为LVOTG 较术前下降>50%伴有SAM 征减弱或消失。所有患者在手术结束时常规置入临时起搏器备用起搏。
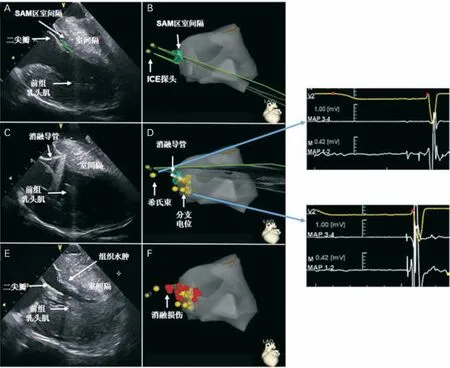
图1 CARTO3及ICE指导下的HOCM 标测及射频消融
1.4 统计学分析 采用SPSS22.0软件包进行数据统计学处理。计量资料采用Mean±SD,配对资料比较采用配对样本t检验进行分析。计数资料以百分数(%)表示。以P<0.05为差异有显著性。
2 结果
本研究共5例,基线临床资料见表1。本组患者年龄为(59±15)岁,男性2 例(40.0%),BMI为(26.4±3.2)kg/m2。入组患者平均室间隔厚度为(23.4±1.7)mm,术前LVOT 静息压差为(98.2±22.6)mm Hg,运动激发LVOTG 为(130.0±25.6)mm Hg,左 室射血分数(LVEF)为0.67±0.05,4例NYHA分级为Ⅲ级,余1例为Ⅳ级。HOCM 患者消融术前均接受过β受体阻滞剂和(或)地尔硫艹卓药物治疗。所有HOCM 患者既往均未接受过外科室间隔切除术、PTSMA 以及起搏器治疗,入组患者均首次接受ERASH 治疗。
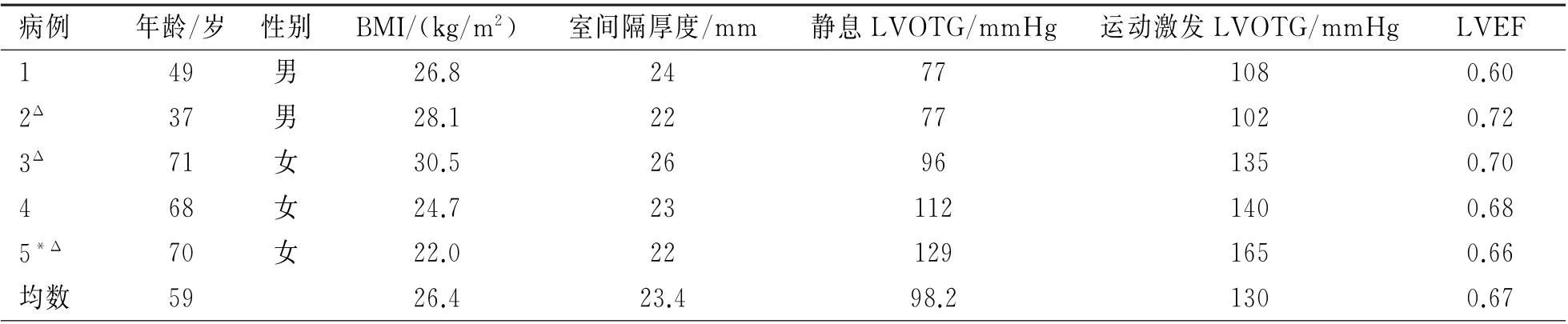
表1 基线临床资料
ERASH 术中参数资料见表2。术中标记SAM-室间隔区面积为[5.2±1.6(3.1~7.0)cm2],消融面积为[3.7±1.6(2.3~6.4)cm2],消融点数为(18.2±4.7)个,手术时间为(135±26.9)min,消融时间为(20.8±4.8)min,X 线曝光时间(14.8±2.2)min。
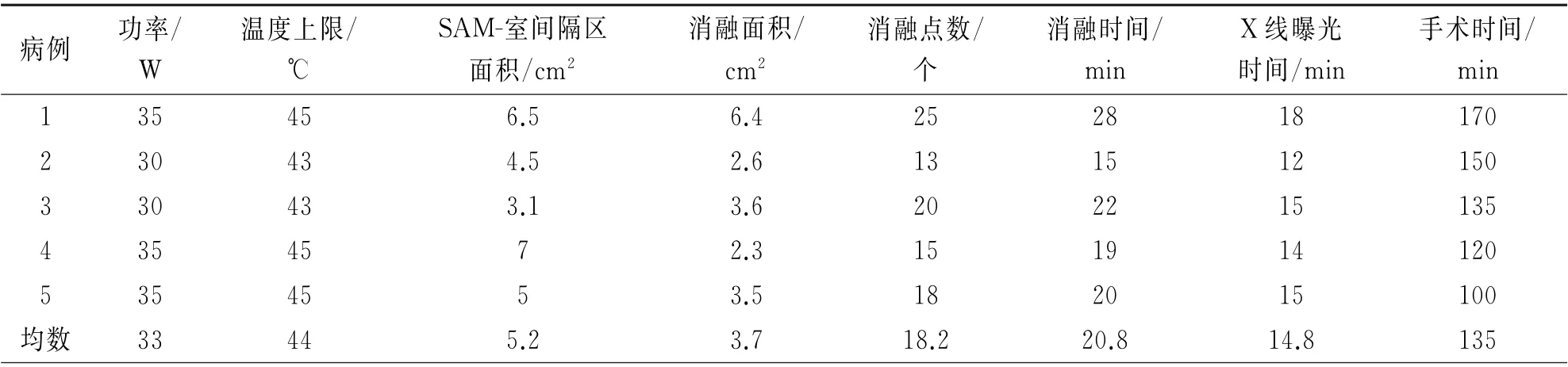
表2 射频消融手术资料
随访6 个月,术后静息LVOTG(35.2±6.7)mm Hg及运动激发LVOTG(47.6±5.6)mm Hg,均较术前明显减低(表3和4)。所有患者SAM 征不同程度减轻或消失。术后3例患者NYHA 分级改善为Ⅰ级,2例患者NYHA 分级改善为Ⅱ级。术后室间隔厚度(22.4±1.5)mm 与LVEF(0.65±0.04),较术前无显著性变化。
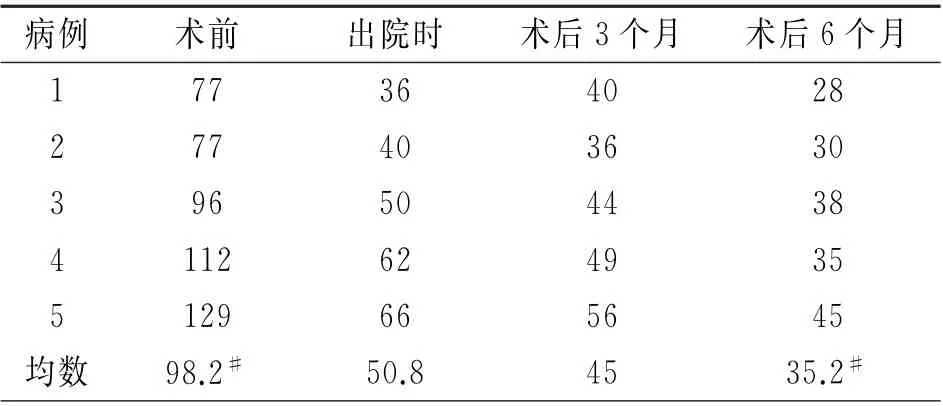
表3 5例患者射频消融术前及随访期静息LVOTG 变化/mm Hg

表4 5例患者射频消融术前及随访期运动激发LVOTG 变化/mm Hg
1例(患者5)在消融结束回撤导管时发生一过性房室传导阻滞,约5 min后房室传导自行恢复。2例(患者1和3)在放电消融时发生一过性左束支传导阻滞,停放电即刻左束支传导恢复正常。所有患者术中及术后均未发生射频消融相关并发症,包括严重房室传导阻滞、恶性心律失常、急性肺水肿及心包积液等,临时起搏器保留2~3天后均顺利拔除。
3 讨论
本研究报道了ERASH 治疗国人HOCM 的初步临床应用,探讨了该技术的可行性及有效性。本小规模临床研究共纳入5例药物难治性HOCM 患者,通过结合三维电解剖标测及ICE技术,精准地定位SAM-室间隔区及心脏传导系统,在未损伤心脏传导系统的前提下进行肥厚室间隔射频消融。本研究结果表明,ERASH 治疗能够显著降低HOCM 患者LVOTG 并改善其临床症状,具有良好的可行性及有效性。
目前,对于伴有严重临床症状和LVOT 梗阻的患者,外科室间隔切除术是HOCM 治疗的金标准[1]。然而,外科术后发生左束支传导阻滞比例接近100%,完全性房室传导阻滞率约5%,围手术期死亡率约3%~4%[7],故仅限于经验丰富的心脏中心开展[8]。PTSMA 是将无水酒精选择性注入间隔支动脉,使室间隔凝固性坏死及变薄,从而明显降低LVOTG。PTSMA 需要有合适的冠状动脉靶血管,而约有5%~15%患者无理想的间隔支[9]。此外,PTSMA 导致冠状动脉夹层、房室传导阻滞及潜在致心律失常风险均较高[10]。双腔起搏器治疗有助于降低LVOTG,但不能真正改善HOCM 患者的临床症状,其症状改善获益主要为安慰剂效应[11]。
外科室间隔切除术、PTSMA 以及起搏器治疗均有局限性,尚不能满足所有临床患者的治疗需求。2004年,Lawrenz等[12]首次报道了射频消融治疗HOCM 降低LVOTG 的病例,该研究采用经胸心脏超声指导下进行右侧室间隔面射频消融,LVOTG由术前107 mm Hg降至53 mm Hg。此后,冷盐水灌注消融导管、三维电解剖标测及ICE 技术迅速发展,这为精准消融肥厚室间隔提供了可能性,越来越多的心脏中心相继开展射频消融治疗HOCM 的临床研究[13-17]。Lawrenz等[18]对19例HOCM 患者行ERASH,可显著降低静息LVOTG 约62%,减低运动激发LVOTG 约60%,NYHA 分级显著改善。Sreeram 等[13]对32 例 儿 童 HOCM 患 者 行ERASH,研究发现LVOTG 由术前(78.5±26.2)mm Hg降至术后(36.1±16.5)mm Hg。2016 年,Cooper等[15]首次报道了应用ICE 导管结合Carto-Sound模块对4例HOCM 患者行ERASH,LVOTPG 由术前(64.2±50.6)mm Hg 降至(12.3±2.5)mm Hg,运动激发LVOTPG 由术前(93.5±30.9)mm Hg降至(23.3±8.3)mm Hg。与既往研究结果相似,本研究中ERASH 治疗HOCM 术后6个月静息LVOTG 较术前降低64.2%,与外科手术及PTSMA 治疗效果相当(分别可降低77%与71%)[19],NYHA 分级亦明显改善。然而,本研究中ERASH术后室间隔厚度较术前平均减少仅为1 mm,明显低于外科手术及PTSMA 室间隔减少程度(分别可减少8 mm 及5~6 mm)[20-21]。
无论是外科室间隔切除术或PTSMA,其治疗原理是使肥厚室间隔心肌变薄,增宽LVOT 内径,从而减轻LVOTG。然而,ERASH 则是通过消融导管释放射频电流于SAM-室间隔区肥厚心肌,消融早期使室间隔心肌组织温度升高,产生界限清楚的心肌水肿反应,使室间隔心肌顺应性减低及运动失协调待心肌水肿消退后心肌凝固性坏死、瘢痕化及挛缩,使缩窄的LVOT 恢复通畅,从而实现减轻LVOTG。因此,ERASH 主要通过损伤及顿抑“关键”部位的SAM-室间隔区肥厚心肌以减轻LVOT梗阻,而在减少室间隔厚度方面作用较小,并非通过消融导致室间隔心肌大面积坏死。与既往传统治疗方法相比,ERASH 避免了外科开胸手术,且不易损伤正常传导组织及诱发室性心律失常。此外,射频消融可在ICE 引导下对梗阻最严重部位精准消融,减少无效消融范围,且不受间隔支动脉解剖变异的影响。对于消融术后LVOT 压差下降不佳的患者,可进行二次ERASH,而再次室间隔射频消融并未增加手术风险[18]。
在HOCM 患者中,心脏传导系统(包括左束支、左前分支及左后分支)可能直接走行于主动脉窦下的SAM-室间隔区心肌表面,故消融可能会直接损伤或水肿效应波及到心脏传导组织,引起房室传导阻滞。一项荟萃分析显示,ERASH 治疗HOCM 不能完全避免严重房室传导阻滞,其发生率为8.8%[22]。目前的三维电解剖标测联合ICE 辅助下行ERASH 治疗不仅可实时显示消融导管头端与消融靶区域的接触部位及贴靠程度,同时可将希浦系电位标记在三维电解剖模型上,从而可降低心脏传导系统损伤发生率。本研究中消融后出现的一过性三度房室传导阻滞可能是因为消融水肿反应所致,而消融中出现的一过性左束支传导阻滞则是因消融直接损伤左束支所致。因此,消融过程中需时刻密切关注心电图,一旦心电图提示传导组织损伤,应立即停止消融,移动导管头端位置后可再次尝试消融。
综上所述,本研究结果显示三维电解剖标测联合ICE 辅助下ERASH 治疗能够减轻难治性HOCM 患者LVOTG,明显改善其生活质量,术后无消融并发症发生,具有良好的可行性及有效性。ERASH 作为一项治疗HOCM 的新技术,有望成为不适合或不耐受外科室间隔切除术和PTSMA 的HOCM 患者的替代治疗方法,使更多难治性HOCM 患者获益。

