东莞地区幽门螺杆菌感染儿童的抗生素耐药基因突变现状调查*
陈彭亮 刘旻 李桢 邹姒妮 张勇
幽门螺杆菌(Helicobacter pylori,H.pylori)为一种革兰阴性菌,常见于上消化道,具有传染性及致病性,是多种慢性消化道疾病,如慢性胃炎、消化性溃疡、MALT淋巴瘤、胃癌等疾病的主要致病因素[1]。全球约有50%的人存在H.pylori感染,我国H.pylori感染率也高达56.2%[2-3]。儿童期是H.pylori感染的关键时期,有研究表明,我国有消化道症状的儿童H.pylori感染率为29.2%~53.2%,呈逐年递增的趋势[4],12岁以上感染率显著上升[5]。因此,儿童幽门螺杆菌感染的治疗对降低H.pylori感染率具有重要意义。目前我国H.pylori感染治疗主要以至少两种抗生素组成的根除治疗方法,但随着根除治疗的广泛开展,幽门螺旋杆菌对抗生素耐药的问题也逐渐引起重视,如何合理应用抗生素、提高H.pylori感染的根治率已成为临床医生重点关注的问题。本研究旨在分析东莞地区H.pylori感染儿童克拉霉素、甲硝唑及阿莫西林的耐药基因突变情况,并比较不同性别儿童携带H.pylori抗生素耐药基因的差异,为东莞地区H.pylori感染的治疗提供依据。
1 资料与方法
1.1 一般资料
选取2019年12月-2021年1月本院收治的H.pylori感染患儿84例,年龄1~14岁,平均(6.69±2.83)岁。纳入标准:(1)13C呼气试验、胃快速尿素酶检查确诊为H.pylori感染阳性;(2)年龄≤14岁;(3)伴有明显的消化不良症状,包括恶心、呕吐、腹胀及反酸等;(4)检查前1个月内未用抗生素、质子泵抑制剂、H2受体拮抗剂、非甾体消炎药等药物。排除标准:(1)活动性出血;(2)对本研究所用药物有过敏史;(3)存在其他影响本研究结果的严重疾病,如肝、肾、肺及心等脏器损害等。本研究方案经伦理委员会批准,患儿家属对研究内容知情并签署知情同意书。
1.2 方法
1.2.1 粪便中H.pylori DNA的提取及质量控制 称取200 mg标本在冰水中解冻,悬浮于5 ml磷酸钠缓冲液中,并充分涡旋混匀,放在离心机离心后取上清液,然后用缓冲液洗涤,加入溶菌酶溶解细菌后再离心,取沉淀液,此时沉淀液应含有蛋白和核酸等细菌裂解物,马上加入苯酚、氯仿溶液,混匀,提取核酸等物质,离心后的沉淀物便是核酸提取物,用无水乙醇洗涤沉淀物,晾干后用无菌水溶解,对提取的DNA溶液取部分用紫外光光度计检测并用细菌通用序列16sDNA进行PCR扩增,电泳扩增物,检验提取的DNA质量。确认有DNA后将提取液样品置于-20 ℃下保存备用。
1.2.2 耐药基因的检测 克拉霉素耐药基因为23sRNA,甲硝唑耐药基因为rdxA,阿莫西林耐药基因为PBP1A,获得3个基因的引物序列,见表1,对以上提取的DNA溶液分为3份,分别进行巢式PCR扩增,扩增反应条件:94 ℃ 3 min,72 ℃、5 min。扩增目标基因的序列后,行琼脂糖凝胶电泳提纯,与标准菌株扩增的电泳条带对比,切割出目标基因条带,此条带就是目标基因序列的PCR产物,对此产物回收及进行Sanger法测序,并与正常基因序列作Clustal W2对比,了解有无基因序列的变异。

表1 引物设计表
1.3 统计学处理
2 结果
2.1 不同性别患儿感染情况
84例确诊为幽门螺旋杆菌感染患儿入组,其中8例患儿粪便标本不合格,故不将其纳入本研究内。因此,最终入组76例H.pylori感染患儿,平均年龄(6.84±2.81)岁,男37例,占48.7%;女39例,占51.3%。
2.2 不同抗菌药物的耐药情况
本次研究中,抗菌药物耐药基因发生突变者共46例,基因突变率为60.5%,克拉霉素耐药基因突变者有29例,基因突变率为38.2%;甲硝唑基因突变者有6例,基因突变率为7.9%;阿莫西林基因突变者有7例,基因突变率为9.2%,发生两种以上抗生素基因突变者4例,基因突变率为5.3%,见表2。经Pearsonχ2检验,克拉霉素的耐药基因突变率高于甲硝唑、阿莫西林耐药基因突变率及多重耐药基因突变率,差异有统计学意义(χ2=42.316,P<0.05)。甲硝唑耐药基因突变率与阿莫西林耐药基因突变率相近,差异无统计学意义(χ2=0.084,P>0.05)。

表2 76例不同抗菌药物的耐药情况 例(%)
2.3 抗菌药物耐药的性别差异
男、女患儿的克拉霉素、甲硝唑、阿莫西林的耐药基因突变率比较,差异无统计学意义(P>0.05),见表3。
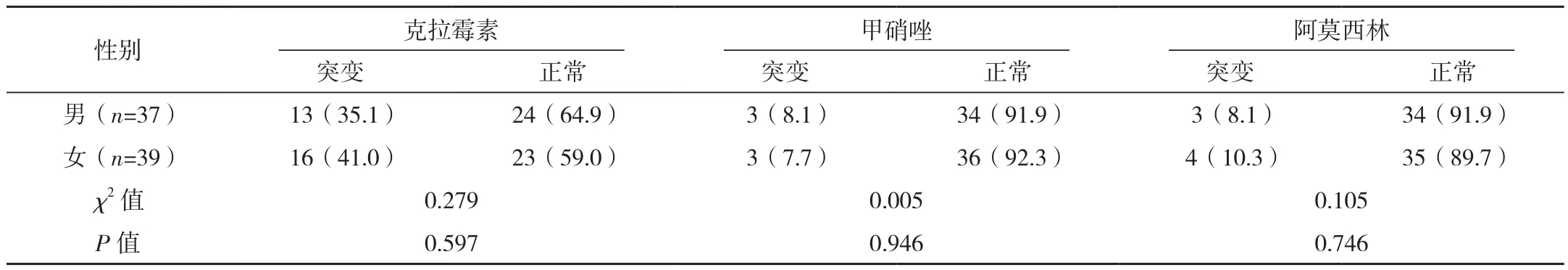
表3 抗菌药物耐药的性别差异 例(%)
3 讨论
H.pylori感染在我国具有较高的感染率,并与多种消化系统疾病具有密切联系[1],因其具有传染性,过高的H.pylori感染率引起了社会的广泛关注,降低H.pylori感染率已成为亟须解决的公共健康问题。国内外多项研究表明,儿童期是H.pylori感染最重要的年龄阶段,有2/3的H.pylori感染发生于10岁以前,因此,根除儿童H.pylori感染可减少消化道相关疾病的发生及发展[7]。目前,国内外H.pylori根除方案中常用的抗生素主要包括甲硝唑、克拉霉素、阿莫西林、四环素、左氧氟沙星等,儿童可选择抗生素的种类有限,同时随着抗生素在H.pylori感染根除治疗中的广泛应用,导致耐药菌的产生,近年来H.pylori抗生素耐药问题日趋严重,H.pylori感染的根治率也不断下降。因此,如何在治疗过程中提高Hp根除率,避免耐药菌的产生,成为一项重要的研究议题。
成人H.pylori感染研究资料显示,克拉霉素及甲硝唑的耐药率在全国范围均比较高,不同国家不同地区对抗生素的耐药性均存在不同程度的差异[8]。H.pylori对克拉霉素耐药主要由23SrRNA基因Ⅴ功能域的点突变引起,导致克拉霉素与核糖体亚基的结合力下降,不能阻断肽链的延伸,从而无法达到杀菌目的[9],常见的点突变位点为A2143G、A2142G及A2142C[10]。H.pylori对甲硝唑的耐药机制主要为rdxA基因突变,其突变导致NADPH还原酶活性降低,从而产生耐药[9]。PBP1突变是阿莫西林耐药基因突变的常见形式,通过转移青霉素结合基序影响H.pylori对阿莫西林的耐药性[11]。但阿莫西林作为临床常用药物,H.pylori对其耐药性却显示出与其既往用药史无明显相关性,提示H.pylori对阿莫西林继发性耐药发生率较低[9]。本研究中发现H.pylori感染患儿对克拉霉素、甲硝唑及阿莫西林均有不同程度的耐药基因突变情况出现,其中克拉霉素耐药基因突变率为38.2%;甲硝唑耐药基因突变率为7.9%;阿莫西林耐药基因突变率为9.2%,多重耐药基因突变率为5.3%,以克拉霉素耐药基因突变率高于其余抗生素耐药基因突变率,且差异有统计学意义(P<0.05),提示东莞地区可能属于克拉霉素高耐药地区。其原因可能在于克拉霉素突变位点较多,容易发生突变,导致较高的耐药基因突变率。由于甲硝唑剂型及患儿依从性的问题,临床上较少选择甲硝唑对儿童进行相关疾病的治疗,以致于该地区儿童对甲硝唑的耐药性普遍较低,这可能是本次研究中甲硝唑耐药基因突变率较低的原因;此外,也有研究表明,除了rdxA基因突变以外,frxA基因突变也与甲硝唑耐药形成相关[12],还需进一步分析甲硝唑的耐药机制。本次研究中也得出阿莫西林耐药基因突变率较低的结论,与任小舟等[9]研究结果相符合。同时,本次研究也出现克拉霉素和甲硝唑耐药基因同时存在情况,提示在H.pylori感染的治疗中,需充分考虑多重耐药的因素。
本研究通过分析不同抗菌药物耐药性的性别差异发现,克拉霉素、甲硝唑及阿莫西林的耐药性与H.pylori感染患儿的性别无关,原因可能在于本研究仅纳入儿童H.pylori感染患儿,年龄段比较局限,该结论与前期文献[13]研究一致,未来将进一步分析抗生素耐药基因突变与H.pylori感染根除治疗的关系。同时,本研究仍存在一些不足,如样本量较少,需进一步扩大样本量探讨该地区的儿童H.pylori感染现状及携带耐药基因状况。
综上所述,东莞地区H.pylori感染患儿抗生素耐药基因突变主要以克拉霉素耐药基因为主,其可能影响H.pylori感染的治疗,且在后续治疗中应充分考虑双重耐药的因素。

