松材线虫侵染对马尾松苗不同部位内生细菌菌群结构的影响
尹诗恒,张绍勇,刘骕骦,吴酬飞2,,王俊伟,李 阳2,,张立钦2,
(1. 浙江农林大学 林业与生物技术学院,浙江 杭州 311300;2. 湖州师范学院 浙江省媒介生物学与病原控制重点实验室,浙江 湖州 313000;3. 湖州师范学院 生命科学学院,浙江 湖州 313000;4. 烟台市昆嵛山林场,山东 烟台 264100)
马尾松Pinus massoniana为松科Pinaceae松属Pinus的常绿大乔木,最高达45 m,树皮呈红褐色,多见于中国南方[1−2]。马尾松是中国松属中占比最大的一类树种,因其速生和耐贫瘠的特点成为经济效益较大的用材树种之一[3]。松材线虫Bursaphelenchus xylophilus病又称松树萎蔫病,其扩散途径主要为人类行为传播和松墨天牛Monochamus alternatus携带传播2种[4],且扩散速度快,危害程度极高,对林业经济和森林资源造成了极大损失[5]。因马尾松侵染初期并不表现任何特征,一旦发病则植物开始枯萎且无法救治,最终死亡,所以松材线虫病也被称为“森林癌症”[6]。松材线虫病的早期研究主要集中于致病机制[7];后随科技和经济发展,化学和物理防治研究逐步取得进展[8];近年来,由于环境问题日益突出,生防研究逐渐受到重视,尤其对植物体内生防细菌的研究与应用。谈家金等[9]通过水培离体松枝得到1株坚强芽孢杆菌Bacillus firmus GD2,可影响松材线虫病的侵染,首次证明茎部内生细菌与松材线虫病之间有密切联系。袁文婷[10]从马尾松与黑松Pinus thunbergii茎部分离到9株内生细菌,其中3株对部分病原菌有一定拮抗作用。CARRELL等[11]、IZUMI等[12]在柔松Pinus flexilis、欧洲赤松Pinus densiflora的根部与根际发现了大量不同种类的内生细菌。胡振亮等[13]从健康油松Pinus tabuliformis根部、木质部、韧皮部及松针等7个部位分离到40株内生细菌,其中1株枯草芽孢杆菌Bacillus subtilis可对松树枯梢病Sphaeropsis sapinea起到抑制作用。李阳[14]对健康马尾松接种清水处理与空白对照,证实了接种产生的机械损伤与野外条件变化对菌群结构并无影响。综上可知,自2000年以来,对松科植物内生细菌相关的研究已取得一定进展,但对马尾松不同部位内生细菌的研究并不多,尤其缺乏高通量测序技术对松材线虫病侵染后马尾松内生细菌菌群的研究。基于此,本研究利用变性梯度凝胶电泳(DGGE)技术与高通量测序技术,探究野外接种松材线虫后马尾松不同部位内生细菌菌群的结构变化,为松材线虫病的早期诊断和后期生防菌株的挖掘提供理论参考。
1 材料与方法
1.1 材料
从杭州四季春马尾松苗圃(30°21′42″N,119°34′51″E)采集30株3年生健康马尾松幼苗种植于湖州师范学院试验田中,缓苗15 d后采用套管接虫法接种24株马尾松苗,每株接种松材线虫1万条。接种当天取其中6株未接种苗作为空白对照,之后每隔15 d取6株接种苗作为试验样本,共取样5次,时间为60 d,其间取侵染15 d的松干样本进行镜检,确定松材线虫已接种成功。其中3株马尾松幼苗的松干、松针和根系样本分开装入自封袋,按顺序编号并保存至−20 ℃冰箱,用于DGGE分析;另外3株试验样本分装后按相同顺序编号保存至−80 ℃冰箱中用于高通量测序。
1.2 方法
1.2.1 松材线虫的培养与接种 松材线虫与灰葡萄孢Botrytis cinerea均取自浙江农林大学生物农药高效制备技术国家地方联合工程实验室,将松材线虫接种于布满灰葡萄孢的PDA培养基上,于25 ℃恒温培养箱培养4~6 d,挑选其中密封完好且取食干净的培养基,采用贝尔曼漏斗法分离松材线虫[15]。将分离得到的松材线虫液以3 500 r·min−1转速下离心3 min,离心后松材线虫沉积于离心管底部,弃上部液体并将剩余液体混匀,最后加入无菌水与松材线虫,按比例配制成10 000条·mL−1的线虫悬液,用于试验田马尾松苗接种。
1.2.2 DGGE技术 聚合酶链式反应(PCR)扩增:采用磁珠法细菌基因组DNA抽提试剂盒分别提取松干、松针与根系总细菌的DNA后,选用BIO-RAD的T100TM Thermal Cycler PCR仪对细菌DNA的16S V3区序列进行扩增,扩增选择带有 GC 夹的细菌特异性引物 GC-341(cgc ccg ccg cgc gcg gcg ggc ggg gcg ggg gcg cgg ggg gcc tac ggg agg cag cag)与 518R(att acc gcg gct gg)进行,其产物经体积分数为 2% 的琼脂糖凝胶电泳检测后存至−20 ℃冰箱备用。
DGGE凝胶电泳:首先,分别吸取9.6 mL体积分数100%与6.4 mL体积分数0的变性胶、6.4 mL体积分数100%与9.6 mL体积分数0的变性胶于2个锥形瓶中,再次吸取80 μL的过硫酸铵(AP)与16 μL的四甲基乙二胺(Temed)均加至上述2个锥形瓶中,配制成体积分数为60%与40%的梯度胶,分别倒入梯度胶电动生成器进行灌胶,梯度胶凝固后吸取10 μL PCR扩增产物与5 μL loading buffer混合后进行点样。其次,将点样完成的凝胶放入已预热至60 ℃的电泳仪中,80 V电泳13 h。最后待电泳完毕向凝胶倒入0.5 μL染色剂避光染色,用BIO-RAD凝胶橙色系统获取DGGE电泳条带图。将DGGE电泳条带图导入Quantity One软件中进行DGGE图谱分析,并利用PAST生物统计软件与WPS软件处理数据图表,分析不同部位受松材线虫侵染后内生细菌菌群结构的差异。
1.2.3 高通量测序技术 委托诺禾致源生物科技有限公司对样本细菌的DNA进行测序,测序平台为Illumina NovaSeq。首先,采用CTAB法对样本的细菌DNA进行提取,选择带有Barcode的特异引物515F与806R对样本16S V4区进行扩增,使用体积分数为2%的琼脂糖凝胶进行电泳检测后对目的条带进行回收。其次,使用 TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,经Qubit和Q-PCR定量后使用NovaSeq6000进行上机测序得到数据。最后,使用FLASH对下机数据进行拼接得到原始Tags数据,在去除低质量碱基及接头污染序列后,在97%的相似性水平上,使用Uparse软件进行操作分类单元(OTU)聚类,通过Qiime软件和R软件对样本进行群落多样性分析,同时对比DGGE数据,定性定量对内生细菌菌群结构的差异变化进行分析。
2 结果与分析
2.1 马尾松不同部位内生细菌菌群的DGGE分析
2.1.1 不同部位内生细菌菌群的DGGE电泳条带分析 如图1所示:松针部位空白对照组(即侵染0 d)和侵染15 d的样品条带数量和亮度基本不变,侵染30 d后条带数量增多且亮度加深,侵染45 d后条带的亮度和数量进一步增加,但侵染60 d后,条带的数量减少且亮度减弱。松干部位不同侵染期样品的条带数量和亮度差异最大,侵染15 d后样品条带即开始变化,侵染30 d后其数量与亮度明显增加且到达高峰;至侵染后期,条带整体变化不明显,但条带数量有一定的减少,且部分条带明显增亮或减弱。相比松干与松针,根系的变化非常小,不同侵染期条带的数目与亮度均无明显变化,整体相对稳定。

图1 不同时期马尾松内生细菌菌群变化的DGGE分析图Figure 1 DGGE analysis chart of changes in the endophytic bacterial flora of P. massoniana in different periods
2.1.2 不同部位内生细菌菌群的差异显著性分析 如图2所示:松干部位侵染0与60 d样本数据的离散程度最小,中位数约20;侵染30 d数据最大值可达80,数据离散程度极大,中位数约60;侵染15与45 d的样本数据离散程度中等,中位数约30,其中P=0.000 8,小于0.05。松针部位各组数据的离散程度相近,除侵染0与45 d样本的中位数接近70,剩余3组数据中位数约20,其P=0.089 8,大于0.05。根系部位数据的离散程度最小,除空白对照外,不同侵染期样本中位数均接近60,且P=0.714 4,大于0.05。

图2 不同时期马尾松内生细菌菌群的差异箱式图Figure 2 Box diagram of differences in endophytic bacterial flora of P. massoniana in different infection stages
综上可知:根系部位物种多样性整体离散程度最小,差异不显著(P>0.05);松干部位整体离散程度最大,且各组数据间的离散程度差异也较大,差异显著(P<0.05);松针部位整体离散度介于松干与根系之间,但各组数据间的离散程度基本一致,差异显著(P<0.05)。
2.1.3 不同部位内生细菌菌群的多样性指数分析 利用PAST软件对条带数据进行统计分析,得到不同侵染时期马尾松内生细菌菌群的多样性指数,即香农威纳指数(Shannon-Wiener)、均匀度指数(Pielou)以及丰富度指数(Margalef)。如表1所示:随侵染时间延长,松干的Shannon-Wiener指数由1.93上升到3.12,Margalef指数由1.01到3.27;松针的Shannon-Wiener指数从2.06到2.73,Margalef指数由1.02到1.85,与松干部位变化趋势一致;根系部位的多样性数值远大于松针与松干部位,但数值间的差值极小。由此可知,随侵染时间延长,松干和松针部位内生细菌菌群的多样性都呈先增加后减少的变化趋势;根系部位的菌群结构多样性变化极小,但多样性最丰富。
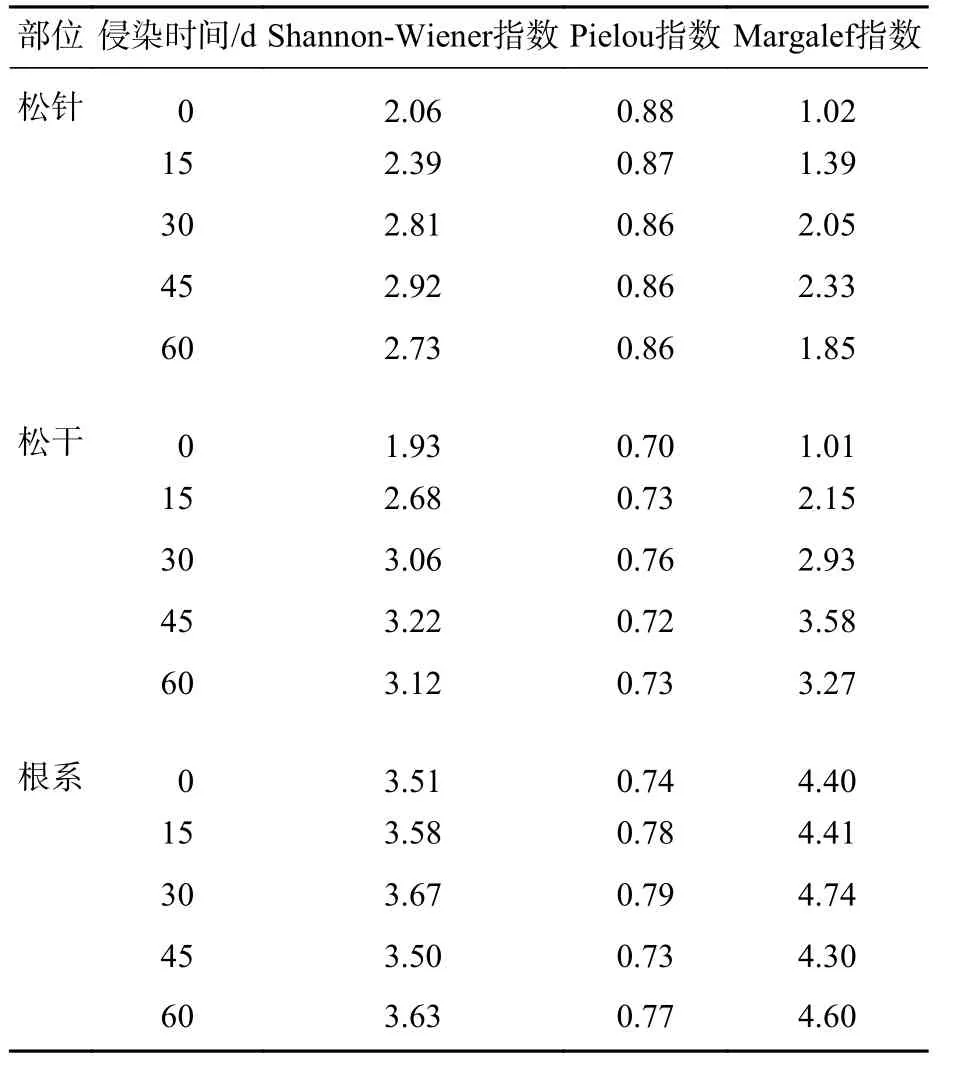
表1 不同时期马尾松内生细菌菌群结构的多样性指数分析Table 1 Analysis of diversity index of the endophytic bacterial community structure of P. massoniana in different periods
2.2 马尾松不同部位内生细菌菌群结构的高通量测序分析
2.2.1 不同部位内生细菌菌群的 OUTs聚类分析
由OTUs维恩图(图3)可知:根系部位菌群的OTU数最多,为4 523,且随侵染时间延长,OTU数无明显变化趋势;松针与松干菌群的OTU总数分别为3 833和3 823,且随侵染时间延长表现为持续增长的变化趋势,其中侵染15 d的松干部位特有OTU数由48突增至154,变化最大。这与DGGE图谱分析结果相同,即松干与松针条带数目在空白对照组极少,且随侵染时间延长逐渐增多;菌群多样性变化与条带数目相同,即松干被侵染15 d菌群结构多样性明显增多,而松针部位菌群则随侵染时间变化逐渐增多。可见,在长期侵染过程中,松材线虫的侵染确实对不同部位细菌菌群结构的变化有较大影响,其中松干部位对松材线虫病的侵染敏感性最强,响应速度最快;松针次之,根系则基本不受侵染影响。

图3 不同部位内生细菌的 OTUs维恩图Figure 3 Venn diagram of OUTs of endophytic bacteria in different parts
2.2.2 不同部位内生细菌菌群的物种组成分析 综上可知,DGGE与高通量测序结果一致,DGGE分析能够直观地比较和分析马尾松不同部位细菌群的结构差异,可对菌群进行定性分析,但无法直接检测到菌群的种类,仍需配合其他实验方法如T克隆。高通量测序技术则凭借其大量、速度、准确的特点可直接检测到较全面的马尾松菌群信息。本研究检测到马尾松体内细菌共442属,隶属于35门49纲110目210科。
由图4可知:在门水平上,相对丰度排名前10的细菌分别为蓝藻细菌门Cyanobacteria、变形菌门Proteobacteria、放线菌门Actinobacteria、酸杆菌门Acidobacteria、拟杆菌门Bacteroidetes、浮霉菌门Planctomycetes、绿弯菌门Chloroflexi、芽单胞菌门Gemmatimonadetes、疣微菌门Verrucomicrobia及装甲菌门Armatimonadetes,其中分布最广、种类最多的是放线菌门与变形菌门。
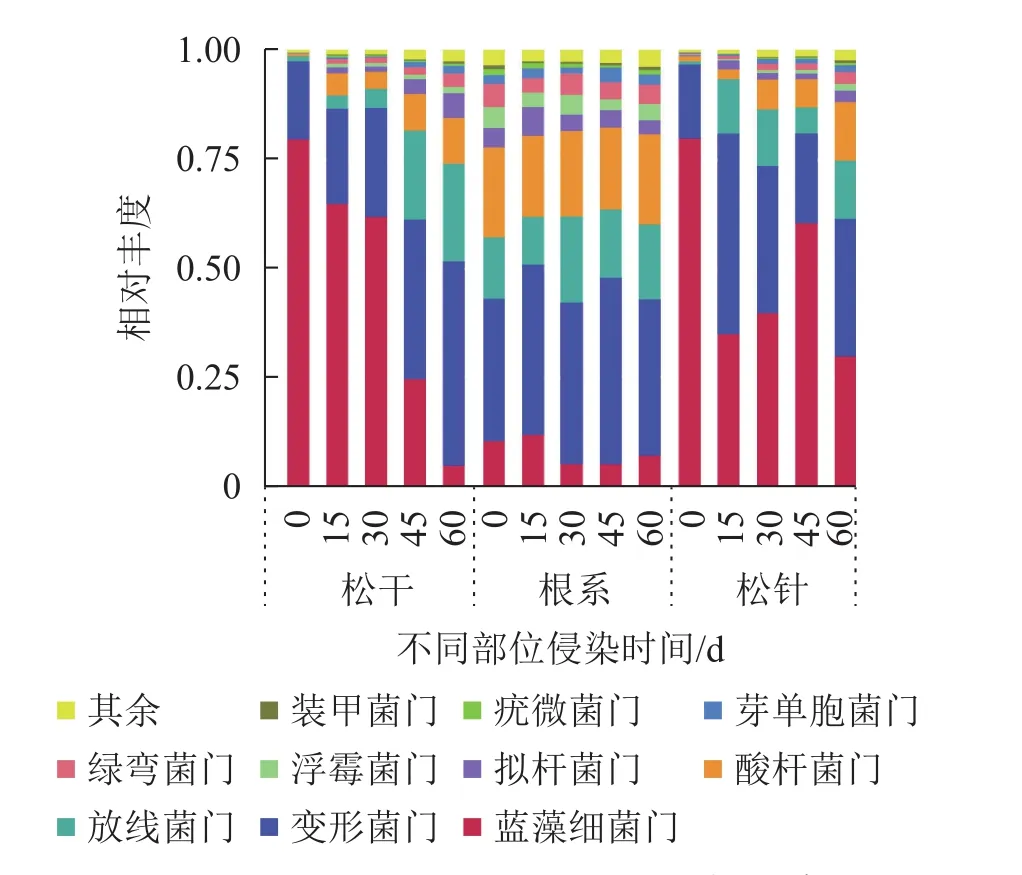
图4 门水平上排名前 10的物种相对丰度Figure 4 Relative abundance of the top 10 species at the phylum level
由图5可知:在属水平上,松干部位侵染0与15 d菌群的种类相差非常大,如Bryobacter属、Pseudolabrys属、类诺卡氏属Nocardioides、分枝杆菌属Mycobacterium与弗莱德门菌属Friedmanniella,在侵染0 d时,上述菌群几乎没有,侵染15 d后才出现;侵染15~60 d相对丰度整体变化减弱,但部分菌种如甲基杆菌属Methylobacterium、假平胞菌属Sphingomonas与薄层菌属Hymenobacter在侵染后期相对丰度有所增加。与松干相比,松针部位内生细菌菌群种类变化并不明显,但菌群丰度变化较明显,如泛菌属Pantoea与假平胞菌属随侵染时间延长其相对丰度整体呈先增加后减少的趋势,甲基杆菌属、假单胞菌属Pseudomonas、短小杆菌属Curtobacterium则表现为持续减少的趋势。其余菌属如蓝藻菌属Cyanobacteria、伯克氏菌属Burkholderia、放线菌属Amnibacterium、变形杆菌属Gammaproteobacteria、罗思河小杆菌属Rhodanobacter、拜叶林克氏菌属Beijerinckiaceae、酸杆菌属Acidobacteria、嗜麦芽窄食单胞菌属Stenotrophomonas、溶杆菌属Lysobacter、慢生根瘤菌属Bradyrhizobium和节杆菌属Arthrobacter则并无明显丰度变化。根部内生细菌菌群的种类与相对丰度则始终维持在一定水平。

图5 属水平上排名前 30的物种相对丰度Figure 5 Relative abundance of the top 30 species at the genus level
3 结论与讨论
微生物的复杂培养条件使大部分微生物包括植物内生细菌较难使用传统分离培养法进行研究[16]。虽然松材线虫病的生防研究已取得一定进展,如芽孢杆菌属Bacillus、短小杆菌属与区文氏菌属Erwinia的生防菌株对松材线虫病的侵染可起到一定作用,尤其是芽孢杆菌属,但其野外生防效果普遍弱于室内实验效果[17−18]。本研究通过DGGE技术对不同部位的内生细菌分析发现:松材线虫的侵入明显改变了马尾松内生细菌结构,随侵染时间推移菌群多样性整体表现为先增加后稳定的变化趋势,但不同部位内生细菌群的变化规律并不一致。松干部位内生细菌群在侵染15 d时产生较大变化,至45 d时菌群差异达到显著,到侵染60 d时菌群结构与侵染45 d基本一致;而松针部位在侵染30 d才开始表现明显的菌群变化,且多样性指数增长趋势较平缓;根系部位内生细菌菌群结构在侵染全过程未表现出明显的动态变化,但内生细菌的数量远大于干部与针部。由此可知,内生细菌菌群的物种数量与丰度从大到小依次为根系、松干、松针;内生细菌菌群结构差异从大到小依次为松干、松针、根系。说明受侵染后松干部位对松材线虫病的侵染敏感性最强,其次是松针,根系则基本不受松材线虫病侵染的影响。
通过高通量测序技术对马尾松不同部位内生细菌定量分析发现:共检测到细菌442属,分布于35门49纲110目210科。由OTUs维恩图分析可知:不同部位内生细菌菌群结构的变化趋势与上述结果一致,即松干部位内生细菌对松材线虫病的侵染响应最迅速,部分内生细菌的结构在侵染15 d时已发生显著变化。因此,在松材线虫传播的高峰期实时监测马尾松的菌群变化对松材线虫病的早期检测有一定的帮助。此外,松干与松针部位的部分内生细菌相对丰度也产生了显著变化,松干部甲基杆菌属、假平胞菌属与薄层菌属随侵染时间的增加其相对丰度显著增多;而松针部的甲基杆菌属、假单胞菌属与短小杆菌属相对丰度随侵染时间的延长逐渐减少,泛菌属与假平胞菌属则随侵染时间延长其相对丰度呈先增加后减少的变化趋势;根部内生细菌菌群的种类与相对丰度则整体保持稳定。
接种植物内生菌可刺激植物产生抗性酶,并促进植物体内抗氧化活性物质的表达,诱导植物产生系统防御反应[19]。目前,甲基杆菌属、假平胞菌属、薄层菌属、泛菌属、假单胞菌属和短小杆菌属的部分菌株已从广泛的生境中分离得到,且已被发现对植物具有一定的促生或生防作用。KHAN等[20]研究发现:假平胞菌属中的LK11菌株可通过产生吲哚乙酸(IAA)促进植物产生诱导系统抗性(ISR),刺激植物对环境胁迫与病原体产生反应,使植物启动防御机制,提高植物抗性;甲基杆菌属、泛菌属也可促进植物分泌细胞分裂素(CK)、吲哚乙酸等植物激素以促进植物生长发育,并帮助植物抵挡生物和非生物因素的侵害[21−22];薄层菌属与假单胞菌属也具有解磷酸钙、产铁载体等的生物特性,铁作为植物存活和繁殖的必需微量营养素,当达到一定含量即可促进植物生长,从而提高植物的抗性[22−24]。虽然上述细菌属在马尾松病害防治研究中报道较少,但已证实对其他植物的生长发育有一定的促进或阻碍作用,尤其是假单胞菌属与泛菌属的部分菌株对松材线虫病具有生防效果[25]。综上,推测上述细菌属中的部分菌株可对松材线虫病产生生防作用,为后期发掘新型生防菌株提供研究方向。

