高效液相色谱法测定食品中姜黄素类化合物检测方法的建立
孔凡华 李菁菁 韦艳琳 马文丽 白沙沙 徐佳佳 崔亚娟

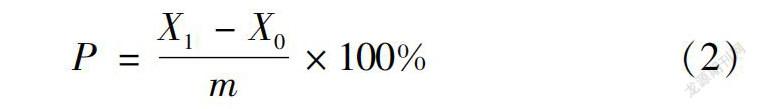
摘 要:建立高效液相色谱法测定食品中姜黄素类化合物含量的分析方法。利用单因素试验,对食品中姜黄素类化合物的提取试剂、提取方式、提取时间进行选择,确定最佳提取条件为甲醇振荡提取5 min。色谱条件:YMCTMC30色谱柱(150 mm×4.6 mm,5 μm),流动相为乙腈-水(80∶20,v/v),用磷酸调节pH 到3.0,流速1 mL/min,检测波长420 nm,柱温30 ℃。结果表明:3种姜黄素类化合物在0.10~10.00 μg/mL内与峰面积有良好线性关系,生姜和咖喱中3种姜黄素类化合物的平均回收率分别为87.86%~107.35%和87.08%~107.47%,RSD均小于5%,3种姜黄素类化合物含量的相对标准偏差(RSD)均小于5%。该方法简单可行、重复性好、准确度高,可广泛用于食品中姜黄素类化合物含量测定。
关键词:高效液相色谱法;姜黄素类化合物;脱甲氧基姜黄素;双脱甲氧基姜黄素
姜黄素是我国食品添加剂使用卫生标准GB 2760[1]允许使用的着色剂,可以在糕点、饮料、糖果、冷冻饮品等14种食品中使用。姜黄素类化合物具有抗炎抗氧化和抗菌活性[2-4]、抗肿瘤抗癌抗病毒活性[5-7]、抗动脉粥样硬化[8]、保肝护肝[9]等多种药理功效,广泛应用于医药、食品着色剂以及化妆品上并逐渐被应用到保健食品和饮料上[10]。目前文献报道的姜黄素类化合物检测方法主要有高效液相色谱法[11-13]、分光光度法[14]、薄层色谱法[16]、毛细管电泳法[17-18]和液相色谱-质谱法[19-20]等。分光光度计法测定的是总姜黄素类化合物的含量,不适合姜黄素各单体化合物的测定;薄层色谱法通常用来做半定量或限定试验,但由于姜黄素类化合物不稳定,在薄层上分离时容易受光及其他因素影响,导致结果重现性差、准确性低;毛细管电泳法具有快速、微量的优点,但方法的重现性较差;液相色谱-质谱法具有灵敏度高的特点,但是设备昂贵,方法普及性差;HPLC法因其分离效果好、灵敏度高、選择性好成为目前测定姜黄素类化合物的常用方法。本研究参照姜黄素类化合物检测的标准方法和文献方法,设计单因素试验,对食品中姜黄素类化合物的提取试剂、提取方式、提取时间等前处理条件进行优化,以3种姜黄素类化合物提取效率的高低作为评价指标,筛选最佳提取条件;通过比较检测波长、色谱柱、流动相、流速和柱温等高效液相色谱条件,以3种姜黄素类化合物的分离度和峰形对称性作为评价指标,筛选最佳色谱条件,实现食品中3种姜黄素类化合物的有效提取和高效分离。生姜和咖喱是最常见、最易得的富含姜黄素的样品,因此该试验选取这两种物质为研究对象,进行方法学验证,考察方法的科学性、准确性和适用性,以期建立食品中姜黄素类化合物的精准分析检测技术。
1 材料与方法
1.1 材料与试剂
生姜、咖喱等样品,市购;姜黄素、脱甲氧基姜黄素、双脱甲氧基姜黄素标准品(纯度≥98.0%),都埃法生物科技有限公司。甲醇、乙腈(均为色谱纯),美国Fisher公司;无水乙醇,优级纯,北京化工厂。
1.2 仪器与设备
BS224S分析天平,德国赛多利斯科学仪器(北京)有限公司;QL-901斡旋振荡器,海门市其林贝尔仪器制造有限公司;EYELA MMV-1000W振荡器,东京理化株式会社;KQ-500DE型数控超声波清洗器,昆山市超市仪器有限公司;HITACHI CF16RXII 高速冷冻离心机,日本日立科技有限公司;METTLER TOLEDO pH计,梅特勒-托利多国际贸易(上海)有限公司;EYELA N-1100旋转蒸发仪,东京理化株式会社;安捷伦1260高效液相色谱仪,配二极管阵列检测器和ChemStation for LC systems(版本序列号:Rev.B.04.03-SP2[105])色谱工作站,美国Agilent公司;YMCTMC30色谱柱,5 μm,250 mm×4.6 mm(内径)。
1.3 方法
1.3.1 标准溶液的配制 准确称取姜黄素、脱甲氧基姜黄素和双脱甲氧基姜黄素标准品5 mg,置于10 mL棕色容量瓶中,加甲醇溶解并稀释至刻度,摇匀,得到浓度为500 μg/mL 标准储备液,置于4 ℃冰箱中保存,使用前用甲醇稀释成相应的质量浓度,现用现配。
1.3.2 提取溶剂的选择 称取0.100 0 g咖喱样品和10.000 0 g(精确至 0.000 1 g)生姜样品,置于 50 mL 棕色容量瓶中,根据姜黄素类化合物的理化特性,分别加入 30 mL甲醇、无水乙醇、甲醇∶水=1∶1(V/V)、甲醇∶水=7∶3(V/V)、无水乙醇∶水=8∶2(V/V)、乙腈超声提取(功率为100 W,25 ℃)10 min,分别加提取溶剂定容至刻度,摇匀后转移至离心管中,置于离心机4 ℃、5 000 r/min 离心 5 min,取上清液过0.45 μm滤膜后供液相色谱测定。
1.3.3 提取方式的选择 称取0.100 0 g咖喱样品(精确至 0.000 1 g)置于 50 mL 棕色容量瓶中,分别加入 30 mL甲醇,常温超声提取、振荡提取(280 r/min)、涡旋提取10 min,加甲醇至刻度,摇匀后转移至离心管中,置于离心机4 ℃、5 000 r/min离心5 min,取上清液过 0.45 μm滤膜过滤后供液相色谱测定。
1.3.4 提取时间的选择 称取 0.100 0 g咖喱样品(精确至 0.000 1 g)置于 50 mL 棕色容量瓶中,分别加入 30 mL甲醇,振荡提取(280 r/min)1、5、10、15、20、30 min,加甲醇至刻度,摇匀后转移至离心管中,置于离心机4 ℃、5 000 r/min 离心 5 min,取上清液过 0.45 μm滤膜后供液相色谱测定。
1.3.5 色谱参考条件 色谱柱:YMCTMC30色谱柱,5 μm,250 mm×4.6 mm(内径);柱温30 ℃;流动相∶乙腈-水(80∶20,v/v),用磷酸调节pH 为3.0;流速1 mL/min;检测波长420 nm;进样量10 μL。
1.3.6 方法验证 按照《GB/T 27404—2008试验室质量控制规范 食品理化检测》[21]方法学要求,建立校准曲线及校准曲线的工作范围;逐步稀释样品上机测定,R(S/N)=3时的测定浓度作为检出限,R(S/N)=10时的测定浓度作为定量限;分别称取生姜和咖喱样品,按照试验优化的方法,平行测定6次,计算姜黄素、脱甲氧基姜黄素和双脱甲氧基姜黄素的含量,并计算相对标准偏差,考察方法的重现性;向样品本底添加低、中、高三个浓度水平的标准溶液,进行三水平六平行加标回收试验,以回收率的高低评价方法的准确度。
1.4 姜黄素类化合物含量的计算
1.4.1 标准曲线的制作 本法采用外标标准曲线法进行定量。将姜黄素、脱甲氧基姜黄素和双脱甲氧基姜黄素系列混合标准工作液进样分析,以峰面积为纵坐标、以标准溶液浓度为横坐标绘制标准曲线,计算直线回归方程和相关系数。
1.4.2 结果计算 试样中姜黄素、脱甲氧基姜黄素和双脱甲氧基姜黄素含量按式(1)计算:
X=C×Vm×f………………(1)
式(1)中,X-试样中姜黄素、脱甲氧基姜黄素和双脱甲氧基姜黄素的含量(μg/g);C-标准工作液中姜黄素、脱甲氧基姜黄素和双脱甲氧基姜黄素的含量(μg/mL);V-试样溶液体积(mL);m-试样质量(g);f-试样浓缩倍数。总姜黄素含量是3种姜黄素类化合物单体含量的和。
1.5 数据处理
通过与仪器配套的 ChemStation for LC systems(版本序列号:Rev.B.04.03-SP2[105])工作站软件完成數据的采集与处理。
2 结果与分析
2.1 提取溶剂的选择
姜黄素极性较小,不溶于水和乙醚,易溶于甲醇、乙醇、丙二醇等试剂中。本研究根据前人研究成果[22-26]选取6种不同提取溶剂,比较不同提取溶剂对生姜和咖喱中姜黄素类化合物的提取效果。由表1、表2可知,甲醇对生姜和咖喱中姜黄素类化合物的提取效果最佳,显著高于其他提取溶剂(P<0.05),本研究结果与李卓等[27]研究结果吻合。
2.2 提取方法的选择
提取方法是指提取、制备目标化合物的方法。选择提取方法时,既要保证高提取效率,又要保证有效成分在提取过程中不被破坏,振荡提取、超声提取和涡旋提取是常用的提取方法。由表3可知,振荡提取、超声提取和涡旋提取对咖喱中3种姜黄素类化合物提取效率没有显著性差异(P>0.05),本研究选择振荡提取方法。
2.3 提取时间的选择
由表4可知,振荡提取不同时间对咖喱中3种姜黄素类化合物提取效率没有显著性影响(P>0.05),考虑到食品基质的复杂性,个别样品提取时间太短可能会导致提取不完全,所以本研究选择振荡提取5 min。
2.4 姜黄素类化合物方法学验证
2.4.1 线性关系、检出限及定量限 按照1.3.5色谱
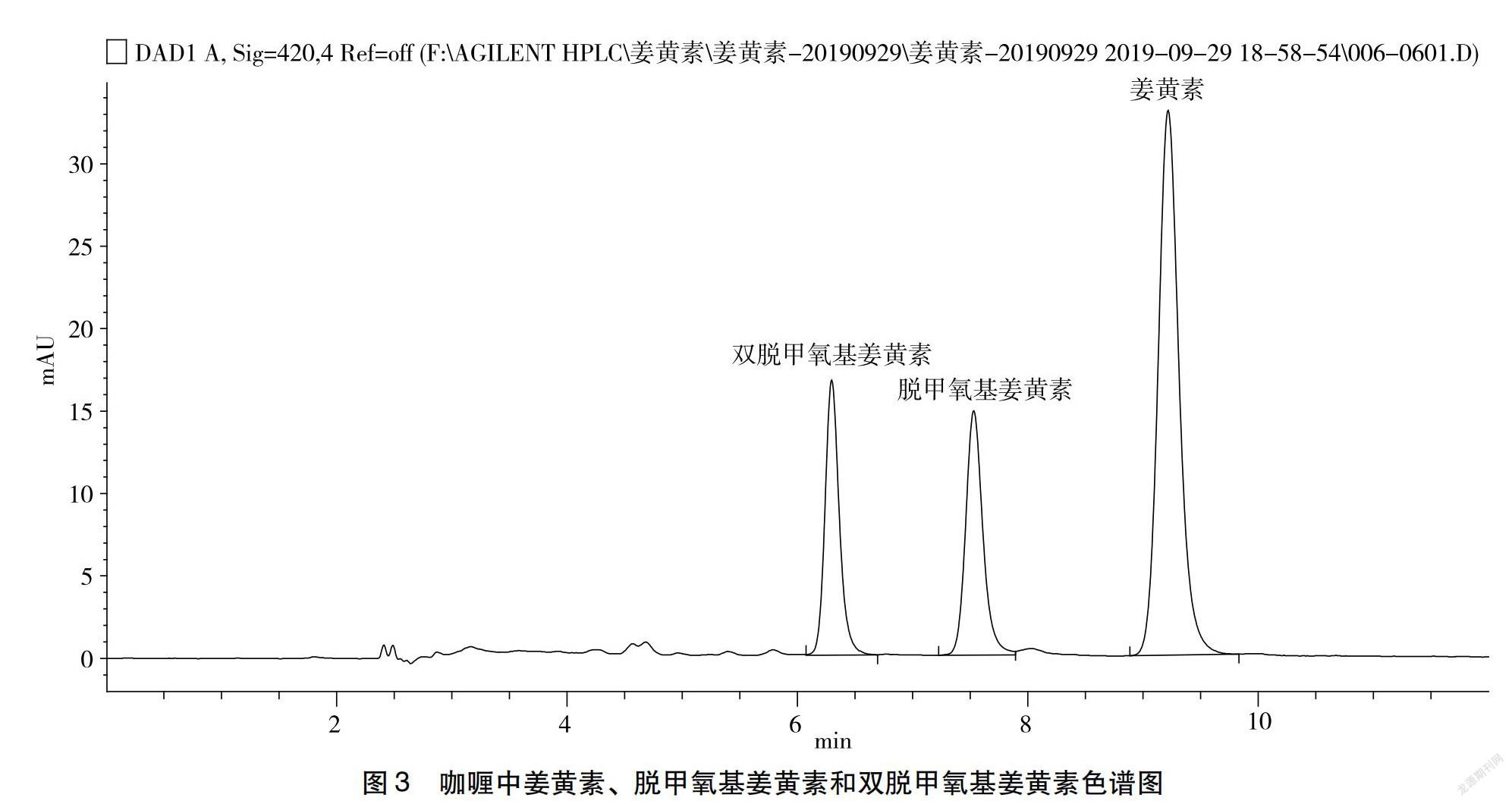
条件进行HPLC分析,得出姜黄素类化合物的线性回归方程、线性范围、相关系数、检出限和定量限。表5结果表明,在0.1~10.0 μg/mL内,3种姜黄素类化合物的浓度与峰面积有良好的线性关系。双脱甲氧基姜黄素和脱甲氧基姜黄素分离度为4.96、脱甲氧基姜黄素和姜黄素分离度为5.59、双脱甲氧基姜黄素出峰时间为6.012 min、脱甲氧基姜黄素出峰时间为7.155 min、姜黄素出峰时间为8.719 min(图1)。
2.4.2 方法精密度试验 按试验优化的最佳提取方式和色谱条件,平行测定6次,生姜和咖喱中姜黄素、脱甲氧基姜黄素和双脱甲氧基姜黄素HPLC色谱图见图2和图3。由表6可知,生姜和咖喱中姜黄素、脱甲氧基姜黄素和双脱甲氧基姜黄素测定结果的RSD均小于5%,满足《GB/T 27404—2008 试验室质量控制规范 食品理化检测》[21]要求,表明方法精密度良好。
2.4.3 方法准确度试验 准确度为分析方法测定的平均值与真值相符的程度。稳定样品中加入不同水平已知量的标准物质(将标准物质的量作为真值)称加标样品;同时测定样品和加标样品;加标样品扣除样品值后与标准物质的误差即为该方法的准确度:
P=X1-X0m×100%(2)
式(2)中,P-加入的标准物质的回收率;m-加入的标准物质的量;X1-加标试样的测定值;X0-未加标试样的测定值。
为测定本方法的准确度,采用样品加标试验进行验证。由表7、表8可知,生姜和咖喱中3种姜黄素类化合物的平均回收率均分别为87.86%~107.35%和87.08%~107.47%,RSD均小于5%,表明方法准确度良好。
3 结论
在前人研究的基础上,本试验设计单因素试验,对食品中姜黄素类化合物的提取试剂、提取方式、提取时间等前处理条件进行优化,以3种姜黄素类化合物提取效率的高低作为评价指标,得到食品中姜黄素类化合物的最佳提取方式为甲醇振荡提取5 min。选择生姜和咖喱样品进行方法学验证,结果表明,3种姜黄素类化合物在0.1~10.0 μg/mL(决定系数r>0.999)的浓度范围内与峰面积有良好的线性关系;姜黄素、脱甲氧基姜黄素和双脱甲氧基姜黄素的检出限分別为0.1、0.2、0.3 μg/g,定量限分别为0.3、0.6、0.9 μg/g;按试验确定的最佳前处理条件和色谱条件平行测定6次,得到生姜和咖喱中3种姜黄素类化合物含量的相对标准偏差(RSD)均小于5%;向样品本底添加低、中、高三个浓度水平的标准溶液,进行三水平六平行加标回收试验,得到生姜和咖喱中3种姜黄素类化合物的平均回收率为87.86%~107.35%和87.08%~107.47%,RSD均小于5%,表明方法准确度良好。本研究建立的方法,操作简单,仪器成本低,精密度好,准确度高,可以同时测定食品中3种姜黄素类化合物的含量,是分析食品中姜黄素类化合物成分的理想方法,可以为食品中姜黄素类化合物的测定提供方法基础。◇
参考文献
[1]国家卫生和计划生育委员会.食品安全国家标准 食品添加剂使用标准:GB 2760-2014[S].北京:中国标准出版社,2014.
[2]Hou Y,Wang H,Zhang F,et al.Novel self-nanomicellizing solid dispersion based on rebaudioside a:a potential nanoplatform for oral delivery of curcumin[J].International Journal of Nanomedicine,2019(14):557-571.
[3]Ahangari Najmeh,et al.Curcumin in tissue engineering:a traditional remedy for modern medicine[J].BioFactors(Oxford,England),2019,45(2):135-151.
[4]Jiang Yan,et al.Anti-inflammatory effect of a curcumin-aspirin derivative on Ureaplasma-induced cytokine expressions in neonatal monocytes[J].Cellular and Molecular Biology(Noisy-le-Grand,France),2018,64(14):61-65.
[5]Mukherjee Sumit,et al. TriCurin,a synergistic formulation of curcumin,resveratrol,and epicatechin gallate,repolarizes tumor-associated macrophages and triggers an immune response to cause suppression of HPV+ tumors.[J].Cancer Immunology,Immunotherapy:CII,2018,67(5):761-774.
[6]Klinger Neil V,Mittal Sandeep.Therapeutic potential of curcumin for the treatment of brain tumors.[J].Oxidative Medicine and Cellular Longevity,2016,2016(5):1-14..
[7]Loutfy S,Eldin H A,Elberry M H,et al.THU-155-Polymeric,metallic nanoparticles,and curcumin as inhibitors of hepatitis C virus genotype 4a replication in vitro[J].Journal of Hepatology,2019,70(1):e230.
[8]Shin S K,Ha T Y,McGregor R A,et al.Long-term curcumin administration protects against atherosclerosis via hepatic regulation of lipoprotein cholesterol metabolism[J].Molecular Nutrition & Food Research,2011,55(12):1829-1840.
[9]Rivera-Espinoza Y,Muriel P.Pharmacological actions of curcumin in liver diseases or damage[J].Liver International,2009,29(10):1457-1466.
[10]周阿容,等.姜黄素的功能特性及其毒理学研究进展[J].食品研究与开发,2019,40(16):219-224.
[11]王善钰.用高效液相色谱法测定食品中姜黄素[J].食品安全导刊,2019(15):166.
[12]干婧,刘枫,吕世均,等.高效液相色谱法测定干生姜中姜黄素的含量[J].食品工业,2019,40(4):305-308.
[13]Jagdish Mahale,et al.An HPLC-UV method for the simultaneous quantification of curcumin and its metabolites in plasma and lung tissue:Potential for preclinical applications[J].Biomedical Chromatography,2018,32(9):e4280.
[14]史明彪,张文,刘河,等.紫外-可见分光光度法定量测定姜黄素及其载体药物方法的优化[J].国际药学研究杂志,2017,44(4):366-368.
[15]段雪芹.姜黄属药用植物姜黄素的提取、含量测定及抗氧化活性研究[D].四川雅安:四川农业大学,2013.
[16]徐仲溪,王坤波.姜黃素的高效薄层色谱分析[J].食品科学,2004,25(6):156-159.
[17]刘保启,胡孝忠,王玉春,等.高效毛细管电泳法测定姜黄中姜黄素类化合物[J].分析测试学报,2004,23(1):109-111.
[18]Yuan K,Weng Q,Zhang H,et al.Application of capillary zone electrophoresis in the separation and determination of the curcuminoids in urine[J].Journal of Pharmaceutical and Biomedical Analysis,2005,38(1):133-138.
[19]Saradhi U V R V,et al.A liquid chromatography-tandem mass spectrometric method for quantification of curcuminoids in cell medium and mouse plasma[J].Journal of Chromatography B,2010,878(30):3045-3051.
[20]蒋建兰,靳晓丽,乔斌,等.HPLC-ESI-MS/MS分析姜黄中姜黄素类化合物[J].天然产物研究与开发,2012,24(11):1582-1588.
[21]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.食品安全国家标准 试验室质量控制规范 食品理化检测:GB/T 27404—2008[S].北京:中国标准出版社,2008.
[22]国家质量监督检验检疫总局,出口食品中姜黄素的测定 高效液相色谱法和液相色谱-质谱/质谱法:SN/T 4890-2017[S].北京:中国标准出版社,2017.
[23]李文兵,卢君蓉,胡麟,等.一测多评法测定姜黄中姜黄素、去甲氧基姜黄素和双去甲氧基姜黄素[J].中草药,2017,48(3):573-577.
[24]国家卫生和计划生育委员会,食品安全国家标准 食品添加剂 姜黄素:GB 1886.76—2015[S].北京:中国标准出版社,2005.
[25]刘永涛,李乐,王赛赛,等.鱼组织中双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素含量的超高效液相色谱法测定[J].分析测试学报,2017,36(2):276-279.
[26]孙鹏尧,李丹丹,牟德华.HPLC法测定姜黄根茎及姜黄素饮料中姜黄素类化合物的含量[J].食品工业科技,2016,37(21):313-317.
[27]李卓,等.HPLC测定小米中非法添加姜黄素及不确定度分析[J].食品研究与开发,2017,38(24):169-173.
Determination on Curcuminoids in Food by High Performance Liquid Chromatography
KONG Fan-hua1,LI Jing-jing1,WEI Yan-lin,MA Wen-li2,BAI Sha-sha1,XU Jia-jia1,CUI Ya-juan1
(1Beijing Institute of Nutrition Resources,Beijing 100069,China;2Inner Mongolia Mengniu Dairy Industrial Co.Ltd.,Hohhot 011500,China)
Abstract:An analytical method was developed for determining total content of curcuminoids in food by high performance liquid chromatography.The extraction reagent,extraction method and extraction time of curcuminoids in food were selected by single factor experiment.Methanol extraction by shaking for 5 min was selected.The separation of curcuminoids were achieved on YMCTMC30 column(150 mm×4.6 mm,5 μm)using acetonitrile-water(80∶20,v/v)as the mobile phase at a flow rate of 1.0 mL/min.The DAD detection wavelength and column temperature were set at 420 nm and 30 ℃,respectively.The results showed that the linear range of three curcuminoids were 0.10~10.00 μg/mL.The average recovery rate of ginger and curry was 87.86%~107.35% and 87.08%~107.47% and RSD was less than 5%.The relative standard deviation(RSD)was no more than 5%.Therefore,this developed method is characteristics of simple operation,and high reproducibility and accuracy.It can be widely applied to determine total content of curcuminoids in food.
Keywords:HPLC;curcuminoids;demethoxycurcumin;bisdemethoxycurcumin

