阴沟肠杆菌对碳青霉烯类药物的耐药机制
刘丽娟,王 学,姜梅杰,赵书平,任玉国
(1. 济南市人民医院检验科,山东 济南 271100; 2. 青岛市黄岛区西海岸新区人民医院检验科,山东 青岛 266500; 3. 泰安市中心医院检验科,山东 泰安 271000)
阴沟肠杆菌是医院内感染重要的病原菌,可引起呼吸道、伤口、泌尿系统感染和脑膜炎等病症[1-2]。碳青霉烯类抗生素是治疗此类菌株感染的最佳药物。但随着碳青霉烯类抗生素应用的增加,近年来临床上耐碳青霉烯类阴沟肠杆菌的检出数也逐年增加,给临床抗感染治疗带来困难[3-5]。对我院2019年4—9月检出的耐碳青霉烯类阴沟肠杆菌分布、耐药性及耐药机制进行分析,为抗感染治疗及医院感染预防控制提供依据。
1 资料与方法
1.1 菌株来源 收集本院2019年4—9月住院患者临床分离到的非重复耐碳青霉烯类阴沟肠杆菌(亚胺培南或美罗培南MIC≥2 mg/L),所有菌株进行药敏试验。
1.2 细菌鉴定及药敏试验 采用WalkAway 96 PLUS NUC61复合板进行菌种鉴定及药物敏感性检测,用K-B纸片扩散法补充检测头孢哌酮/舒巴坦、头孢吡肟、头孢噻肟、厄他培南、环丙沙星和左氧氟沙星的敏感性,药敏试验执行2018年美国临床实验室标准化协会(CLSI)标准。其中替加环素敏感性试验执行美国食品药品监督管理局(FDA)的标准,头孢哌酮/舒巴坦敏感性试验执行CLSI中头孢哌酮的标准。M-H琼脂和药敏纸片均为英国Oxoid产品。铜绿假单胞菌ATCC 27853、大肠埃希菌ATCC 25922作为质控菌株。
1.3 临床资料收集 采用回顾性分析方法,收集耐药菌感染患者的临床资料,包括标本来源、科室分布、基础疾病、抗菌药物应用、是否有创伤性操作、呼吸机的应用情况等。
1.4 碳青霉烯酶检测-改良碳青霉烯酶灭活试验 依据CLSI M100S-28th文件的改良碳青霉烯灭活试验mCIM联合eCIM试验筛选碳青霉烯酶产酶菌株。
1.5 碳青霉烯耐药基因检测及测序 煮沸法提取细菌DNA模板,采用多聚酶链反应(PCR)方法对碳青霉烯酶类相关耐药基因KPC、IMP、VIM、NDM、SME、IMI、NMC及OXA-23、OXA-24、OXA-48、OXA-51、OXA-58基因进行扩增测序,所用引物参考文献[6-10]报道。PCR反应体系为25 μL,含Taq酶(5 U/μL)0.5 μL,10×PCR buffer 2.5 μL,MgCl2(25 mmol/L)1 μL,dNTP mixture(5 mmol/L) 0.5 μL,待检菌DNA模板2 μL,引物F、R(10 μmol/L)各1 μL,ddH2O补足至25 μL。退火温度参照文献[6-10]。PCR扩增产物送上海桑尼生物科技有限公司测序,测序结果在GenBank中的BLAST(http://blast.ncbi.nlm.nih.gov/blast.cgi)进行对比,确定基因型。
1.6 多位点序列分型(MLST) 对阴沟肠杆菌7个管家基因片段dnaA-fusA-gyrB-leuS-pyrG-rplB-rpoB通过PCR扩增后直接测序,测序结果在pubMLST数据库中已有管家基因谱进行比对,确定序列类型(ST)。MLST分析所用引物见表1。

表1 MLST引物序列
1.7 脉冲场凝胶电泳(PFGE) 使用限制性内切酶XbaI对染色体DNA进行消化,试验参数为:14℃,电压6 V/cm,相对分子质量50~400 kb,电场夹角120℃,脉冲4~40 s,电泳时间20 h。溴化乙锭(EB)染色30 min后在紫外灯下观察结果,Bio-Rad凝胶成像系统成像,Bionumeric软件分析,作出进化树分析菌株亲缘性,各菌株间相似性>85%判断为同一克隆株。
1.8 统计分析 应用WHONET 5.6软件进行耐药性分析。
2 结果
2.1 临床资料 2019年4—9月共检出8株非重复耐碳青霉烯阴沟肠杆菌,5株来自于重症监护病房(ICU);4株来源于痰,2株来源于穿刺液,1株来源于血标本,1株来源于尿标本。见表2。
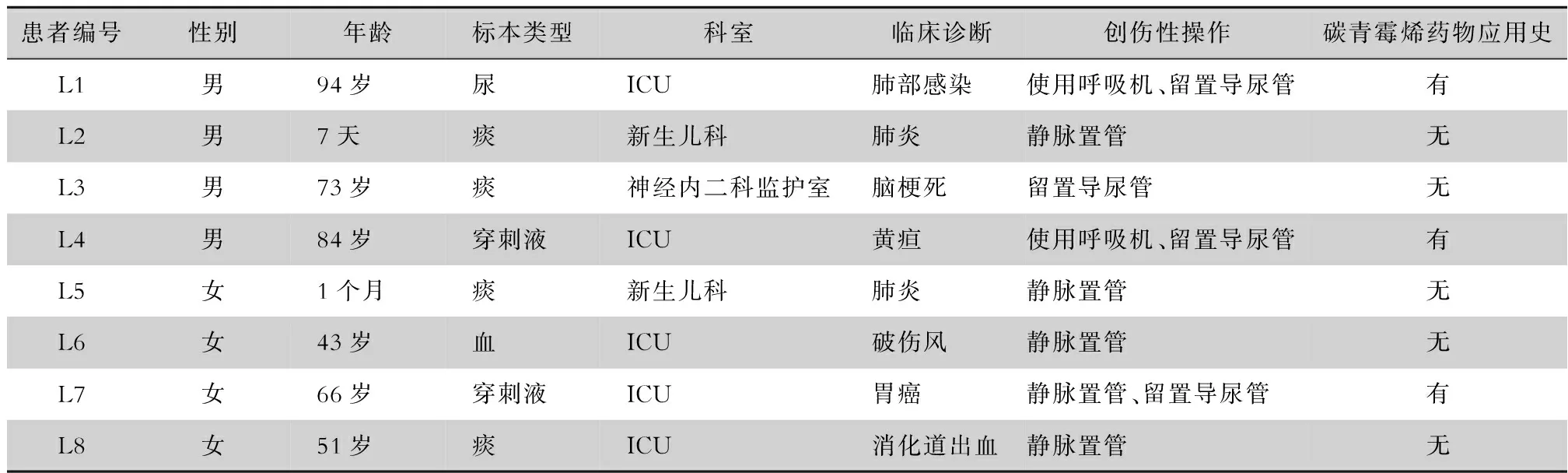
表2 8例耐碳青霉烯类阴沟肠杆菌感染患者临床资料

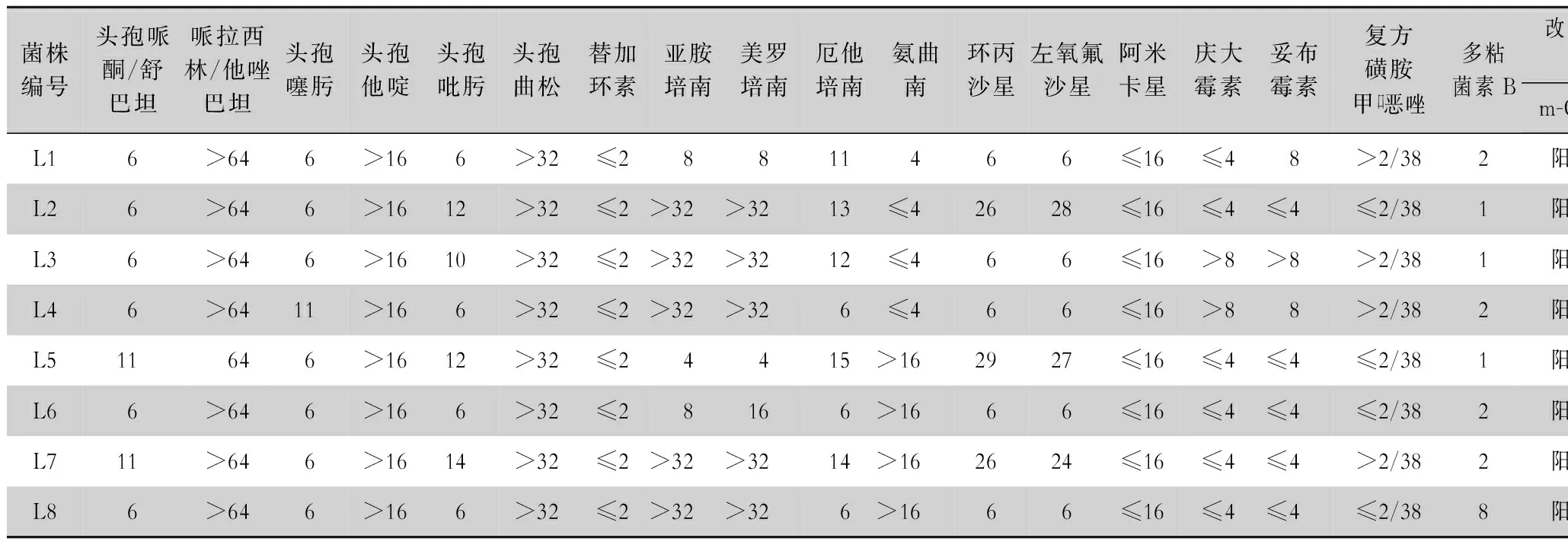
表3 抗菌药物对阴沟肠杆菌的MIC值及改良碳青霉烯酶灭活试验结果

A:0.5麦氏单位大肠埃希菌(ATCC 5922)标准菌液; B: MEM(10 μg)药敏质控片; C: mCIM阳性结果; D: eCIM阳性结果。
2.3 碳青霉烯类耐药基因检测及测序结果 8株耐碳青霉烯类阴沟肠杆菌均携带B类碳青霉烯酶,表型筛选和基因检测的符合率为100%。其中7株PCR扩增出NDM基因目标片段(见图2),经测序分析比对均为NDM-1金属酶基因(见图3);1株PCR扩增出IPM基因片段(见图4),经测序分析为IPM-4金属酶基因(见图5)。
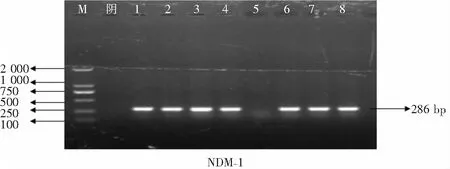
M:为DNA Marker;阴:为阴性对照;泳道1—4、6—8为临床blaNDM-1基因阳性菌株;泳道5为临床blaNDM-1基因阴性菌株。
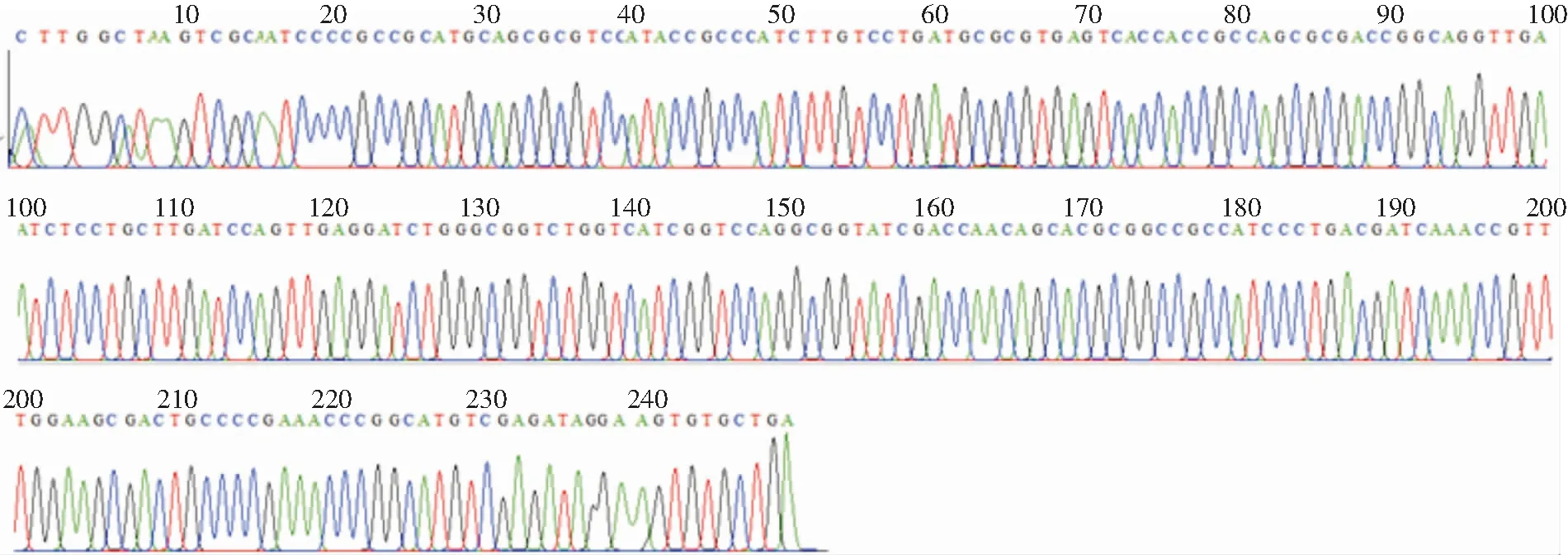
图3 耐碳青霉烯类阴沟肠杆菌PCR产物NDM-1金属酶基因测序图

M:为DNA Marker;阴:为阴性对照;泳道5为临床IPM-1基因阳性菌株;泳道1—4、6—8为临床IPM-1基因阴性菌株。
2.4 MLST分子分型及PFGE同源性分析结果 8株耐碳青霉烯类阴沟肠杆菌MLST分子分型结果显示,有6个序列类型,依次为ST596(3株)、ST121(1株)、ST993(1株)、ST91(1株)、ST794(1株)、ST88(1株),ST596是主要流行的序列类型,均来源于ICU。PFGE同源性分析共分为6个克隆群,分别为A群(菌株L1、L4、L8)、B群(菌株L6)、C群(菌株L2)、D群(菌株L7)、E群(菌株L5)、F群(菌株L3)。3株A群菌株均为ST596型,均来源于ICU。见图6。
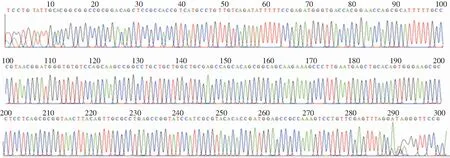
图5 耐碳青霉烯类阴沟肠杆菌PCR产物IPM-4金属酶基因测序图

图6 8株耐碳青霉烯类阴沟肠杆菌PFGE聚类分析
3 讨论
阴沟肠杆菌已成为医院感染的常见病原菌之一,其耐药机制十分复杂,可同时产Ampc酶、超广谱β-内酰胺酶(ESBLs)及碳青霉烯酶,从而导致多重耐药,引起难治性感染。早期研究表明,产头孢菌素酶并伴有膜蛋白的缺失[11]是阴沟肠杆菌对碳青霉烯类耐药主要原因。但是目前报道阴沟肠杆菌对碳青霉烯类耐药的主要机制是产A类、B类或D类碳青霉烯酶[12]。

所有菌株mCIM联合eCIM碳青霉烯酶筛选试验结果与PCR结果一致,均检出B类碳青霉烯酶,7株为NDM-1金属酶基因,1株为IPM-4金属酶基因,说明产B类碳青霉烯酶NDM-1是该段时间内阴沟肠杆菌对碳青霉烯类耐药的主要原因。 MLST分子分型及PFGE同源性分析有6个ST序列类型,6个克隆群:ST596(3株)均为A群,ST121(1株)为C群,ST993(1株)为F群,ST91(1株)为E群,ST794(1株)为B群,ST88(1株)为D群。其中3株ST596 A群阴沟肠杆菌均来源于ICU,说明5月初至8月底存在此型菌株的播散流行。警示本院感染监控部门应加强ICU多重耐药菌患者的管理,特别是要做好转入转出患者的监管,预防医院感染暴发。短时间内新生儿科出现2例多重耐药阴沟肠杆菌,虽然属于不同的克隆群,但也应分析原因,加强科室医院感染防控措施。
本研究显示,本院ICU存在ST596型A群耐碳青霉烯类阴沟肠杆菌的播散流行。主要的碳青霉烯类耐药机制是产B类金属酶,以NDM-1为主,呈现出多重耐药的趋势,且出现多粘菌素耐药菌株。由于研究标本时间跨度短,例数少,可能存在一定局限性,另本课题是回顾性研究,未对科室人员、医疗设备和周围环境等进行采样检测,未能查找到引起克隆聚集的感染源,需要进一步追踪研究。

