环境因子和免疫刺激对香港牡蛎免疫指标的影响
王佳雯,卢 洁,姚 托,叶灵通,王江勇
(1. 天津农学院水产学院,天津 300384; 2. 中国水产科学研究院南海水产研究所/农业农村部南海渔业资源开发利用重点实验室,广东 广州 510300; 3. 惠州学院,广东 惠州 516007)
环境胁迫会影响贝类代谢及能量收支平衡,使免疫相关酶活性下降,降低机体免疫防御能力,影响贝类的生长和存活[1-2]。氨氮是贝类蛋白质代谢的分解产物,当养殖水体中亚硝酸盐浓度过高时,容易对水生动物体内的酶起到催化作用。氨氮常以离子氨和非离子氨的形式存在于水体中,非离子氨具有脂溶性能够穿过细胞膜[3],因此还会影响细胞膜的稳定性,使贝类生长受到抑制[4]。盐度是影响水生动物生理代谢、分布等的重要环境因子之一[5]。贝类能适应一定的盐度范围,并根据盐度的高低来调节自身渗透压,从而保持正常的生长繁殖,若超出适应范围,则会影响其正常的生理代谢[6]。弧菌是普遍存在的海洋细菌[7],水产养殖中危害最大的细菌性疾病是由弧菌属细菌引起的[8],其胞外产物是主要的致病因子[9]。脂多糖 (LPS) 是革兰氏阴性细菌细胞壁的组成部分,具有免疫调节作用,是贝类非特异性免疫的重要激活剂[10],可激活巨噬细胞活性增强机体吞噬能力。干露会影响贝类生长代谢,离开水体后,贝类的呼吸功能受到抑制[11],长期暴露在空气中会导致贝类氧化应激[12],甚至死亡。与其他不利环境条件一样,干露可引起活性氧(Reactive oxygen species, ROS) 过量,造成脂质和蛋白质氧化,导致各种疾病的发生[13-14],还会影响细胞内免疫相关酶活性的变化。
中国是世界水产养殖第一大国,2019年贝类总产量约 1 439×104t,其中牡蛎产量居贝类总产量之首,约 522×104t[15]。香港牡蛎 (Crassostrea hongkongensis) 主要分布在长江以南[16],是我国南方海域重要的养殖品种,其含有丰富的蛋白质,肉味鲜美,具有较高的医药价值[17-18]。香港牡蛎在我国牡蛎养殖业中占有重要地位[16],是两广地区牡蛎养殖中最主要的种类。在养殖或运输过程中,降雨干旱导致的生理环境急剧变化,长时间的空气暴露和温度波动等均会使牡蛎受到多种环境压力。急性的物理应激会影响牡蛎的免疫功能,造成免疫酶活性降低,进而导致其成活率下降,这是牡蛎大规模死亡的原因之一[19-20]。
研究证实,盐度[21]、氨氮[22]的改变,干露状态[23]及弧菌感染[24]等应激刺激会引起贝类体内代谢发生重要变化,对其免疫指标产生显著影响。免疫相关酶活性是评估环境应激下贝类健康状态的重要指标[25],可反映贝类氧化应激水平的免疫反应,对于了解贝类的健康状况及其对外界环境的适应性具有重要意义。为探究环境因子胁迫对香港牡蛎免疫指标的影响,本研究采用氨氮、干露、盐度胁迫和弧菌感染香港牡蛎,测定了各种胁迫条件下香港牡蛎肝胰腺组织中超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT)、碱性磷酸酶 (AKP)、酸性磷酸酶(ACP)、总抗氧化能力 (T-AOC)、一氧化氮合酶(NOS)、过氧化物酶 (POD) 活性与丙二醛 (MDA)含量的变化,旨在找出香港牡蛎对环境因子变化敏感的1~2个免疫指标,揭示香港牡蛎在适应环境因子胁迫过程中免疫指标的变化规律,监测香港牡蛎的生态健康养殖,为其养殖推广提供参考依据。
1 材料与方法
1.1 实验材料
实验所用香港牡蛎购于广州市黄沙水产市场,实验个体为同一环境条件下养殖的牡蛎,体质量为(115.18±16.45) g。实验在中国水产科学研究院南海水产研究所进行。实验前牡蛎在水族缸暂养1周,暂养温度为 (25±1) ℃,盐度为20,氨氮质量浓度低于 0.05 mg∙L–1,pH 为 8.1±0.1,暂养期间连续充气,每天定时投饵、换水。
1.2 实验方法
1.2.1 氨氮胁迫实验设计 通过预实验,在确定香港牡蛎 96 h 氨氮胁迫半致死浓度为 60 mg∙L–1的基础上,设置 0 mg∙L–1(对照组)、6 mg∙L–1(低氨氮组) 和 60 mg∙L–1(高氨氮组) 3个浓度梯度。向各实验组添加氯化铵 (NH4Cl),使水体氨氮终浓度与实验设置浓度相同。每隔8 h使用E-1456水质分析仪 (德国 Dechem-Tech.GmbH 公司) 检测各水体的氨氮浓度,将其调整为实验设计的氨氮浓度。每个浓度设3个平行,每组15只香港牡蛎,进行24 h的胁迫实验。所有组的水温、盐度、充气量等养殖条件均与暂养期间相同。
1.2.2 盐度胁迫实验设计 实验设置 3个盐度梯度[26],其中盐度20为对照组,盐度30为高盐组,盐度3为低盐组,每个盐度均设3个平行,每个平行15只香港牡蛎。实验水体由自来水加海水晶混匀调制,实验前水体均充分曝气。牡蛎在盐度胁迫后的72 h随机取样。所有组的水温、pH、充气量等养殖条件均与暂养期间相同。
1.2.3 免疫感染实验设计 实验设置哈维弧菌(Vibrio harveyi) 组、LPS组、对照组,对照组注射无菌养殖海水50 μL,实验组分别注射50 μL哈维弧菌 (107CFU∙mL–1) 菌液和 LPS (0.5 mg∙L–1) 溶液,进行24 h感染实验。每组均设3个平行,每个平行15只香港牡蛎。所有组的水温、pH、充气量等养殖条件均与暂养期间相同。
1.2.4 干露胁迫实验设计 将香港牡蛎分别置于25和4 ℃下干露处理7 d,并在第0、第1、第3、第5和第7天取样。2个温度均设3个平行,每个平行50只香港牡蛎。温度25和4 ℃分别由培养箱和冰箱控制。
1.3 样品采集与保存
4个胁迫实验均采用同一方法取样,即从每个平行中随机取出3只香港牡蛎,每组共9只,分离出肝胰腺,液氮速冻后于−80 ℃冰箱内保存待用。
1.4 指标测定
1.4.1 样品处理 将所取样品与匀浆介质(0.86% 的生理盐水) 以质量∶体积=1∶9 (g·mL–1)比例在冰水浴条件下机械匀浆,制备成10%的组织匀浆。之后 2 500 r·min–1离心 10 min,取上清液进行相关免疫指标测定。免疫酶活的测定均采用南京建成科技有限公司生产的试剂盒,实验操作均按照试剂盒说明书进行。
1.4.2 ACP和 AKP活性测定 以微量酶标法测定 ACP (货号 A060-2) 和 AKP (A059-2) 活性,ACP和AKP分解磷酸苯二钠,产生游离酚和磷酸,酚在碱性溶液中与4-氨基安替吡啉作用经铁氰化钾氧化生成红色醌衍生物,根据红色深浅可以测定酶活性的高低。
1.4.3 MDA 含量测定 用硫代巴比妥酸法(TBA法) 测定MDA含量 (A003-1),过氧化脂质降解产物中的MDA可与TBA缩合,形成红色产物,在532 nm处有最大吸收峰,可计算出MDA含量。
1.4.4 SOD 活性测定 以羟胺法测定 SOD 活性(A001-3),通过黄嘌呤及黄嘌呤氧化酶反应系统产生∙O2−,∙O2−与羟胺反应产物经显色剂作用呈紫红色,而SOD对∙O2−专一性抑制,利用实验组与对照组的吸光值差异,即可计算出样品的SOD活性。
1.4.5 T-AOC 活性测定 以微板法 (ABTS法) 测定 T-AOC (A015-1-1),2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸 (ABTS) 在适当的氧化剂作用下氧化成绿色的 ABTS·+,在抗氧化物存在时,ABTS·+的产生会被抑制,在405或734 nm处测定ABTS·+的吸光度即可测定比计算出样品T-AOC。
1.4.6 CAT 活性测定 以可见光法测定 CAT 活性(A007-1-1),CAT 分解过氧化氢 (H2O2) 的反应可通过加入钼酸铵而迅速中止,剩余的H2O2与钼酸铵作用产生一种淡黄色的络合物,通过A-5082 TACAN 酶标仪 (奥地利 Tecan 有限公司) 在 405 nm处测定其生成量,可计算出CAT的活性。
1.4.7 NOS活性测定 以比色法测定 NOS活性(A014-2),NOS催化L-Arg和分子氧反应生成一氧化氮(NO),NO与亲核性物质生成有色化合物,在530 nm波长下测定吸光度,根据吸光度的大小可计算出NOS活性。
1.4.8 POD 活性测定 以比色法测定 POD 活性(A084-1-1),利用POD催化H2O2反应的原理,通过测定420 nm处吸光度单独变化得出其酶活性。
1.5 数据分析
采用SPSS 20.0软件对免疫指标进行单因素方差分析 (One-way ANOVA)。组间差异采用 Duncan's多重比较分析,P<0.05表示差异显著。
2 结果
2.1 氨氮胁迫下香港牡蛎肝胰腺中免疫酶活性的变化
方差分析表明氨氮胁迫对香港牡蛎ACP活性具有显著影响 (图1-a),高浓度组和低浓度组中香港牡蛎ACP活性均显著高于对照组 (P<0.05),SOD活性与ACP活性变化一致 (图1-d)。对照组MDA显著高于低氨氮组 (P<0.05,图1-c)。POD活性随氨氮浓度升高而降低 (图1-h),T-AOC也有相似的变化趋势 (图1-e),但均无显著差异 (P>0.05)。此外,CAT活性随氨氮浓度的增加而下降,高浓度氨氮组CAT活性显著低于对照组 (P<0.05,图 1-f)。
2.2 盐度胁迫下香港牡蛎肝胰腺中免疫酶活性的变化
在不同盐度的环境中,香港牡蛎肝胰腺中ACP、AKP、T-AOC和POD活性及MDA含量均无显著变化 (P>0.05,图2)。在高盐度胁迫下,SOD活性显著高于对照组 (P<0.05,图2-d),高盐度也显著诱导NOS活性上升 (P<0.05,图2-g)。与其他酶活相比,无论是在低盐度还是高盐度中,实验组CAT活性均显著高于对照组 (P<0.05,图2-f)。
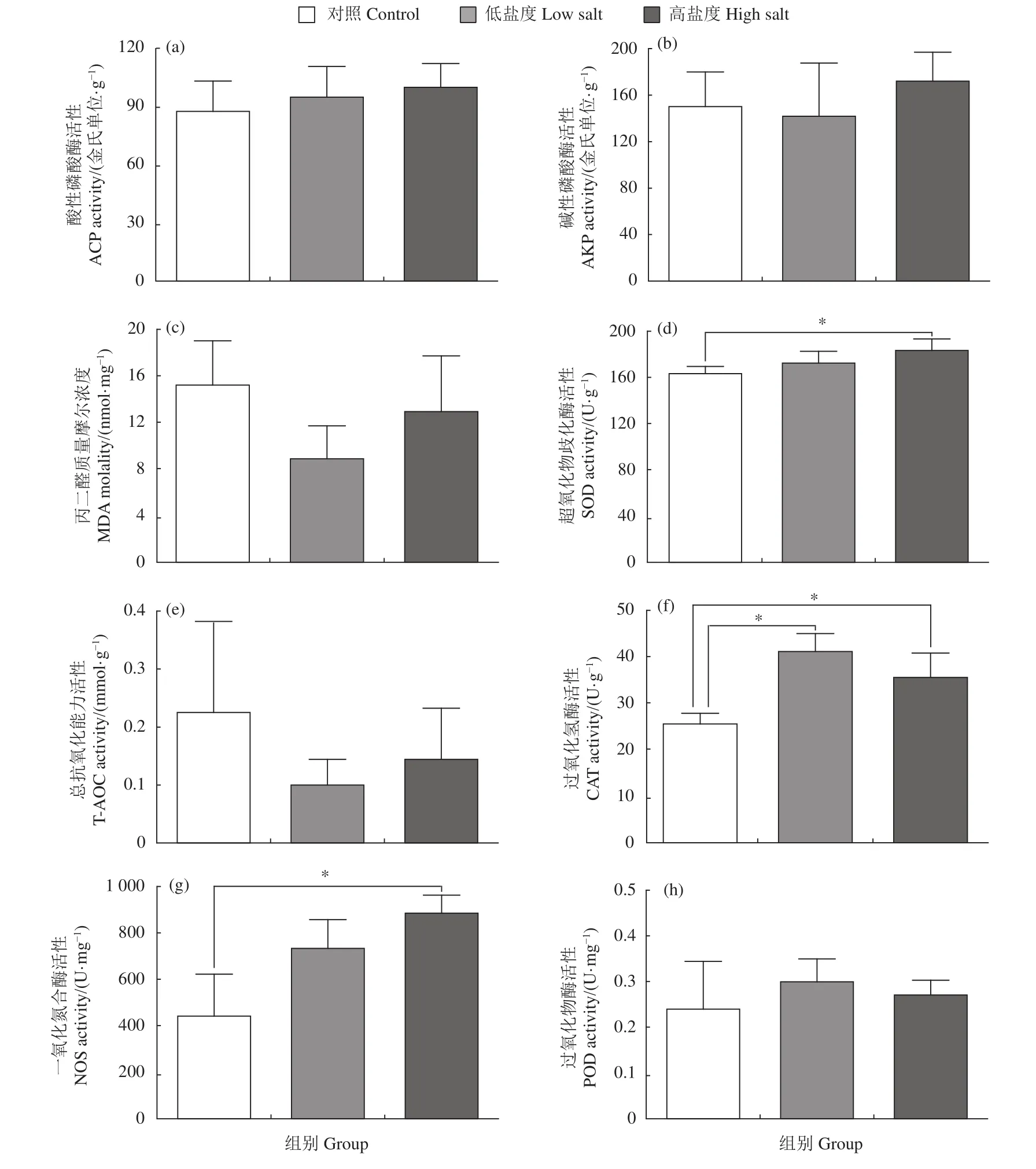
图2 盐度胁迫对香港牡蛎肝胰腺中免疫酶活性的影响Figure 2 Effects of salinity stress on immune enzyme activity in hepatopancreas of C. hongkongensis
2.3 免疫感染后香港牡蛎肝胰腺免疫酶活性的变化
ACP、SOD活性及MDA含量在2种免疫刺激过程中均无显著变化 (图3)。LPS组的AKP活性显著高于哈维弧菌组 (P<0.05,图3-b)。哈维弧菌免疫感染组T-AOC活性显著低于对照组和LPS组(P<0.05,图3-e),LPS组NOS活性显著高于对照组和哈维弧菌组 (P<0.05,图3-g)。此外,2种免疫刺激均显著降低了香港牡蛎肝胰腺组织中CAT活性 (P<0.05,图3-f)。对照组POD活性均高于2个实验组,且显著高于LPS组 (P<0.05,图3-h)。
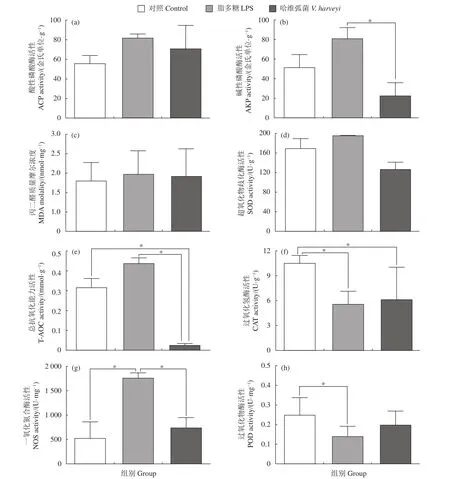
图3 免疫刺激对香港牡蛎肝胰腺中免疫酶活性的影响Figure 3 Effects of immune stimulation on immune enzyme activity in hepatopancreas of C. hongkongensis
2.4 干露条件下香港牡蛎肝胰腺中CAT活性的变化
干露实验前后,香港牡蛎肝胰腺中CAT活性有显著差异,即干露初期 (0 d) 与干露后期 (7 d) 相比显著下降 (P<0.05)。25 ℃干露第3天,CAT活性显著低于干露第0和第5天 (P<0.05,图4-a)。温度为4 ℃,随着干露时间持续,CAT活性有显著差异 (图4-b)。香港牡蛎肝胰腺中CAT活性在第1和第7天时显著低于干露初期 (P<0.05),在第3天,与干露第7天相比CAT活性又有显著上升(P<0.05)。
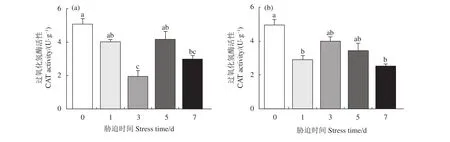
图4 25 ℃ (a) 和4 ℃ (b) 干露条件对香港牡蛎肝胰腺中免疫酶活性的影响不同小写字母代表各时间点实验组间存在显著差异 (P<0.05)Figure 4 Effects of air exposure conditions at 25 ℃ (a) and 4 ℃ (b) on immune enzyme activity in hepatopancreas of C. hongkongensisDifferent lowercase letters indicate significant difference between the experimental groups at different time (P<0.05).
3 讨论
代谢过程中,环境胁迫导致生物机体的生理环境发生变化,使其体内自由基数量增加。自由基可以通过各种还原反应保护有机体,但过量则造成机体损害,导致组织损伤[27]。抗氧化酶 (T-AOC、CAT、SOD) 参与机体对自由基的初级抗氧化保护,这些酶在免疫应答和代谢过程中产生,以防止脂肪酸氧化,减少ROS对机体的毒性作用,并保护生物体免受氧化损伤[28]。
贝类因缺乏获得性免疫系统,其防御机制主要依赖于先天免疫反应。ACP和AKP均为水生动物中重要的溶酶体酶,既可参与非特异性免疫作用[29],也可参与各种代谢过程,如解毒、代谢、大分子生物合成等。本研究中各种浓度氨氮均诱导了ACP活性显著升高 (P<0.05)。研究发现,短期内的氨氮胁迫会诱导中华小长臂虾 (Palaemonetes sinensis)体内ACP活性显著上升[30]。粟志民等[22]报道在低浓度氨氮 (1.25~10 mg∙L–1) 条件下,马氏珠母贝(Pinctada martensii) 血清中ACP活性随氨氮浓度的增加而升高,从而有效提高了机体的抗病力和免疫力,这与本实验结果一致;但在高浓度氨氮 (20~40 mg∙L–1) 下,马氏珠母贝的 ACP活性随氨氮浓度增加而急剧下降,这与本研究中高浓度氨氮组的变化有所不同。原因可能是本实验的采样时间点(24 h) 与前者 (72 h) 不同,短时间的氨氮胁迫不会使香港牡蛎出现免疫疲劳,故未观察到下降趋势。因此,肝胰腺中ACP活性增加可能是香港牡蛎为维持自身酸碱平衡和离子平衡而通过去磷酸化应激反应来主动调节和适应短期氨氮胁迫的结果。AKP是非特异性磷酸单酯酶,主要作用于细胞跨膜运输过程,是所有动物细胞所固有的质膜酶,但在氨氮、盐度及免疫刺激下,牡蛎肝胰腺组织中AKP活性变化均不显著。王帅等[31]研究表明低盐胁迫对中国血蛤 (Hiatula chinensis) AKP的影响不显著。本研究中,可能是由于过大的环境压力致使香港牡蛎的AKP活性受到抑制,而诱导需要一定的反应时间,也可能是由于机体免疫系统受到了严重损害。
MDA含量可以反映机体的脂质过氧化速率和强度,也能间接反映组织过氧化损伤程度,是反映机体抗氧化潜在能力的重要参数。氨氮胁迫下香港牡蛎体内MDA含量显著下降 (P<0.05),SOD活性显著上升。本研究结果与Florence等[32]报道的金属对紫贻贝 (Mytilus edulis) 和长牡蛎 (C. gigas) 脂质过氧化影响的结果相似,这可能是因为包括SOD在内的体内抗氧化酶体系增强,限制了MDA的生成。
SOD广泛存在于机体中,可以将∙O2−转化为O2和H2O2,在机体氧化应激反应中起重要作用。本研究中,低氨氮组和高氨氮组SOD活性均呈现显著诱导作用 (P<0.05),与方斑东风螺 (Babylonia areolata)[33]的研究结果相似;在盐度胁迫下,高盐度组牡蛎肝胰腺中的SOD活性显著升高 (P<0.05),这与马氏珠母贝[22]的研究结果一致。因此,SOD活性升高可能是因为氨氮或盐度等环境胁迫因子使牡蛎体内∙O2−生成增加,进而诱导了牡蛎自身机体的免疫防御机制,使SOD活性显著上调,催化∙O2−发生歧化反应以保持体内抗氧化系统的动态平衡。
T-AOC主要用于清除体内过量的ROS,从而保护机体免受损害,是反映机体总抗氧化能力的重要综合性指标。在感染哈维弧菌后,香港牡蛎肝胰腺的T-AOC活性显著下降 (P<0.05)。研究发现,金属蛋白酶的胁迫会使大菱鲆 (Scophthalmus maximus) T-AOC活性显著降低[34]。金属蛋白酶属于毒力因子,有较强致病性,哈维弧菌中也存在该蛋白酶。由此推测,哈维弧菌中金属蛋白酶的胁迫使得香港牡蛎体内积累了过量的ROS,导致其肝胰腺中T-AOC活性受到抑制,进而抑制了香港牡蛎机体的抗氧化系统。
NOS催化L-精氨酸合成NO,NO具有强大的免疫调节作用,参与机体免疫调控[35]。在高盐度胁迫下,NOS活性显著升高 (P<0.05)。与对照组相比,LPS组的NOS活性也显著升高 (P<0.05)。LPS可诱导炎症因子并通过NF-kB等转录途径激活大量基因,实现机体的免疫应答[36]。Shen等[37]研究表明LPS可诱导细胞中NOS的表达和NO的产生,能够刺激细胞中的NF-kB通路。蒋秋芬[38]对贝类NO系统研究发现,在LPS刺激下NOS活性与NO含量显著升高,进一步证实了NO系统参与贝类的免疫防御过程。因此,本研究中NOS在被诱导后合成大量的NO,参与到LPS诱发的免疫防御调节。
POD作为一种抗氧化酶,可以催化H2O2和其他底物反应,消耗H2O2,在机体氧化应激条件下发挥重要作用。本研究中,LPS明显抑制了POD活性 (P<0.05),而哈维弧菌组却无显著变化。Saleem等[39]发现牡蛎具有识别不同微生物抗原的能力,且能作出不同的机体反应,原因可能是香港牡蛎在分别注射LPS和哈维弧菌后免疫酶活性存在差异。在盐度胁迫下,POD活性较其他抗氧化酶敏感性较低,这一结果与Liu等[40]的相似。
不同于POD,CAT主要催化H2O2转化为H2O,从而达到消耗H2O2的目的[41],保持体内代谢平衡。本研究表明,氨氮胁迫和免疫刺激均使CAT活性下降,但盐度胁迫导致CAT活性上升。随着氨氮浓度的增加,香港牡蛎SOD和ACP活性呈升高趋势,高氨氮组CAT活性显著降低 (P<0.05),对方斑东风螺[33]的研究也有相似结果,这可能是由于氨氮浓度上升,使机体大量产生∙O−2等超氧化产物,诱导SOD活性升高将其转化为O2和H2O2,但∙O−2对机体也存在抑制作用,大量∙O−2使CAT活性难以升高甚至降低;金属蛋白酶具有抑制大菱鲆血清CAT活性的作用[34],这与本研究中哈维弧菌感染实验的结果一致,原因可能是蛋白酶破坏了香港牡蛎体内的免疫系统,并诱导ROS在体内积累使CAT活性下降。LPS也可以导致ROS的产生,从而诱导炎症和氧化应激。本研究中LPS诱导的ROS含量超过了机体的耐受程度,因未能及时清除使得CAT活性降低。在盐度胁迫下,实验组中CAT活性均显著高于对照组 (P<0.05)。李庭古[42]研究指出,盐度会影响虾蟹类的渗透压,虾蟹类主要通过改变代谢状况来适应不同的盐度环境。本实验与上述研究结果相似,在渗透压主动调节过程中,需要排出多余的盐分或水分来调节透渗压。此外,当机体内外存在较高渗透压梯度时,呼吸器官首先受到损伤,诱导细胞内氧自由基含量增加,这时需要更多的CAT来减少氧自由基对机体造成的损害。
通过上述3个胁迫实验,可以推测香港牡蛎在受到环境因子胁迫时,CAT可能适合作为环境监测的潜在生物标记物。为了验证这一个假设,本研究检测了不同温度与不同时间点干露胁迫下香港牡蛎肝胰腺中CAT活性的变化,发现长时间干露胁迫会降低香港牡蛎的非特异性免疫力,使CAT活性发生显著变化,这与Cui等[23]对白仿刺参 (Apostichopus japonicus) 的研究结果类似。从本实验结果可以看出2个温度的干露胁迫CAT 活性均呈下降、恢复、再下降趋势,虽然大体变化趋势相近,但存在时间上的差异变化。在4 ℃干露实验组中,由于温度骤变使CAT活性在第1天显著降低;25 ℃干露实验组在第3天CAT活性才显著降低,原因可能是当机体处于不利环境因素条件下,体内抗氧化酶活性受到限制。表明极端温度的干露胁迫对香港牡蛎机体的损伤程度更高,因为25 ℃是香港牡蛎适宜生存的温度,即使是在干露条件下其体内酶活性也并未从开始就剧烈变化,而是有一个延缓的趋势。不利因素在时间的加持下逐渐激发体内的抗氧化应激系统,致使CAT活性上升。4 ℃实验组第3与第7 天相比CAT活性差异显著,25 ℃实验组第3天CAT活性显著高于第5天。随着时间延长,牡蛎体内自由基的清除速率不及产生速率,致使自由基大量积累,破坏了体内抗氧化系统的动态平衡,导致CAT活性下降。这可能是7 d干露后CAT活性比0 d显著降低的主要原因。CAT活性在不同温度与时间的干露胁迫下表现出敏感性,验证了CAT适合作为环境监测的潜在生物标记物这一观点。
4 结论
本研究表明,抗氧化酶是香港牡蛎在外界因子胁迫下一种敏感的生理指标。环境因子胁迫会增加体内的自由基含量,刺激机体产生抗氧化防御反应,而自由基在体内积累过度会产生毒害作用。由此得出结论,香港牡蛎肝胰腺的CAT适合作为监测环境因子胁迫的潜在生物标记物,用于监测环境因子胁迫下香港牡蛎的氧化应激反应。

