微波诱导燃烧法制备纳米铝酸镧及其表征
范华风, 孟 竺, 吴 钳, 吴 静, 张 静, 储 刚
(辽宁石油化工大学a. 石油化工学院; b. 工程训练中心; c. 继续教育学院, 辽宁抚顺113001)
LaAlO3化合物是钙钛矿ABO3型结构,其有一定活性、 较好的热稳定性、 较低的介电损耗、 较小的介电常数、较大的比表面积、 宽的能隙等优势,因此在力、 热、 电磁、 光学和催化等各个方面具有优异的性能[1-2],被广泛应用于催化材料、 高温超导、 微波电子器件、 衬底材料、 陶瓷和荧光材料的基质材料等[3-4]。
目前,用来制备纳米LaAlO3的方法很多,其中常用的有沉淀法[6]、 微乳液法[7]、 溶胶凝胶法[8]、 溶液燃烧法[9-11]和微波诱导燃烧法[12]等。在这些方法中,微波诱导燃烧法是一种相对较新的制备稀土无机材料的方法,它是以有机物为反应物的燃烧合成,利用微波辐射带来超高能量,使反应物相互之间发生氧化-还原反应, 这种方法合成粉体材料提高了反应温度, 增大了反应速率[13]。 与常规加热相比,微波加热[14-15]具有升温速率快、 耗时短、 样品受热均匀、 易控制、 效能好等优点。 该法还能合成SrAl2O4∶Pr3+[16]、 SnO2[17]等纳米材料, 但存在产物容易出现杂相和团聚烧结现象, 影响产物性能, LaAlO3粉体的微波诱导燃烧法合成工艺条件有待进一步优化。 鉴于此, 本实验采用La(NO3)3·6H2O和Al(NO3)3·9H2O为氧化剂, C2H5NO2为还原剂,采用微波诱导燃烧法制备了纳米LaAlO3粉体,通过研究原料配比、煅烧温度和保温时间考察其最佳制备工艺条件。
1 实验
1.1 实验试剂和仪器
实验试剂为:分析纯Al(NO3)3·9H2O,中国国药集团化学试剂有限公司;分析纯La(NO3)3·6H2O,中国国药集团化学试剂有限公司;分析纯 C2H5NO2,中国国药集团化学试剂有限公司。
实验仪器: 电子数显天平(XY-2C), 天津精拓仪器科技有限公司; 家用微波炉(DW700S-1), 广东格兰仕微波生活电器制造有限公司; 马弗炉(SRJX-4-13), 天津市泰斯特仪器有限公司; 扫描电子显微镜(SU8010), 日本日立公司; X射线衍射仪(D/max RB), 日本理学公司。
1.2 纯相LaAlO3样品的制备
依据推进剂化学原理[18],计算出各反应物La(NO3)3·6H2O、 Al(NO3)3·9H2O、 C2H5NO2的理论物质的量的比(配比)为3∶3∶10。按照此配比,用电子天平准确称量这3种原料,将其置于研钵中,研磨至黏稠状,再转移至50 mL坩埚内,盖好坩埚盖,放在微波炉中加热,加热下反应物浓缩、 冒烟,温度不断上升,达到燃烧点后,样品自蔓延燃烧。为了去除反应过程中残留的碳化物,将燃烧反应得到的产物放在马弗炉中煅烧并保温一定时间,最终将合成粉体冷却后,收集反应物所合成的粉末。
1.3 合成产物的表征
采用X射线衍射仪(XRD)分析合成产物的物相, 铜靶 Kα辐射, 管电压为40 kV, 管电流为160 mA, 步长为0.02 °,扫描速率选定为4 (°)/min;扫描电子显微镜(SEM)观测合成粉体产物的形貌,并测定其颗粒粒径;荧光光谱分析仪测试合成产物的荧光特性,其光路设置条件为:入射、出射狭缝均为2.5 mm,将得到产物的荧光数据,将数据用Origin 8.0软件进行处理,得到荧光图谱,计算产物的特征峰位置以及峰的强度。
2 结果与讨论
2.1 微波功率对合成LaAlO3粉体的影响
家用微波炉不能确定温度,这就需要用实验来确定合成最佳产物的微波功率。实验采用的格兰仕微波炉,有5个功率档,分别是100、 80、 60、 40、 20档。其输出功率最大为800 W,对应的输出功率分别为800、 640、 480、 320、 160 W。实验条件筛选将在3个800、 640、 480 W不同功率条件下进行,考察不同功率下的反应情况,并确定合适的加热功率。
以Al(NO3)3·9H2O和La(NO3)3·6H2O为氧化剂, C2H5NO2为燃烧剂,制备纯相纳米LaAlO3粉体。在La(NO3)3·6H2O、 Al(NO3)3·9H2O、 C2H5NO2理论配比为3∶3∶10条件下进行实验。微波加热时间5 min,分别对800、 640、 480 W的微波功率进行实验研究。不同微波功率下的燃烧反应时间和产物见表1,不同微波功率下合成产物的XRD图谱见图1。
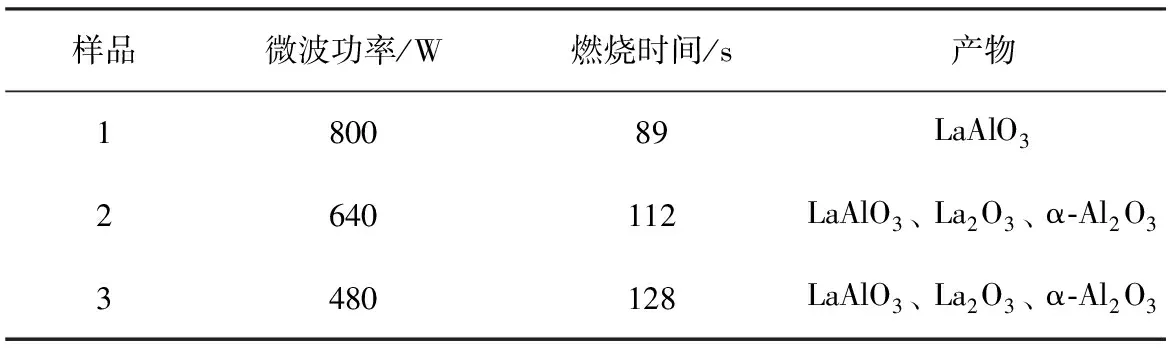
表1 不同微波功率下的燃烧反应产物
从表1可见,3个样品的燃烧时间及产物的形貌都不同。从时间来看,最先发生反应的是样品1,然后是样品2,最后是样品3。针对样品1,我们采用800 W的最大微波功率,因此,样品吸收的热量最多,升温速率最快,最先达到燃烧点,所以它的燃烧时间最短,最先发生燃烧反应。
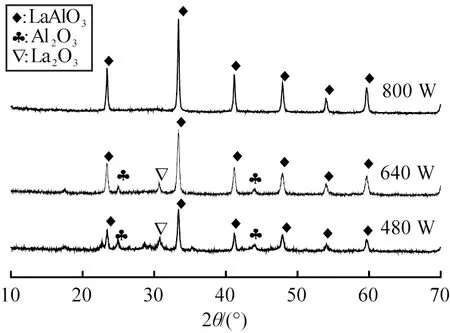
图1 不同微波功率下合成产物的XRD图谱Fig.1 XRD patterns of samples prepared with different microwave power
从图1可见,在480、 640 W的加热状况下,得到的产物中均存在2种少量的La2O3、 α-Al2O3杂质,而640 W的产物结晶比480 W更完全。这是由于加热样品3时,较低的微波功率降低了反应温升速率,反应物吸收到的热量少,这给部分杂相的生成创造了条件,从而产生了一些杂相,降低了目标产物的生成率。另一方面,也造成了反应不完全,使可能没有参与反应的La(NO3)3和Al(NO3)3在高温的作用下,分解出了La2O3和α-Al2O3。相比之下,合成产物的效果最好的是在800 W的反应,产物LaAlO3结晶完全,但是,残碳的不充分燃烧导致产物呈现灰黑色。从3组结果可以看出,产物中都含有残留的C,这说明样品的燃烧不充分,这是由于燃烧反应结束后,燃烧剂已耗尽,快速燃烧后的残C无法去除。
采用谢乐公式:D=Kλ/βcosθ,扣除对应低角度峰位的仪器本身的展宽,可计算目标产物的平均粒径,计算结果见表2。由图1和表2可知,微波功率为800 W时,得到的微波燃烧产物符合实验预期,为纳米LaAlO3粉体,其粒径为34.3 nm,而480、 640 W容易生成较多的杂相,因此选择800 W作为燃烧法的加热功率。
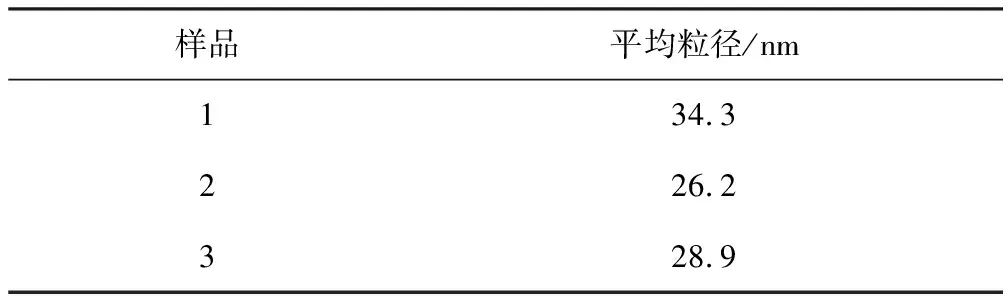
表2 合成LaAlO3粉体的平均粒径
2.2 原料配比对合成LaAlO3粉体的影响
在燃烧反应中,原料配比直接影响最终的产物的物相纯度,即Al(NO3)3·9H2O、 La(NO3)3·6H2O的配比影响LaAlO3粉体的纯度。根据热化学理论, 假定反应完全燃烧, 以理论反应方程式作为反应原料的配比, 即La(NO3)3·6H2O、 Al(NO3)3·9H2O、 C2H5NO2配比为3∶3∶10为基础, 在微波功率为800 W, 加热时间为5 min, 通过实验分析原料的配比对合成产物生成的影响。 以La(NO3)3·6H2O与Al(NO3)3·9H2O两组份的混合物, 两组份的配比为1∶1,分别称取混合物与C2H5NO2配比为3∶6、 3∶8、 3∶10、 3∶12和3∶14。燃烧反应的产物的物相见表3,所得产物的XRD表证如图2所示。
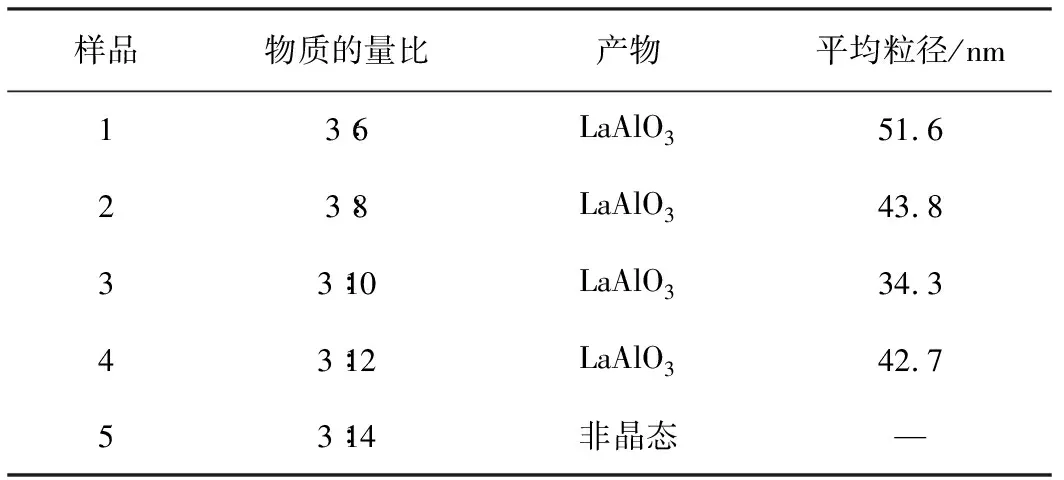
表3 不同原料配比下的燃烧反应产物和平均粒径
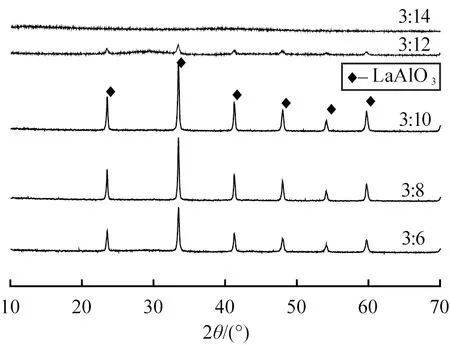
图2 不同原料配比下产物的XRD图谱Fig.2 XRD patterns of products with different ratios of raw materials
从图2可以看出,当原料配比为3∶14时,得到的产物都是非晶态的,这说明在微波800 W加热下,还原剂C2H5NO2用量太大,不会得到燃烧反应产物结晶相。当C2H5NO2用量比理论值稍大时,虽然也能生成LaAlO3,但衍射峰的强度弱,这说明结晶不是非常完全。原因是燃烧反应是一瞬间点燃只持续几分钟时间的反应,由于反应时间短,很多晶核还没生成的情况下反应已经结束。综上所述,合成的产物LaAlO3的粉体存在一个较佳的原料配比,即La(NO3)3·6H2O、 Al(NO3)3·9H2O、 C2H5NO2的物质配比为3∶3∶10。
由表3可知,原料配比的不同对目标产物有明显的影响。在反应中La(NO3)3·6H2O和Al(NO3)3·9H2O作为氧化剂,C2H5NO2作为还原剂,当C2H5NO2的用量小于理论值时,产物中出现杂质,产物呈现出淡黄色、灰白色物质,且坩埚内壁附着淡黄色固体。说明反应的原料燃烧不充分,可能是由于C2H5NO2用量少,氧化剂不能发生反应,在炉中脱水消耗热量,加上C2H5NO2生成的气体消耗的热量,导致局部燃烧温度较低,反应释放出来的热能不多。而当C2H5NO2的量超过理论值时,产物中出现了少量灰黑色物质。这可能是因为氧化剂不足,反应过程中没有足够的氧气,燃烧还原反应不能完全进行,多余的C2H5NO2在高温环境下分解而产生的残余碳所致。实验结果表明,在理论配比条件下可以得到理想的目标产物。
2.3 煅烧温度和保温时间对合成LaAlO3粉体的影响
为了除去微波诱导燃烧反应过程中产生的杂质, 并使晶核继续长大, 晶核发育更完整, 考察不同煅烧时间对合成产物的形貌和相组成的影响。 将微波诱导燃烧反应后的初产物在马弗炉中升温继续加热煅烧, 选取650~800 ℃间隔50 ℃分别煅烧1、 2、 3、 4 h,观察产物的颜色, 并对产物进行XRD图谱分析。图3的a)、 b)、 c)和d)分别是温度为650、 700、 750、 800 ℃分别保温1、 2、 3、 4 h的XRD谱。
从图3 a)中见,随着保温时间的增加,LaAlO3特征衍射峰的强度增强,峰型变窄,结晶度增加,但从合成产物粉体外观上看,依然掺有褐色物质存在,表明原料燃烧反应不充分,有少量残留C的存在,且颜色不随保温时间的延长而变白,所以650 ℃下煅烧不适合目标产物的合成。
从图3的b)、 c)、 d)中对应的XRD谱图中可以看到,随着保温时间的增加,LaAlO3的特征衍射峰的强度增强,峰型变窄,结晶度提高;从燃烧后粉体外观形貌上来看,700~800 ℃温度下的粉体颜色为纯白色粉末,说明反应的原料燃烧充分,没有C杂质的存在。而图3b)的XRD谱图可见,当保温时间到4 h时,XRD衍射图中的衍射峰高趋于稳定,说明晶体的晶型完整,产物纯度高,平均粒径为48 nm,得到了理想的LaAlO3粉体。因此,选择700 ℃下,煅烧4 h,可以得到理想的目标产物。为避免高温下的粉体产物的粒径增大和出现烧结现象,降低LaAlO3粉体的纳米特性,故排除高于700 ℃下煅烧合成目标产物。
2.4 目标产物LaAlO3粉体的表征
2.4.1 SEM分析
原料采用理论配比,目标产物纯相LaAlO3的SEM图像如图4所示。由图可知,目标产物LaAlO3粉体形貌较好,只有轻微团聚现象,颗粒分布均匀。
2.4.2 荧光光谱分析
目标产物纯相LaAlO3粉体的荧光光谱,如图5所示。单晶体LaAlO3的理论禁带宽度为5.6 eV,对应的波长为222 nm,曾雄辉等[19]在测定单晶体LaAlO3时得到了相关的光谱数据。由于电子从价带到导带的跃迁,使得在209 nm处有一个宽的吸收带,晶体在226 nm处有紫外吸收,因此在220 nm作为激发光时,没有明显的荧光峰。激发光谱是不同波长的光对材料发光性能的表征,进一步确定发光材料发光所需的波长范围,在波长大于220 nm的基础上变换激发波长时,激发波长的改变不影响发射波长与发光强度的关系。
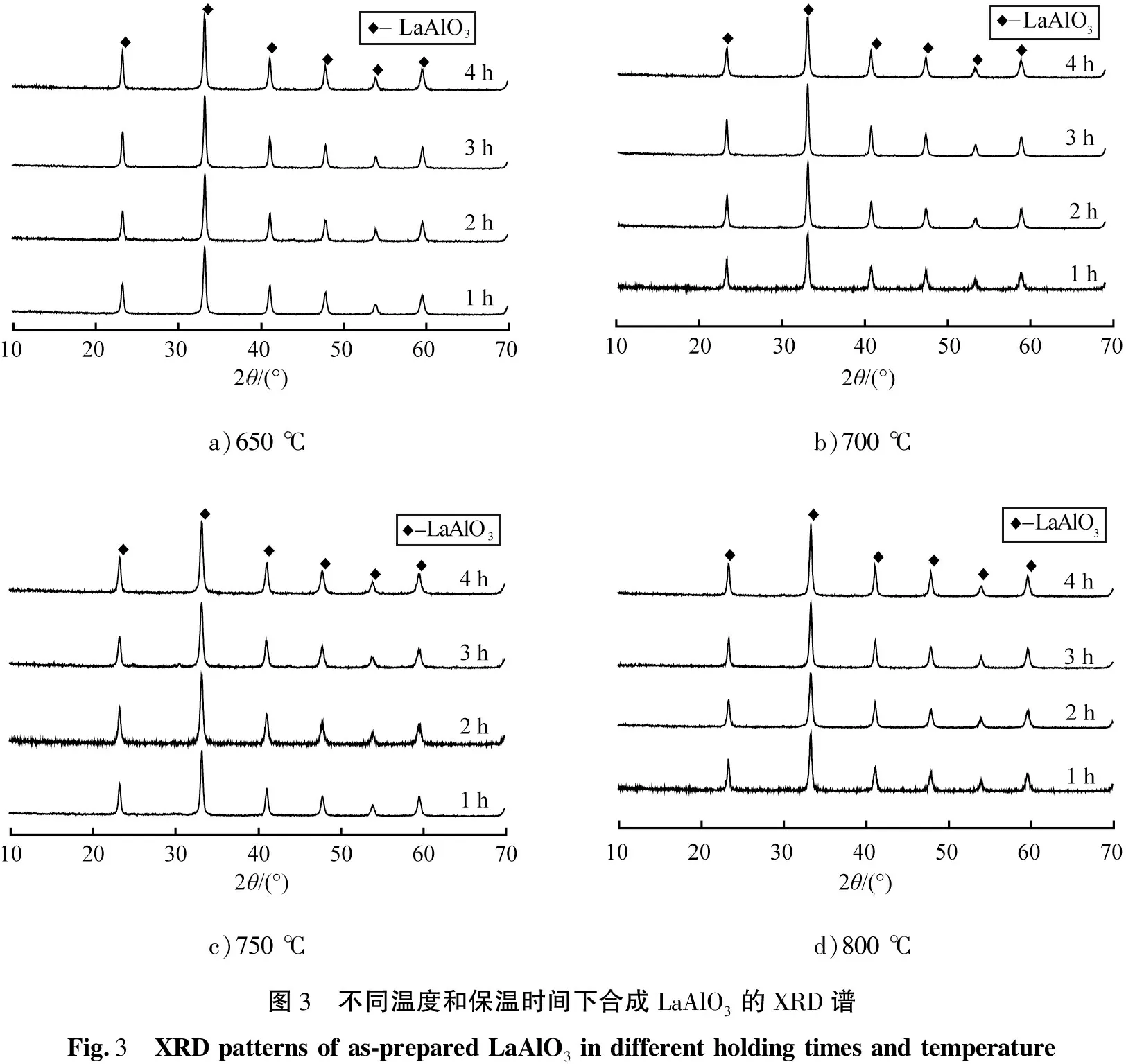
a)650 ℃b)700 ℃c)750 ℃d)800 ℃图3 不同温度和保温时间下合成LaAlO3的XRD谱Fig.3 XRD patterns of as-prepared LaAlO3 in different holding times and temperature
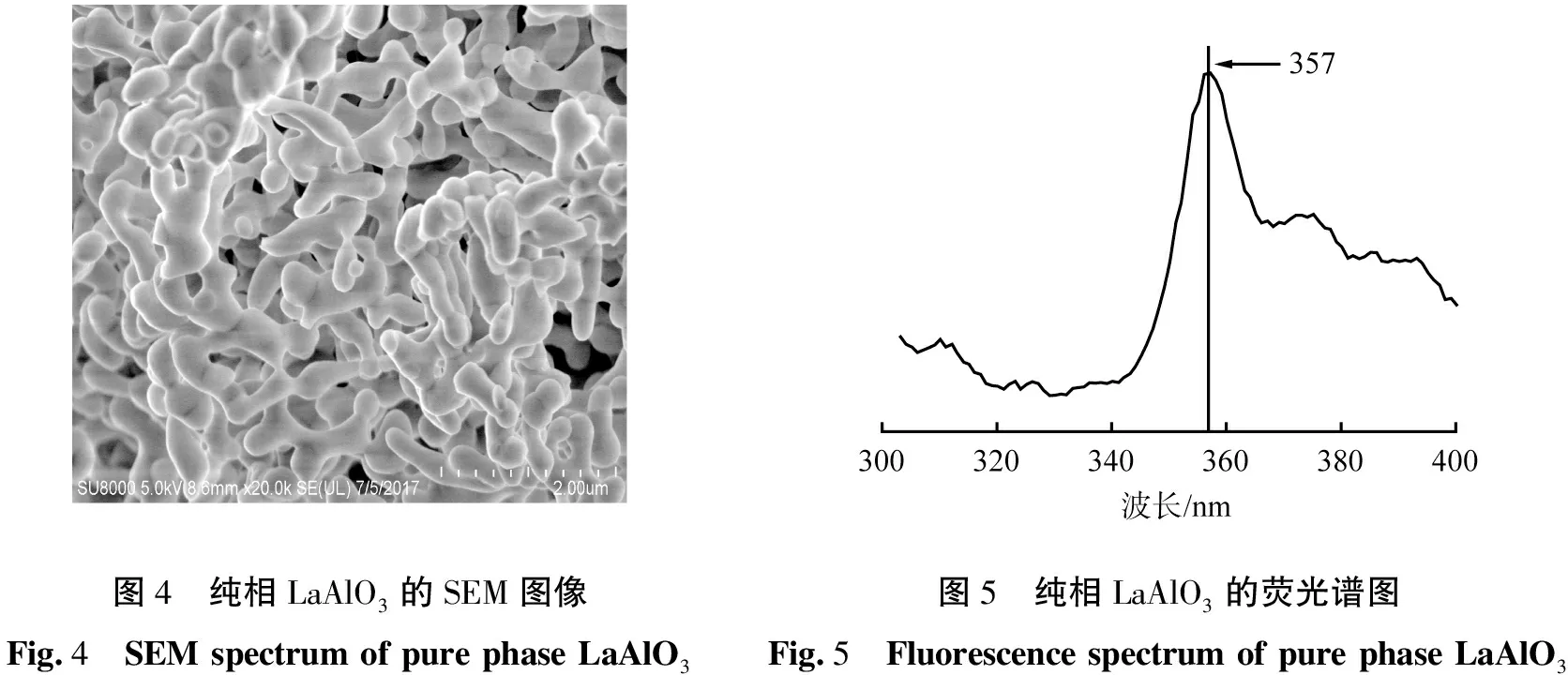
图4 纯相LaAlO3的SEM图像Fig.4 SEM spectrum of pure phase LaAlO3图5 纯相LaAlO3的荧光谱图Fig.5 Fluorescence spectrum of pure phase LaAlO3
相对于其他合成方法,由于燃烧法的反应过程剧烈,短时间形成大量微晶核,合成产物中可能存在大量的晶格缺陷,这些缺陷点位非易于接纳具有荧光激活特性的稀土元素的离子,特别是与La3+离子半径相近的Ce3+、 Eu3+和Pr3+等。由图5可见,在激发波长为260 nm时,LaAlO3在357 nm处有一个较弱的荧光峰。这可能是由于晶格缺陷造成的,但其稳定的结构可作为荧光基质材料。与La3+离子尺寸(0.011 7 nm)相近的稀土元素容易被引入其晶格点位,为制备掺杂改性的高活性稀土发光材料奠定了基础。
3 结论
1)以C2H5NO2作氧化剂,Al(NO3)3·9H2O和La(NO3)3·6H2O为还原剂,采用微波诱导燃烧法发生氧化-还原反应制备出纳米LaAlO3粉体。
2)微波诱导燃烧法合成过程中,微波功率、原料的配比、煅烧温度、保温时间等工艺参数对最终产物物相组成、粒径等均有影响。通过实验得出的工艺条件为:La(NO3)3·6H2O、 Al(NO3)3·9H2O和C2H5NO2的最佳的物质的量比为3∶3∶10下,微波功率为800 W下,加热5 min得到LaAlO3粉体的初产品,然后将初产品在马弗炉中700 ℃,保温4 h条件下,可以得到颗粒分布均匀、 平均粒径小于50 nm的LaAlO3晶体。
3)LaAlO3晶体在通常的条件下表现出的结构稳定性, 可以应用在荧光发光基质材料, 激光基质材料和物理材料等领域。

