PAC对SBR系统中传质-反应过程的影响研究
万 俐,席英伟,王鸿斌
(1.成都大学 建筑与土木工程学院,成都 610106;2.四川省生态环境监测总站,成都 610091)
前 言
污水处理过程实质是传质—反应过程,活性污泥微生物进行生化反应分解代谢污水中的污染物质,必伴随着传质过程的进行。絮凝剂用于预处理活性污泥污水处理系统,其残余量随着水流进入后续反应系统对系统内的活性污泥及其微生物活性的影响各不相同,同一絮凝剂对不同指标的影响趋势也不完全一致[1~3]。由于残余絮凝剂对活性污泥的作用,除了对活性污泥微生物自身的生物特性等的影响[2],还会对反应系统在污水处理过程中的传质机制产生影响,从而影响活性污泥及其微生物的活性,进而影响污水处理效果。
SBR为好氧生物污水处理系统,则曝气过程成为系统的重要能耗控制单元。溶解氧的传质速率是描述曝气过程效率的一个非常重要的指标,溶解氧传质速率越高说明反应系统内氧化还原反应速率越高、污水处理效果越好,即提高溶解氧传质速率是降低好氧污水处理工艺能耗的最直接有效的手段。反应系统中基质的扩散可通过减小活性污泥絮凝体的尺度缩短传质距离,从而提高其传质速率。EPS普遍存在于活性污泥絮体的表面和内部,EPS的特性对活性污泥絮体的尺度起着至关重要的作用[4~7],EPS中的蛋白质是好氧颗粒污泥的形成的关键[8~12],EPS及其蛋白质含量与反应系统的传质有着密切的联系。
PAC广泛用于各污水处理厂[13],为探索PAC对活性污泥活性的影响,通过实验对加入PAC的SBR反应系统以及空白系统中kLa的分析,并进一步分析残余絮凝剂对活性污泥EPS的影响与系统传质的相关性,从而考察残余絮凝剂对活性污泥传质机制的影响情况,进一步分析残余絮凝剂对SBR系统中活性污泥活性的影响机理。
1 材料与方法
1.1 实验方法
实验采用2个SBR反应器,由有机玻璃制成,工作容积8L。实验利用时间程序控制器自动运行,实验运行周期为8h包括:进水、搅拌、曝气、沉淀、排水,反应装置如图1所示。接种污泥采用四川省成都市高新西区污水处理厂干污泥,污水为人工配水,配制药剂及水质参数如表1所示。每个运行周期进水后向反应器投入10mg/LPAC,另1个反应器为空白对照。反应期间利用溶氧仪实时监测各反应系统的溶解氧浓度(DO),并利用空气流量计将DO控制在2.5~3mg/L之间。
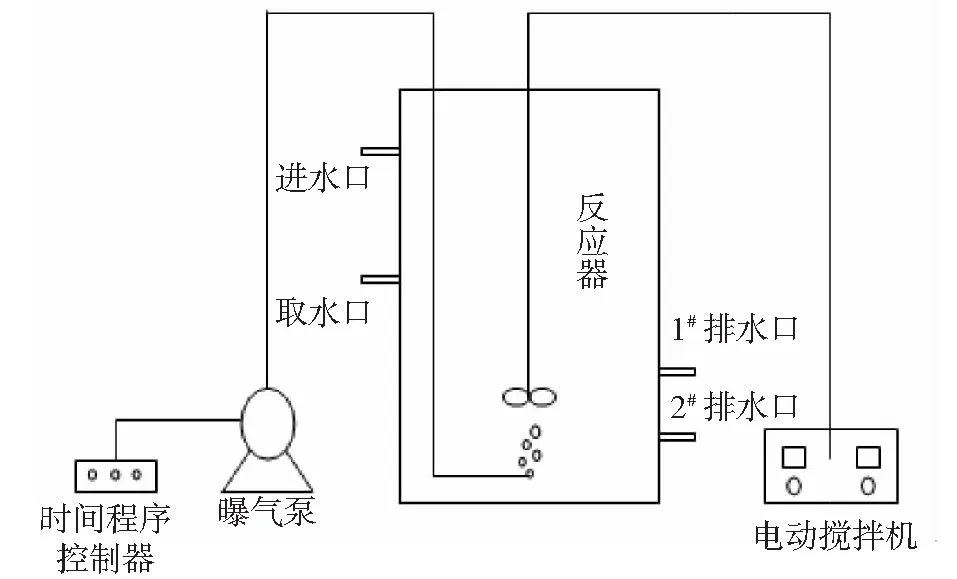
图1 试验装置示意图Fig.1 Schematic diagram of test equipment

表1 配制药剂浓度及进水水质参数Tab.1 Preparation of reagents concentration and inlet water quality parameters
1.2 KLa测定方法

图2 检测装置图Fig.2 Detection device diagram
实验采用如图2所示的装置进行溶解氧浓度变化情况的检测,测量装置由有机玻璃制成,工作容积1 L(内径d=8 cm),装置上端设有通气孔,底部设有曝气砂芯曝气,并用流量计维持恒定曝气量,依靠搅拌器以恒定的转速保证泥水均匀混合,利用溶氧仪监测系统内溶解氧浓度,并与电脑连接采集数据。实验于25℃的空调房内操作以维持实验温度的稳定。具体实验方法如下。
(1)取反应系统曝气刚好停止时的泥水混合液500 mL于测量装置内(此500 mL泥水混合液待测定完成后,作为反应系统排泥量排出,即本研究SBR反应系统的污泥龄为16 d)。
(2)曝气,使装置内污泥溶解氧达到饱和并平稳5 min左右,停止曝气。
(3)搅拌,关闭通气孔保证装置内的密闭性,当溶解氧下降到1 mg/L左右,停止搅拌。
(4)继续曝气,打开通气孔维持装置内外气压平衡,直到溶解氧达到饱和并平稳15~20 min后完成测试。
(5)将数据拟合得到kLa值(如图3所示),第一次曝气停止后溶解氧曲线的下降斜率为污泥耗氧速率OUR,第二次曝气即得出溶解氧变化速率:

(1)
公式(1)中:kLa—体积溶氧传递系数,min-1;
OUR—污泥耗氧速率,mg/L·min;

C∞—饱和溶解氧浓度,mg/L;
C—为溶解氧浓度,mg/L。
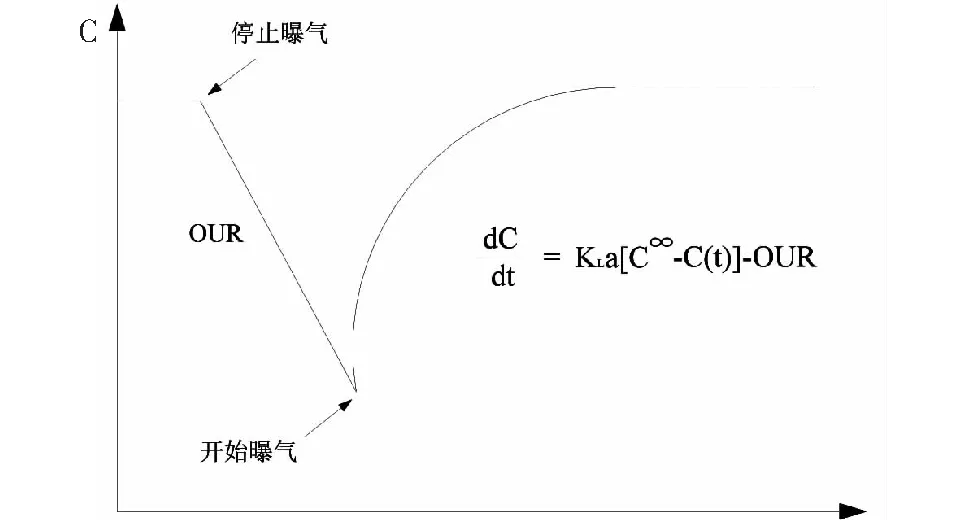
图3 kLa拟合示意图 Fig.3 KLa fitting schematic diagram
1.3 EPS中蛋白质含量测定方法
EPS提取方法采用加热法[11-12];蛋白质检测采用改进型Lowry法,以牛血清蛋白作为标准物质。
2 结果讨论
2.1 残余PAC对SBR系统kLa影响分析
通过考察加入PAC、空白两个反应系统中KLa的变化情况,结果如图4所示。
在PAC系统内,kLa一直低于空白,平稳至13 d后,随着残余PAC在SBR系统中的不断积累,kLa迅速降低最终于第31 d低于检出限。说明残余PAC进入SBR系统不利于系统内活性污泥的溶解氧传质,并且随着残余PAC不断进入,会抑制反应系统内的溶解氧传质,从而抑制反应系统内的氧化还原等生化反应,从而使污水处理效果降低。分析原因,PAC对活性污泥微生物有生物毒性作用,且能抑制活性污泥微生物活性[14]。由于残余PAC对反应系统内活性污泥微生物的毒性作用是生物累积作用的结果,反应前13 d内残余PAC量较少、生物毒性较弱,较其生物毒性作用,残余PAC的絮凝特性对活性污泥絮体发挥的作用更大,反应系统的氧化还原反应也较正常,则反应系统内kLa相对较稳定。随着残余PAC不断进入反应系统,其生物毒性作用逐渐增强对反应系统内活性污泥微生物活性的抑制作用也逐渐加强。在反应系统中,残余PAC除对活性污泥微生物的毒性作用外,其还可以通过破坏活性污泥微生物细胞的细胞壁、细胞膜,使细胞渗透功能紊乱、细胞膜流动受阻[15-16]。基质中的溶解氧需要通过EPS、细胞壁、细胞膜等传质进入活性污泥微生物细胞内,则在13 d后随着残余PAC不断进入反应系统内,反应系统内的kLa快速降低并于30 d后低于检出限。此外,第37 d开始阻止残余PAC进入反应系统,均未能检测出kLa。
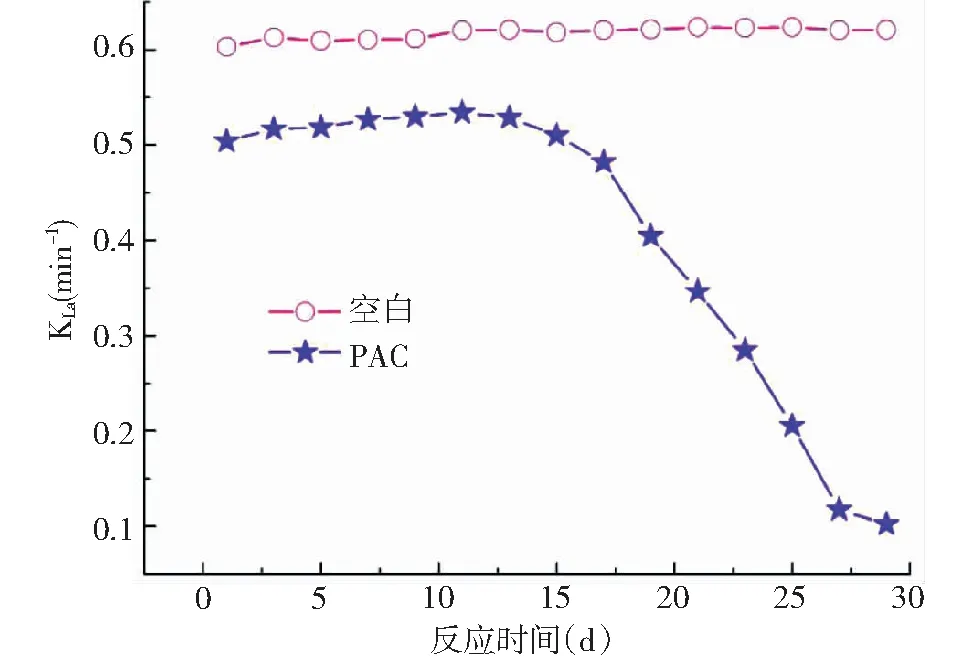
图4 PAC系统中kLa变化趋势Fig.4 Variation trend of kLa in PAC system
2.2 PAC投加对EPS中蛋白质含量的影响
蛋白质作为EPS中的重要组分,与EPS的疏水特性紧密相关,对PAC和空白反应系统中EPS的蛋白质含量及其所占比例变化情况进行研究,结果如图5所示。在PAC系统内EPS的蛋白质含量均低于空白系统,并且随着PAC的加入蛋白质含量平缓至10 d左右后迅速下降,此趋势与图4所示的kLa变化趋势一致。通过对PAC系统中反应30 d内的kLa与EPS的蛋白质含量的相关性分析,求得相关系数r=0.9462,则两者表现为显著正相关性。这说明在PAC系统中,EPS中的蛋白质对溶解氧传质的有着重要的影响作用,EPS中的蛋白质含量的升高能促进溶解氧的传质,进而提高生化反应率、促进活性污泥活性。此外,第31 d后PAC系统中的kLa值已低于检出限,则kLa与EPS的蛋白质含量的正相关性并不适用于说明本研究的整个反应周期,仅对反应的前30 d内适用。

图5 PAC系统中前30 d EPS的蛋白质含量变化趋势Fig.5 Variation trend of protein content of EPS in the first 30 d in PAC system
2.3 PAC系统中kLa与EPS的蛋白质含量的相关性分析影响
传统的活性污泥系统中或多或少有好氧颗粒污泥的存在,相对于活性污泥絮体,颗粒污泥在气液传质上有着更明显的优势。EPS及其蛋白质组分在好氧颗粒污泥形成的过程中扮演着重要角色,在颗粒化过程中EPS的蛋白质含量和蛋白/多糖比值明显增大,并与疏水性、表面电荷等污泥表面特性指标呈正相关[17]。通过对PAC系统中反应30 d内的kLa与EPS的蛋白质含量的相关性分析,求得相关系数r=0.9462,则两者表现为显著正相关性。这说明在PAC系统中,EPS中的蛋白质对溶解氧传质的有着重要的影响作用,EPS中的蛋白质含量的升高能促进溶解氧的传质,进而提高生化反应率、促进活性污泥活性。此外,第31 d后PAC系统中的kLa值已低于检出限,则kLa与EPS的蛋白质含量的正相关性并不适用于说明本研究的整个反应周期,仅对反应的前30 d内适用。
3 结 论
3.1 PAC可对活性污泥微生物造成生物毒性,降低SBR系统中kLa及活性泥泥EPS的蛋白质含量,阻碍系统内的传质-反应过程;且随着PAC在系统中的积累,系统内生物毒性越大,传质-反应过程越慢。
3.2 活性污泥EPS中蛋白质对溶解氧传质有着重要的影响作用,其含量越高溶解氧传质速率越快,反应系统中kLa与EPS的蛋白质含量表现为显著正相关性(相关系数r=0.9462)。
3.3 PAC作为絮凝剂在污水处理系统中至关重要,鉴于残余PAC会阻碍后续生物处理系统的传质-反应过程,故在实际污水处理应用过程中应严控其用量。

