小麦烷基间苯二酚对3T3-L1脂肪细胞胰岛素抵抗改善作用及机制
郝一铭,杨子慧,刘 洁,王子元,王 静
(北京工商大学 中加食品营养与健康联合实验室,北京 100048)
肥胖伴随的慢性低度炎症加速巨噬细胞对脂肪组织的浸润,加速脂肪组织脂质分解,导致机体胰岛素抵抗[1]。肥胖人群脂肪组织中的脂肪细胞和巨噬细胞相互作用,促进巨噬细胞活化为炎性巨噬细胞(M1),进而提高促炎细胞因子分泌,如白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)和单核细胞趋化蛋白-1(MCP-1)等[2]。炎性巨噬细胞分泌的促炎性细胞因子会导致胰岛素受体底物-1(IRS-1)发生降解,从而损伤脂肪细胞的胰岛素敏感性[3]。胰岛素受体底物-1/磷酸肌醇3-激酶/Akt(IRS-1/PI3K/Akt)是受胰岛素调节的一条重要分子信号通路,IRS-1的降解可能影响IRS-1/PI3K/Akt通路下游葡萄糖转运蛋白4(GLUT4)的表达[2-3]。作为调控葡萄糖吸收的关键蛋白,GLUT4表达的下调最终导致脂肪细胞葡萄糖摄取的阻断[4]。此外,脂肪组织在炎症环境下发生脂质分解,释放更多游离脂肪酸,导致肥胖人群的血浆游离脂肪酸水平普遍较高[5-6],而血浆中游离脂肪酸含量的升高会进一步引发机体的胰岛素抵抗[7]。
流行病学研究表明,全谷物膳食可降低肥胖、2型糖尿病、心血管疾病的病发和死亡风险[8-11]。全谷物的健康功效归因于其麸皮中含有的功能活性成分,例如膳食纤维及多酚等植物化学素。烷基间苯二酚(alkylresorcinols,ARs)是存在于小麦和黑麦中一种酚类类脂,在每克小麦麸皮中约含有300~1 500 μg[12]。已有研究表明,60%的ARs进入人体后会被小肠吸收,因此常被作为全谷物膳食的重要生物标志物[13]。近年来,ARs作为重要的全谷物活性功能成分,被报道具有抗氧化[14]、抗炎[15]、神经保护[16]等多种生物活性。Zhu等[13,17]发现,ARs可以有效抑制结肠癌细胞的生长,并且不同烷基链长度的ARs之间的抑制活性具有差异;Oishi等[18]的研究表明,高脂饲料中添加质量分数为0.4%的ARs,能够改善高脂饮食导致的小鼠胰岛素抵抗。本团队前期研究发现,ARs通过抑制NF-κB和JNK/MAPK信号通路,可以抑制脂多糖(LPS)诱导的RAW264.7巨噬细胞炎症因子表达[15];ARs通过Akt依赖的Nrf2/HO-1信号通路,可以保护ARPE-19细胞免受氧化应激损伤[14];ARs主要活性单体AR-C17可以通过调节SIRT3/SOD2信号通路改善APP/PS1转基因小鼠的认知障碍和神经炎症[16]。
近年来的研究表明,人体脂肪组织中的ARs含量可达到883~1 142 pmol/g,因此ARs在人体脂肪中的含量被作为检测人们长时间进食全谷物膳食的生物标志物[19]。目前,关于ARs对于脂肪细胞的健康效应尚不清楚,ARs是否可以改善肥胖导致的脂肪细胞胰岛素抵抗作用的机制尚未见报道。本研究拟通过建立体外模拟炎症诱导的脂肪细胞胰岛素抵抗模型,评价小麦ARs对于脂肪细胞脂质分解和葡萄糖利用的改善作用,进一步解析其改善脂肪细胞胰岛素抵抗的分子作用机制并明确其活性单体,希望为全谷物膳食抑制肥胖及由肥胖导致的胰岛素抵抗提供基础理论依据。
1 材料与方法
1.1 材料与试剂
十七烷基间苯二酚(AR-C17)、十九烷基间苯二酚(AR-C19)、二十一烷基间苯二酚(AR-C21)、二十三烷基间苯二酚(AR-C23)和二十五烷基间苯二酚(AR-C25)标准品,购自美国Sigma-Aldrich公司;济麦22号小麦麸皮中ARs制备方法及含量测定参考文献[15]中方法,其中ARs各主要组成单体质量分数依次为:AR-C17,1.5%;AR-C19,20.8%;AR-C21,58.2%;AR-C23,9.0%和AR-C25,10.5%。3-异丁基-1-甲基黄嘌呤(IBMX)、地塞米松、胰岛素、LPS、噻唑蓝(MTT)、PI3K抑制剂(LY294002),购自美国Sigma-Aldrich公司;Dulbecco’s Modified Eagle Medium(DMEM)高糖培养基、小牛血清(NBCS)、胎牛血清(FBS)、青霉素-链霉素、0.25% 胰蛋白酶,购自美国Gibco公司;甘油含量检测试剂盒,购自南京建成生物工程研究所;葡萄糖吸收转运荧光探针(2-NBDG)吸收试剂盒,购自美国BioVision公司;磷酸化Akt(Ser473)多克隆抗体、Akt多克隆抗体、GLUT4多克隆抗体、β-actin多克隆抗体,购自武汉ABclonal公司;3T3-L1和RAW 264.7细胞系,购自美国ATCC。所有其他化学品和溶剂均为分析纯。
1.2 仪器与设备
GEN5型多功能酶标仪,美国Bio-Tek公司;IX73型荧光显微镜,日本奥林巴斯公司;HF90型二氧化碳生化培养箱,上海力康公司;ChemiDoc成像系统、Mini-Trans-Blot全能型蛋白转印系统,美国Bio-Rad公司;YJ-VS-1型超净工作台,济南鑫贝西生物技术有限公司;5427R型低温高速离心机,德国Eppendorf公司;Mini-Protean型蛋白电泳仪,美国伯乐公司。
1.3 实验方法
1.3.1炎症诱导培养基制备
RAW 264.7巨噬细胞采用DMEM与体积分数为10%的FBS培养基,并置于37 ℃、体积分数为5%的CO2环境中培养。将RAW 264.7细胞按照2×105个/mL接种于细胞培养皿上,培养24 h后进行分组。设置对照组和LPS炎症诱导组。对照组:更换新鲜的正常培养基,继续培养24 h;炎症模型组:更换含有1 μg/mL LPS的正常培养基,诱导细胞炎症反应24 h[20]。收集巨噬细胞上清液培养基,分别作为空白培养基和炎症诱导培养基。
1.3.23T3-L1前脂肪细胞诱导分化与处理
细胞分化流程参照文献[21],具体操作方法:3T3-L1细胞采用DMEM与体积分数为10%的NBCS培养基,置于37 ℃、体积分数为5%的CO2环境中培养。按照融合度60%将3T3-L1细胞接种到培养板中,用生长培养基(DMEM+10% NBCS)培养至细胞完全融合,继续培养2 d让细胞产生接触抑制。加入诱导液Ⅰ(高糖DMEM+10% FBS,10 μg/mL胰岛素,1 μmol/L地塞米松,0.5 mmol/L IBMX 的培养液)培养2 d后,替换为诱导液 Ⅱ(高糖DMEM+10% FBS,10 μg/mL胰岛素培养液),继续培养2 d,最终换成高糖培养基(DMEM+10% FBS)培养2 d,即得到分化成熟的脂肪细胞。分化成熟的脂肪细胞分别加入5、10、20 μmol/L的ARs及20 μmol/L ARs各单体化合物(AR-C17、AR-C19、AR-C21、AR-C23、AR-C25)处理24 h,换炎症诱导培养基处理24 h,再分别检测各指标。细胞模型及分组情况见表1。

表1 脂肪细胞模型的构建Tab.1 Construction of adipocyte model
1.3.3细胞活力检测
分化成熟的3T3-L1脂肪细胞加入终浓度为5、10、20 μmol/L的ARs培养基作用24 h;更换等体积的含0.5 mg/mL MTT的新鲜培养基,并在37 ℃、体积分数为5%的CO2环境下继续培养4 h;去除上清液后,用1 000 μL二甲基亚砜溶解沉淀结晶紫,使用酶标仪在490 nm处测量吸光值。
1.3.4PI3K抑制剂干扰处理
3T3-L1前脂肪细胞分化成熟后,加入ARs处理24 h,换含有1 μmol/L LY294002的新鲜培养基处理24 h,吸取上清液后,PBS清洗2次,换炎症诱导培养基CM处理24 h,检测脂质分解及葡萄糖吸收指标。
1.3.5脂肪细胞葡萄糖吸收与脂质分解检测
通过检测2-NBDG荧光强度评价细胞葡萄糖吸收水平。3T3-L1成熟脂肪细胞经过不同处理后,收集细胞上清培养液,通过检测甘油含量测试脂质分解程度。根据2-NBDG吸收试剂盒操作说明,将葡萄糖摄取增强剂按照体积比1∶100加入到DMEM培养基中,细胞继续更换含有100 μg/mL 2-NBDG的DMEM(含葡萄糖摄取增强剂)培养基,培养30 min,吸取上清液,PBS清洗2遍后,采用质量分数为4%的多聚甲醛溶液固定细胞0.5 h,并用DAPI溶液染色5 min。脂肪细胞葡萄糖吸收能力用脂肪细胞在激发/发射波长465/540 nm (2-NBDG)与358/461 nm (DAPI)处的荧光强度比值表示,并与NC组进行归一化。
1.3.6油红O染色
3T3-L1成熟脂肪细胞经过不同处理后,移除上清液,并用PBS洗涤3次。采用体积分数为4%的多聚甲醛溶液固定细胞1 h,移除甲醛溶液并用PBS再次清洗两遍。采用体积分数为60%的异丙醇媒染15 s,油红O试剂染色30 min。终止染色后移除染液,用体积分数为60%的异丙醇洗涤15 s去除多余的油红O试剂。用PBS清洗3次后显微镜观察并拍照,每孔加入1 000 μL异丙醇,震荡5 min洗出油红O。每孔取200 μL洗出油红的异丙醇溶液,转移至96孔板中,于490 nm处测定吸光值。
1.3.7蛋白质印迹实验
3T3-L1脂肪细胞经过不同处理后,采用RIPA(radio immunoprecipitation assay)裂解液[含1 mmol/L苯甲基磺酰氟(PMSF)]抽提脂肪细胞总蛋白,12 000 r·min-1离心20 min,收集细胞裂解上清液。BCA法测定细胞裂解液总蛋白浓度,95 ℃变性蛋白。采用质量分数为12%的聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白各个条带,每个泳道蛋白样品上样量为60 μg。SDS-PAGE分离结束后,将蛋白条带转移至硝酸纤维素膜(NC)分离,采用质量分数为5%脱脂奶粉的Western洗涤缓冲液(TBST)室温封闭1 h,4 ℃过夜孵育目的蛋白抗体(按体积比例1∶1 000稀释anti-GLUT4、anti-p-Akt、anti-Akt和anti-β-actin)。将NC膜用TBST清洗3次,采用Alexa 488 标记的山羊抗兔IgG(按体积比例1∶10 000稀释)二抗,室温孵育1 h。采用成像系统分析蛋白条带荧光值。
1.4 数据处理
实验均重复3次,采用Graphpad Prism 8.0和SPSS 22.0软件进行数据处理。实验结果以平均值±标准偏差表示,组间比较采用One-way ANOVA和Duncan后比较分析,不同字母表示不同样本同一指标差异显著(P<0.05)。
2 结果与分析
2.1 ARs对3T3-L1脂肪细胞胰岛素抵抗的影响
ARs对炎症诱导的脂肪细胞糖脂代谢的影响,实验结果见图1。由图1(a)可知,5~20 μmol/L ARs未对脂肪细胞产生毒性影响。进一步建立脂肪细胞胰岛素抵抗模型,研究5~20 μmol/L ARs对脂肪细胞葡萄糖吸收与利用的保护作用。由图1(b)可知,与空白组相比,炎症诱导下3T3-L1脂肪细胞2-NBDG摄取水平显著降低了43.0%(P<0.05);同时,ARs(5~20 μmol/L)可以剂量依赖性地提高3T3-L1脂肪细胞糖吸收水平。用5、10、20 μmol/L ARs处理的3T3-L1脂肪细胞,显著增加了炎症诱导下的2-NBDG摄取量,分别较CM炎症诱导组提高了4.3%、10.2% 和24.0%,表明ARs对炎症诱导的脂肪细胞糖脂代谢紊乱具有保护作用。脂肪细胞脂质过度分解通常被视为机体产生胰岛素抵抗性的主要原因[22]。有研究表明,炎症引发的脂解作用会诱导大量的游离脂肪酸的产生,从而进一步破坏细胞胰岛素信号,最终导致胰岛素抵抗性的发生[23-25]。由图1(c)和(d)可知:炎症诱导的脂肪细胞脂质含量与NC组相比降低了32.3%,而甘油释放量显著增加了86.5%,表明炎症导致脂肪细胞脂质分解;20 μmol/L ARs 显著逆转了炎症造成的脂肪细胞脂质含量和甘油释放紊乱(P<0.05),进而抑制了脂肪细胞脂质分解。

不同字母表示不同样本同一指标差异显著(P<0.05)。图1 ARs对炎症诱导的脂肪细胞糖脂代谢的影响Fig.1 Effect of ARs on glucose and lipid metabolism of adipocytes under inflammatory stress
显微镜观察脂肪细胞油红O染色结果见图2。由图2可知,经炎症诱导培养基处理后,3T3-L1脂肪细胞中的脂滴形态出现明显减小,而AH组脂肪细胞中的脂滴形态恢复至正常情况。3T3-L1脂肪细胞中的油红O观察结果与图1中的细胞脂质含量和甘油释放量结果相一致,说明ARs显著改善了炎症导致的3T3-L1脂肪细胞脂解作用。研究结果表明,ARs是通过改善炎症引发的脂肪细胞脂解,来缓解胰岛素抵抗,进而维持脂肪细胞正常生理功能的[23]。
2.2 ARs对3T3-L1脂肪细胞糖吸收相关蛋白表达水平的影响
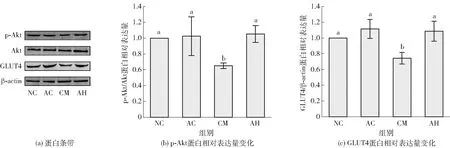
不同字母表示不同样本同一指标差异显著(P<0.05)。图3 ARs对脂肪细胞糖吸收关键蛋白Akt及GLTU4表达水平的影响Fig.3 Effect of ARs on expression level of glucose uptake related protein Akt and GLUT 4 from adipocytes under inflammatory stress
进一步解析ARs在改善炎症引发的脂肪细胞胰岛素抵抗中的保护作用机制,采用Western Blot对胰岛素调控糖吸收相关通路蛋白进行定量分析,实验结果见图3。由图3可知,当炎症培养基诱导脂肪细胞胰岛素抵抗后,细胞内GLUT4和p-Akt蛋白表达水平与NC组相比显著降低了39.7%和46.1% (P<0.05)。GLUT4和p-Akt是胰岛素信号通路调节糖吸收的主要蛋白[26-28],其中p-Akt调控GLUT4向细胞膜转移并提高葡萄糖吸收利用[26];同时,PI3K/Akt是多种活性物质改善胰岛素抵抗作用和提高糖吸收的重要信号通路[25]。有报道证实,富含酚类物质的小麦粉可以通过p-Akt途径显著改善肥胖大鼠的胰岛素抵抗[29];同样,本研究发现,经过20 μmol/L的ARs处理后的脂肪细胞内GLUT4和p-Akt蛋白表达水平与CM组相比显著提高了35.9%和42.6%(P<0.05)。本研究结果显示,ARs可能是通过激活p-Akt/GLUT4 信号通路而提高糖吸收水平,改善胰岛素抵抗的。
2.3 ARs通过激活p-Akt/GLUT4信号通路对脂肪细胞糖脂代谢改善分析
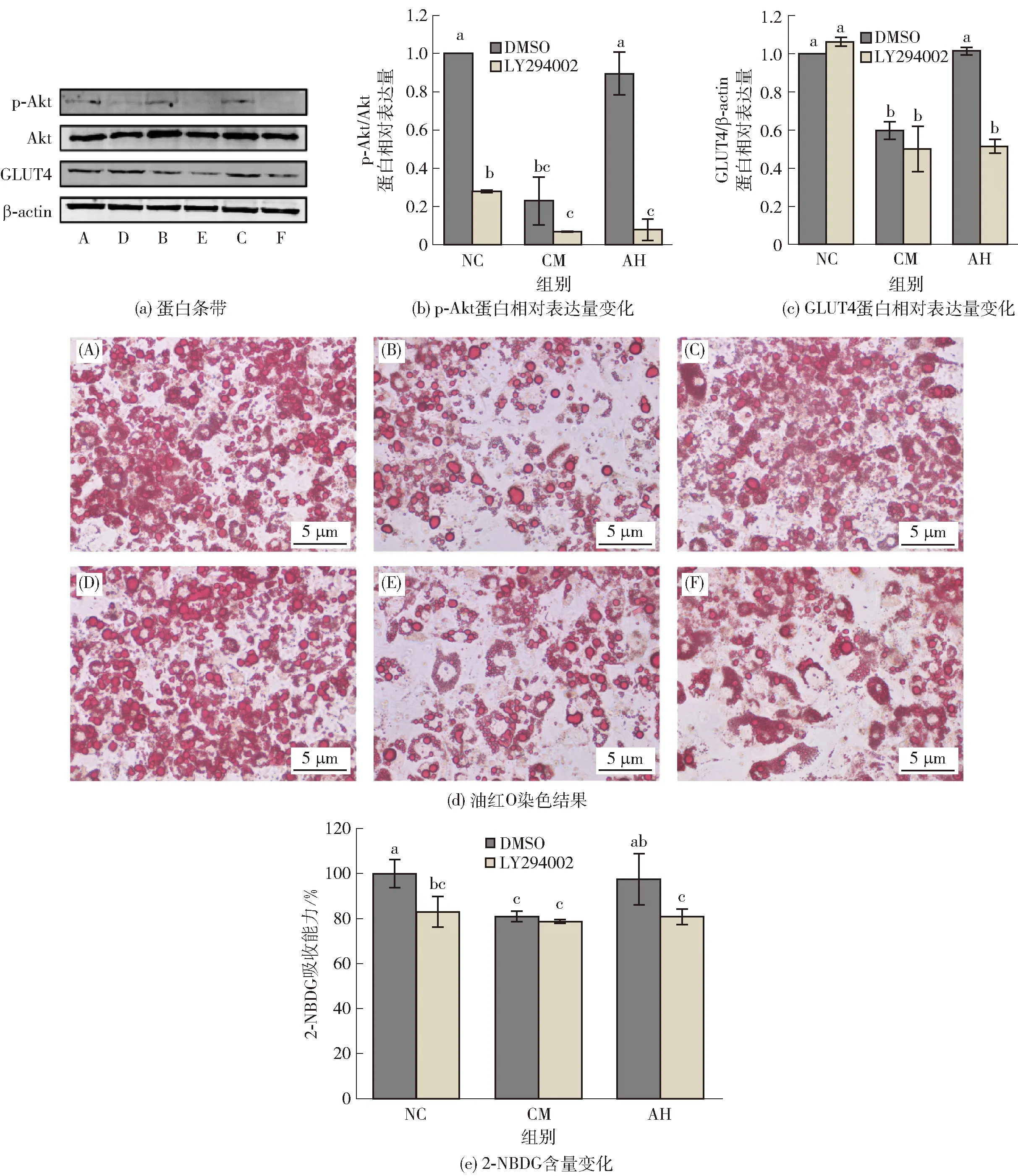
蛋白条带图和油红O染色图中的A、B、C、D、E、F分别为NC、CM、AH、NC+LY294002、CM+LY294002、AH+LY294002组。不同字母表示不同样本同一指标差异显著(P<0.05)。图4 LY294002抑制ARs保护脂肪细胞糖脂代谢作用分析Fig.4 Analysis of LY294002 inhibition on protective effects of ARs on glucose and lipid metabolism
为了探讨ARs对于脂肪细胞胰岛素抵抗保护作用是否特异性激活Akt信号通路,本研究采用LY294002作为PI3K抑制剂,通过抑制PI3K活性以降低p-Akt的蛋白表达水平来进行验证,实验结果见图4。由图4(a)至图(c)可知,采用PI3K抑制剂(LY294002)预处理脂肪细胞后,细胞内p-Akt的表达水平及其下游GLUT4蛋白表达受到显著抑制。ARs对于细胞p-Akt及GLUT4的表达提高被显著逆转;同时,有研究表明,p-Akt表达受到抑制后,胰岛素改善的脂解作用也被削弱[30]。本研究对LY294002干预后的脂肪细胞脂质积累进行分析,探讨ARs激活的p-Akt/GLUT4通路是否参与到ARs对脂肪细胞脂质积累紊乱的保护作用。
图4(d)结果显示,LY294002干扰下AH组脂肪细胞中的脂质积累低于AH组。研究结果说明,随着p-Akt/GLUT4通路表达的降低,ARs改善的脂肪细胞脂质积累保护效果受到限制。抑制剂对于脂肪细胞葡萄糖吸收的影响结果表明,ARs提高3T3-L1脂肪细胞的2-NBDG摄取水平也受到LY294002的显著抑制[图4(e),P<0.05]。本研究发现,ARs除了通过抑制脂肪细胞脂解改善糖吸收能力,还能够通过激活p-Akt/GLUT4介导的糖吸收抑制脂解。谷物中的多种植物化学素已被证实可以通过激活PI3K/Akt/GLUT4信号通路提高糖吸收水平,改善胰岛素抵抗[31-34]。Oishi等[18]发现,ARs可以提高肝脏中的p-Akt表达,这可能与ARs维持血糖平衡相关。ARs还被证实可以激活PI3K/Akt,发挥细胞保护活性[14]。本研究表明,ARs能够通过特异性激活PI3K/Akt发挥生物活性。
2.4 ARs主要单体对脂肪细胞胰岛素抵抗改善作用的活性比较

不同字母表示不同样本同一指标差异显著(P<0.05)。图5 ARs单体同系物对于炎症诱导的脂肪细胞糖吸收水平改善作用分析Fig.5 Analysis of protective effect of ARs monomers on glucose uptake from adipocytes under inflammatory stress
进一步研究了小麦ARs的5种主要单体成分对于脂肪细胞胰岛素抵抗改善作用,实验结果见图5。由图5可知,在同等浓度下,与其余单体相比,十七烷基间苯二酚(AR-C17)能够改善脂肪细胞胰岛素抵抗,增加细胞对于葡萄糖吸收的效果最强,说明AR-C17为小麦ARs 主要活性物质,该结论与前人和本课题组先前研究结果一致。本研究团队通过建立LPS诱导的RAW264.7巨噬细胞炎症模型,比较了5种单体抗炎效果,发现AR-C17具有最佳抗炎能力[15],其原因可能是,相比于其余同系物,AR-C17的烷基链长度最短,使得其具有更高的溶解性[35];同样,Fan等[36]也发现,AR-C17是小麦ARs神经保护作用中的主要活性物质。
3 结 论
本研究发现,浓度为5、10、20 μmol/L的小麦ARs可以有效改善炎症导致的脂肪细胞胰岛素抵抗,2-NBDG吸收率随ARs浓度增加而提高,证明小麦ARs具有一定的肥胖相关胰岛素抵抗改善作用,且AR-C17能够比其余4种同系物单体更有效地改善胰岛素抵抗性。脂肪细胞脂解分析结果表明,ARs能够显著改善炎症导致的脂肪细胞脂质分解;蛋白表达量结果表明,小麦ARs提高了p-Akt和GLUT4的蛋白表达水平,但是LY294002干扰ARs对脂肪细胞胰岛素抵抗性的改善作用。本研究表明,小麦ARs通过激活p-Akt/GLUT4信号通路,可以改善炎症导致的脂肪细胞脂质积累紊乱和胰岛素抵抗。希望本研究结果能够为全谷物食品健康功效的进一步研究提供理论参考。

