转运葡萄糖苷类化合物的Caco-2细胞模型建立
林佳丽,刘杨洁,韩富亮
(1.西北农林科技大学 葡萄酒学院/陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌 712100;2.西北农林科技大学 合阳葡萄试验示范站,陕西 合阳 715300)
Caco-2细胞来源于人结肠腺癌细胞,在体外培养可形成致密单细胞层,其结构和功能与人体小肠上皮细胞组织相似,具有微绒毛结构,可分化多种人体肠细胞具有的酶和转运蛋白,如葡萄糖苷酶、外排蛋白BCRP、P-gp、MRP2等[1]。多年来,Caco-2细胞已被广泛应用于药物或食品营养成分在肠道的消化吸收、转运代谢及其机制的研究[2],包括化合物消化水解、化合物的生物利用率及其结构与转运吸收的关系、化合物转运吸收的相互作用、化合物在上皮细胞的甲基化、葡萄糖醛酸化和磺酸化[3]等代谢转化、化合物的主动吸收和被动吸收等。此外,也可用于研究化合物对肠道健康的作用,包括对肠道细胞屏障功能、细胞炎症的影响等[4]。
糖苷类化合物,如花色苷、白藜芦醇糖苷、柚皮苷等,由糖苷配体与葡萄糖或其他单糖组成,是广泛存在于水果、蔬菜或食品中的化合物。这些化合物的吸收可能涉及主动吸收,即通过转运载体进行转运吸收。小肠上皮细胞可表达己糖转运蛋白[5],包括钠依赖性葡萄糖转运蛋白1(sodium glucose co-transporter 1,SGLT1)和葡萄糖转运蛋白2(glucose transporter 2,GLUT2)。他们将葡萄糖从肠腔侧吸收转运进入细胞[6]。糖苷类化合物由于含有1个或2个以上的单糖,其吸收可能与己糖转运载体有关。
Caco-2细胞单层的功能特性与细胞的来源、培养代数、培养条件等因素密切相关。培养基、细胞接种密度、培养时间等影响细胞的生长和分化[7],包括细胞形态、紧密连接、蛋白表达等[8]。通常,研究化合物在Caco-2细胞单层的吸收转运需要培养21天左右,以使细胞单层分化成熟并形成致密单层[1]。但是,在采用Caco-2细胞模型研究食品组分化合物的吸收转运时,很少有研究对细胞模型进行比较全面的考察,特别是糖苷类化合物的吸收转运。本研究通过对Caco-2细胞最适培养基的选择、单层致密性的测定、单层通透性的测定、单层亚显微结构的观察、细胞两侧碱性磷酸酶活性比、细胞葡萄糖转运蛋白SGLT1和GLUT2的mRNA及蛋白表达水平的分析,考察Caco-2细胞形态和功能完整性,为糖苷类化合物在肠道的转运吸收及机制等研究提供方法学基础。
1 材料与方法
1.1 材料与试剂
Caco-2人结直肠腺癌细胞,上海富衡生物公司;RPMI 1640培养基、DMEM低糖培养基,美国Gibco公司;胎牛血清,美国Gemini公司;GlutaMAX-I 添加剂、Hank’s平衡盐溶液、Penicillin-Streptomycin溶液(PS),北京Solarbio公司;苯酚红,分析纯,天津科密欧化学试剂有限公司;质量分数为0.25%的胰蛋白酶-EDTA消化液、非必需氨基酸(L-谷氨酸、L-天冬氨酸、L-天冬酰胺、L-脯氨酸、L-丝氨酸、丙氨酸、甘氨酸),Thermo Fisher公司;碱性磷酸酶试剂盒,南京建成生物工程研究所;磷酸盐缓冲液(phosphate buffer saline,PBS)(pH 值7.2~7.4),BI生物公司;质量分数1%的锇酸,美国Tedpella公司;醋酸铀,美国SPI公司;柠檬酸铅,阿法埃莎(中国)化学有限公司;白胶,美国EMS公司;PVDF膜(0.45 μm),美国Millipore公司;兔源SGLT1、GLUT2和内参GAPDH(glyceraldehyde-3-phosphate dehydrogenase)一抗,北京Bioss公司;山羊抗兔二抗,江苏康为世纪公司;Transwell细胞小室(12孔,0.4 μm,1.12 cm2),美国Corning公司。
由西安昊兴生物科技有限公司设计引物序列,由北京奥科鼎盛生物科技有限公司合成引物:
SGLT1:正向5′-CAGATGATGCGGGAGAAGAA-3′,反向5′-CGAAGATGCTCGTGGAGTAATA-3′;GLUT2:正向5′-ATGAACTGCCCACAATCTCATA-3′,反向5′-GGACCAGAGCATGGTGATTAG-3′;GAPDH:正向5′-CCTTCCTGGGCATGGAGTC-3′,反向5′-TGATCTTCATTGTGCTGGGTG-3′。
1.2 仪器与设备
311型二氧化碳培养箱,Thermo Fisher公司;IBE1000型倒置显微镜,重庆中显光电仪器有限公司;Millicell ERS-2型电阻仪,美国Millipore公司;Cary 60型紫外可见分光光度计,美国Agilent公司;LC-20AT高效液相色谱仪,日本岛津公司;Nano SEM-450型场发射扫描电子显微镜、TECNAI G2 SPIRIT BIO T12型透射电子显微镜,美国FEI公司;CFX96型实时荧光定量PCR(quantitative real-time polymerase chain reaction,qPCR)仪、170-4481型电泳仪、Tanon4200型成像系统,美国Bio-Rad公司。
1.3 实验方法
1.3.1Caco-2细胞培养与接种
参照Han等[5]方法,在37 ℃培养箱中,保持体积分数为5%的CO2及90%湿度培养细胞。以6×104个/cm2每孔0.5 mL接种细胞至12孔Transwell培养板上室,培养板下室添加1.5 mL培养基。
1.3.2Caco-2细胞最适培养基的选择
选择生长状态良好的同代Caco-2细胞接板培养,使用血球计数板记录细胞数量,分别比较体积分数为10%、15%、20%血清的DMEM低糖培养基和RPMI1640培养基对细胞生长的影响。
1.3.3Caco-2细胞吸收模型的评估
1.3.3.1 Caco-2细胞单层致密性测定
细胞单层跨膜电阻(transepithelial electrical resistance,TEER)值可以作为Caco-2细胞单层致密性的评估参数。TEER采用电阻仪测定,TEER计算见式(1)。
TEER=(TEER测定孔-TEER空白孔)×S0。
(1)
式(1)中,TEER值,Ω·cm2;S0为Transwell小室单孔膜面积(1.12 cm2)。
1.3.3.2 Caco-2细胞单层通透性测定
苯酚红的透过性可以作为Caco-2细胞单层通透性的评估参数。Caco-2细胞培养至14、17、21 d时,Transwell上室添加苯酚红的Hank’s平衡盐溶液(苯酚红的质量浓度为10 mg·L-1)0.5 mL,下室添加无苯酚红的Hank’s平衡盐溶液1.5 mL,孵育4 h。于0.5、1.0、2.0、4.0 h从下室中取样0.15 mL。采用高效液相色谱(high performance liquid chromatography,HPLC)检测苯酚红含量。根据式(2)计算苯酚红的表观渗透系数(apparent permeability coefficient,Papp)。
(2)
式(2)中,Papp,cm·s-1;dQ/dt为单位时间苯酚红转运量,mg·L-1·s-1;C0为其初始浓度,mg·L-1;S0为Transwell小室单孔膜面积(1.12 cm2)。
1.3.3.3 场发射扫描电子显微镜分析
Caco-2细胞培养至7、14、17、21 d时,固定细胞单层,使用不同浓度的乙醇将样品梯度脱水,临界干燥,粘台喷金,观察细胞表面微绒毛。
1.3.3.4 透射电子显微镜分析
随机取培养至14、17、21 d生长良好的Transwell小室固定细胞单层4 h以上,再用质量分数为1%的锇酸固定样品2 h。PBS漂洗,乙醇梯度脱水,白胶梯度渗透,包埋固化切片后,先后使用醋酸铀和柠檬酸铅染色,观察细胞形态。
1.3.3.5 Caco-2细胞的碱性磷酸酶活性测定
细胞单层碱性磷酸酶活性(alkaline phosphatase,AKP)两侧比值[(apical side)/(basolateral side),AP/BL]中可判断细胞的分化水平。细胞培养至7、14、17、21 d时,采用分光光度计仪检测OD值,计算细胞单层两侧碱性磷酸酶活性,公式见式(3)。
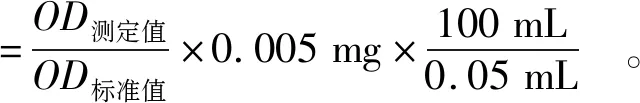
(3)
式(3)中,AKP活力单位是金氏单位/100 mL;OD测定值和OD标准值均为在520 nm处测定的吸光度值。
1.3.3.6 qPCR测定葡萄糖转运蛋白SGLT1和GLUT2的mRNA表达
参考Huang等[9]方法并稍做修改,提取细胞中的RNA,检测浓度与纯度,调整至终浓度200 mg·L-1。反转录后,采用两步法程序对反转录产物进行PCR扩增,用2-ΔΔCT法分析检测结果。以内参基因GAPDH为对照。
1.3.3.7 蛋白质印迹法测定葡萄糖转运蛋白SGLT1和GLUT2表达
蛋白质印迹法(Western blot)的测定参考Wong等[10]方法并稍做修改。细胞裂解后采用BCA法测定蛋白浓度,与蛋白上样缓冲液混合后进行SDS-PAGE电泳。凝胶中的蛋白质湿转到PVDF膜,分别与兔源SGLT1、GLUT2和GAPDH一抗孵育、再与HRP标记的山羊抗兔二抗孵育,杂交完成后使用HRP-ECL发光法对其鉴定,化学发光成像仪分析。以内参蛋白GAPDH为对照。
1.4 数据处理
采用Duncan法对实验数据进行方差分析(P<0.05)(软件SPSS 21.0),软件Origin绘制各类直方图与折线图。
2 结果与分析
2.1 培养基对Caco- 2细胞的影响
考察两种培养基(DMEM低糖培养基和RPMI1640培养基)和3种血清体积分数(10%、15%、20%)对细胞生长的影响,结果见图1。由图1可知,在3种血清体积分数下,使用DMEM低糖培养基培养的细胞从刚接板至铺满孔的细胞量均高于RPMI1640培养基。在同一血清体积分数下培养细胞时,DMEM低糖培养基的增速显著高于RPMI1640培养基,其中图1(b)显示使用体积分数15%血清的两种培养基培养细胞的快速增殖点出现显著差异,而其余体积分数下的两种培养基中,细胞的生长趋势无显著差异。Caco-2细胞在DMEM低糖培养基中生长速度更快,与DMEM低糖培养基所含营养物质比较适合贴壁细胞的生长有关[5]。

图1 相同血清浓度不同培养基细胞生长情况Fig.1 Growth condition of cells in different media with same serum concentration
同种培养基下不同血清浓度对细胞影响的结果见图2。由图2可知,细胞前3 d在RPMI1640培养基生长比较稳定,从第4天开始进入快速增殖期,而使用DMEM低糖培养基培养细胞时,15%和20%体积分数血清的培养基从第3天开始进入快速增殖,10%的则从第4天开始生长迅速。比较两种培养基在不同体积分数血清下细胞的增殖速度可以看出,体积分数15%血清的培养基培养的细胞生长最快,20%的次之,10%的最慢。血清中含有多种因子促进细胞贴附,但是血清浓度过高不利于细胞生长[11]。因此,本研究选择Caco-2的最适培养基为添加体积分数为15%血清的DMEM低糖培养基。

图2 不同血清浓度下细胞生长情况Fig.2 Growth condition of cells in media with different serum concentration
2.2 Caco- 2细胞单层致密性评估
TEER测量是使用两个电极连接肠腔侧与基底外侧,施加恒定的直流电,应用欧姆定律测量跨膜电阻[12]。对培养21 d的Caco-2细胞单层跨膜电阻值进行测定,见图3。显微镜观察,细胞在接种后10 d左右铺满小室,TEER约为250 Ω·cm2,随后细胞开始迅速增殖,TEER相应增大,从第14天开始趋于稳定,数值在1 300~1 500 Ω·cm2之间,表明连续培养14 d以上的细胞单层具有良好的致密性。文献报道,Caco-2细胞单层的TEER约为200~1 000 Ω·cm2[13],细胞单层TEER会在后期传代中升高[7,14]。TEER是细胞间离子流动产生,受细胞自身形态及膜面积影响较大。单层膜出现缺口、破裂,电阻值会突降。因此,仅将TEER作为细胞致密性的参考。
2.3 Caco- 2细胞单层通透性分析
苯酚红在Caco-2单层的表观渗透系数可以表征细胞单层的通透性[7]。不同时期Caco-2细胞单层中苯酚红的表观渗透系数见表1,与空白组相比,14、17、21 d细胞的表观渗透系数均小于1×10-6cm·s-1(表1),并且各组间无显著差异,这与其他研究采用荧光黄评价细胞单层通透性一致(0.26×10-6~0.69×10-6cm·s-1)[15]。图4为转运时间对Caco-2细胞单层苯酚红的转运透过量和转运率的影响。14、17、21 d的细胞对苯酚红的透过量基本稳定,分别为0.79%、0.83%、0.84%[图4(a)],转运率均不超过1%[图4(b)],与空白孔的3.88%呈现显著差异(P<0.05)。有研究报道对14~16 d的Caco-2细胞模型进行通透性实验,结果与此类似[16-17]。因此,培养14 d以上的Caco-2细胞单层已具有良好的致密性。

表1 不同时期Caco-2细胞单层中苯酚红的表观渗透系数Tab.1 Apparent permeability coefficient of phenol red in Caco-2 cell monolayer at different periods

图4 转运时间对Caco-2细胞单层苯酚红透过量和转运率的影响Fig.4 Effect of transport time on permeability and transport rate of phenol red in Caco-2 cell monolayer
2.4 Caco- 2细胞单层亚显微结构观察结果
2.4.1场发射扫描电子显微镜观察结果
使用场发射扫描电子显微镜观察Caco-2细胞表面绒毛,扫描电镜图见图5。图5显示了具有肠细胞特征的分化Caco-2细胞,可以发现,细胞在培养第7 d时已经分化出稀疏的微绒毛,随着培养时间延长,绒毛增长且密度增加。放大至6万倍显示,微绒毛的长度在300~900 nm,7 d的密度约为2~20根/μm2[图5(e)],14 d的密度约为60~180根/μm2,17 d的密度约为80~200根/μm2[图5(f)],图5(f)方框内为2根完整的微绒毛。微绒毛上含有多种蛋白,微绒毛密度增大可以增加肠细胞的吸收面积,从而影响营养成分的吸收[18-19]。图5表明培养的Caco-2细胞在第17 d时已大量分化微绒毛且分布均匀,与文献报道培养21 d的细胞形态一致[20]。因此,从形态学上来看,培养14~17 d的Caco-2细胞适于用来研究营养物质的吸收转运。

图5 Caco-2细胞表面绒毛扫描电镜Fig.5 Scanning electron microscopy of microvilli on Caco-2 cell surface
2.4.2透射电子显微镜观察结果
使用透射电子显微镜观察Caco-2细胞纵切面,透射电镜图见图6。采用消化收集细胞进行切片不利于观察细胞表面结构[21],本研究采用细胞原位固定方式,直接将细胞连同Transwell膜切割制片,以在电镜下观察细胞培养过程中的形态,见图6。透射电镜观察不同时期Caco-2细胞的纵切结构,箭头所指为细胞分化的微绒毛,图6(d)方框内为完整的3根微绒毛。由图6可知,连续培养14 d后,Caco-2细胞肠腔侧分化出微绒毛,而基底侧无分化,表明培养过程中细胞两侧逐渐极化,并且可以看到Caco-2细胞融合成连续完整的细胞单层,细胞表面有连续的微绒毛,细胞间隙消失[图6(b)],微绒毛长度增加[图6(d)]。有研究表明:微绒毛分化的长度及密度都会影响细胞蛋白表达[19]。因此,培养14~17 d的Caco-2适宜于作为细胞模型用来研究营养物质的吸收,这和扫描电镜的观察结果一致,比文献报道的21 d提早4~7 d[16]。

图6 Caco-2细胞单层透射电镜Fig.6 Transmission electron microscopy of Caco-2 cell monolayer
2.5 Caco- 2细胞的碱性磷酸酶活性
碱性磷酸酶位于微绒毛上,基底侧无分化。在培养过程中,细胞肠腔侧逐渐分化出小肠吸收和消化的标志物-碱性磷酸酶,两侧碱性磷酸酶活性比值逐步升高,分布不对称,出现了极化现象[22]。不同培养时间Caco-2细胞单层两侧(AP/BL)碱性磷酸酶活性比见表2。Caco-2细胞两侧碱性磷酸酶活性比分析表明,培养7 d的细胞碱性磷酸酶活性比仅为1.33,未达到极性分化。文献表明:细胞在生长到完全铺满瓶壁时才开始单层分化[23]。在培养14 d时,细胞开始出现极性分化,但是显著小于17 d和21 d的比值,而17 d与21 d的活性比无显著差异(P<0.05)。这与文献报道培养15~21 d细胞两侧碱性磷酸酶活性变化趋于平稳相一致[22],因此,培养14~17 d的Caco-2细胞可以用来做吸收转运研究。

表2 Caco-2细胞单层两侧碱性磷酸酶活性比Tab.2 Activity ratio of alkaline phosphatase on both sides of Caco-2 cell monolayer
2.6 葡萄糖转运蛋白SGLT1和GLUT2的mRNA及蛋白表达水平分析
食物中含有很多糖苷类化合物,如花色苷,葡萄糖苷类化合物的主动吸收需要葡萄糖转运蛋白SGLT1和GLUT2的参与[3,5-6]。葡萄糖转运蛋白SGLT1和GLUT2的mRNA的相对表达量见图7。由图7可知:连续培养14 d及以上的细胞均能表达两种葡萄糖转运载体的mRNA,其中SGLT1在14 d的表达量较高,随着培养时间的延长,表达量显著降低,但是17 d和21 d之间无显著差异(P<0.05),而GLUT2在细胞中的表达量随着培养天数的增加会有少量升高,但差异不显著(P<0.05)。不同培养时间的Caco-2细胞转运蛋白表达水平见图8。由图8可知,以内参蛋白GAPDH为对照,葡萄糖转运载体蛋白SGLT1和GLUT2的相对表达量分析结果表明:随着培养时间的增加,SGLT1和GLUT2均能特异性表达,且相对表达量在14、17、21 d之间无显著差异(P<0.05)。两种糖转运载体的mRNA和蛋白质相对表达水平的差异可能是翻译和蛋白质降解等造成的[24]。通常,Caco-2细胞培养都是21 d,仅考察细胞单层的完整性或致密性来建立细胞模型,很少考察己糖转运载体的表达和微绒毛形态分化等指标[2,22]。本研究基于转运载体mRNA和蛋白表达量,证实Caco-2细胞培养14 d后即可用于葡萄糖苷类化合物的吸收转运研究。

同组不同字母表示差异显著(P<0.05)。图7 Caco-2细胞中SGLT1和GLUT2葡萄糖转运蛋白mRNA表达水平Fig.7 mRNA expression of SGLT1 and GLUT2 glucose transporter in Caco-2 cells
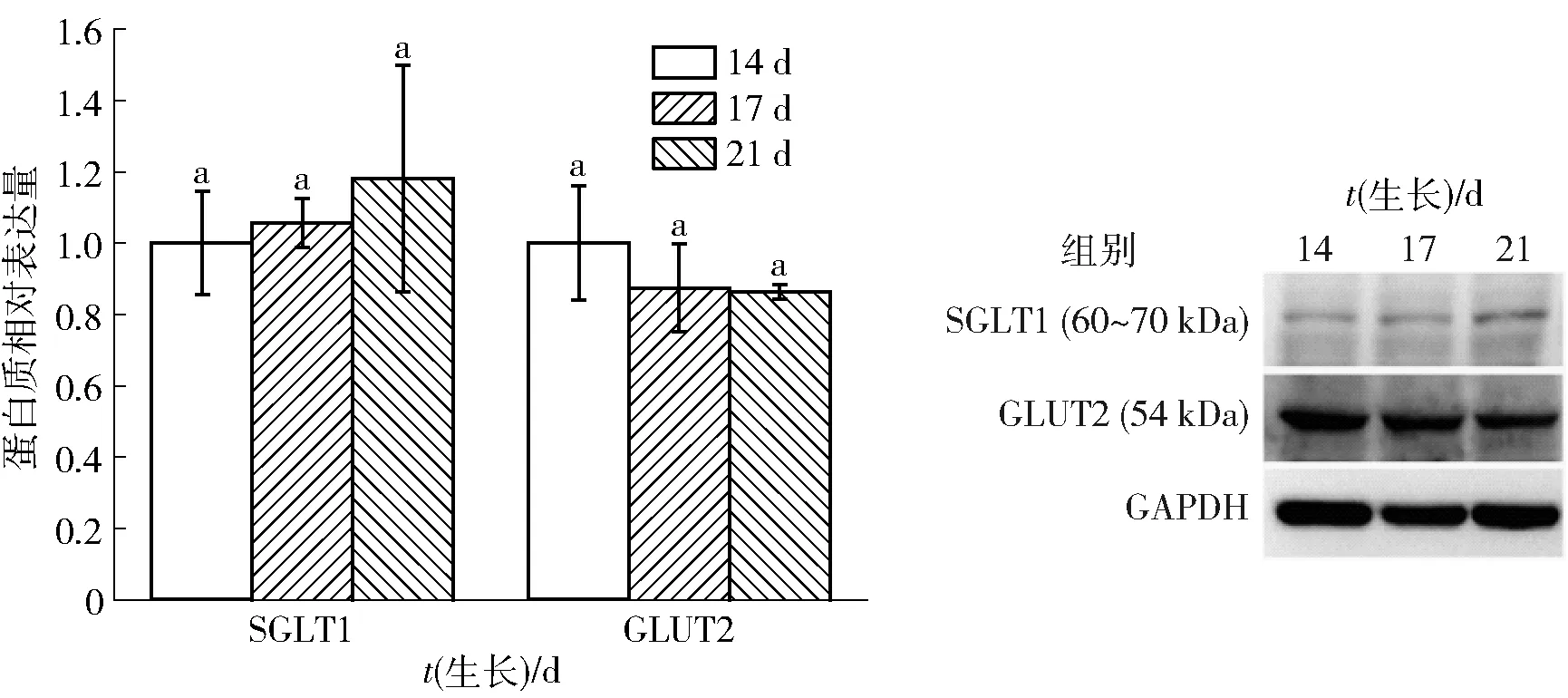
同组相同字母表示差异不显著(P<0.05)。图8 不同培养时间的Caco-2细胞转运蛋白表达水平Fig.8 Expression level of transporters in Caco-2 cells cultured for different days
3 结 论
细胞生长曲线结果表明,使用体积分数为15%血清的DMEM低糖培养基培养细胞效果最佳。在Transwell小室中连续培养14 d及以上的Caco-2细胞单层跨膜电阻值稳定,细胞旁路转运药物苯酚红表观渗透系数小于1×10-6cm·s-1,细胞单层具有明显极性,无细胞间隙,细胞表面连续、均匀分布微绒毛,己糖转运蛋白SGLT1和GLUT2 mRNA及其蛋白特异表达。因此,研究建立的14~17 d的Caco-2可用于葡萄糖和葡萄糖苷类化合物的转运吸收研究,与21 d相比提早4~7 d时间,缩短了培养周期,可保证细胞模型可靠性。

