重组人干扰素联合LEEP对宫颈上皮内瘤变患者P16、P63、Ki-67表达及炎性因子的影响
赵晶蕾,韦广月,刘艳洁
宫颈上皮内瘤变是宫颈癌的癌前病变,若未及时规范治疗,可进展为宫颈癌[1]。随着临床研究的深入,发现宫颈上皮内瘤变患者不仅存在炎症反应,而且P16、P63、Ki-67在宫颈病变过程中可作用于细胞周期,参与细胞的增殖、分裂及肿瘤生成过程[2-3]。有研究表明,P16、P63、Ki-67在反映宫颈上皮内瘤变诊断分级中具有重要意义[4-5]。宫颈环形电切术(LEEP)具有创伤小、切缘清晰、操作简单等优点,在宫颈上皮内瘤变的治疗中应用较广[6]。干扰素由病毒刺激宿主细胞分泌产生,具有抑制细胞增殖、抗病毒谱广等作用[7]。目前国内学者已证实,重组人干扰素联合LEEP对宫颈上皮内瘤变患者免疫功能、阴道微生态、炎症反应等方面具有较好的改善作用[8-10]。但是,联合治疗对宫颈上皮内瘤变患者P16、P67、Ki-67表达的影响报道较少。本研究采用重组人干扰素联合LEEP治疗宫颈上皮内瘤变,并对治疗后P16、P67、Ki-67表达情况进行分析,有关结果报告如下。
1 资料与方法
1.1一般资料 选取2019年7月—2020年6月我院收治的宫颈上皮内瘤变108例为研究对象。根据治疗方法不同将患者分为观察组和对照组,每组54例。观察组年龄32~64(42.28±9.51)岁;分级:Ⅰ级23例,Ⅱ级31例;病程3~36(16.70±2.39)个月。对照组年龄32~65(41.93±9.26)岁;分级:Ⅰ级24例,Ⅱ级30例;病程3~36(16.57±2.48)个月。两组年龄、分级、病程等一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医学伦理委员会批准同意。
1.2纳入与排除标准
1.2.1纳入标准: ①经活组织病理检查、液基薄层细胞检查确诊为宫颈上皮内瘤变;②分级为Ⅰ、Ⅱ级;③具有LEEP的手术指征;④入组前14 d未使用过抗生素、糖皮质激素等可能影响研究结果的药物;⑤患者对本研究知情,且签署知情同意书。
1.2.2排除标准:①合并淋病、滴虫、支原体感染等疾病者;②确诊为恶性瘤变或子宫上皮内瘤变者;③过敏体质或对本研究药物过敏者;④合并急性生殖道炎症者;⑤妊娠或哺乳期患者;⑥合并其他重要脏器严重疾病者。
1.3治疗方法 两组均采用美国Wallach公司生产的QUANTUMA 2000型LEEP刀进行治疗,功率50 W。患者取膀胱截石位,局部麻醉后标记宫颈表面移行区范围,暴露病变位置;选择合适的环形刀电极型号,通过宫颈环切入电圈,并环绕1周;根据电圈和碘示区范围,控制切入深度,切除组织送病理检查。观察组在LEEP治疗基础上,给予重组人干扰素α-2b凝胶[兆科药业(合肥)有限公司,国药准字S20010054]治疗,将重组人干扰素α-2b凝胶100万U置于患者阴道后穹隆部,用纱布填塞6 h左右取出纱布。每天1次,连续10 d。
1.4观察指标
1.4.1P16、P63和Ki-67表达情况:治疗前取手术切除组织标本,治疗30 d后在原病灶点取微量组织标本。标本常规固定、脱水、包埋。3 μm连续切片,HE染色。LEICA BOND MAX全自动免疫组织化学染色机测定,相关抗体由福州迈新生物技术开发有限公司提供。阴性对照染色使用PBS。阳性判断标准:采用光学显微镜观察显色反应,细胞核内(P16还需观察细胞质)见棕黄色颗粒为阳性细胞,阳性细胞占比≥10%为阳性[11]。
1.4.2炎性因子检测:治疗前、治疗30 d后于清晨空腹状态抽取患者静脉血5 ml,离心取血清冷冻待测。采用酶联免疫吸附试验测定白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)和C反应蛋白(CRP)水平,试剂盒由武汉艾迪抗生物科技有限公司提供,操作严格按照说明书进行。
1.4.3免疫功能检测:治疗前、治疗30 d后于清晨空腹状态抽取患者静脉血5 ml,采用流式细胞术测定CD3+、CD4+、CD8+,试剂盒购自军事医学科学院,操作严格按照说明书进行。
1.4.4疗效观察:治疗30 d后,评定患者疗效,①显效:阴道镜及宫颈液基薄层细胞检查未见宫颈上皮内瘤变,宫颈光滑;②有效:阴道镜及宫颈液基薄层细胞检查示病变级别降低,病变范围缩小>50%;③无效:阴道镜及宫颈液基薄层细胞检查示病变级别未降低,或病变范围缩小<50%,甚至扩大[12]。总有效率=(显效+有效)例数/总例数×100%。
1.4.5不良反应观察:记录两组治疗期间感染、出血、宫颈粘连等不良反应发生情况。

2 结果
2.1治疗前后P16、P63、Ki-67阳性率比较 治疗前,两组P16、P63和Ki-67阳性率比较差异均无统计学意义(P>0.05)。治疗后,两组P16、P63和Ki-67阳性率均较治疗前降低,且观察组低于对照组,差异有统计学意义(P<0.05,P<0.01)。见表1。
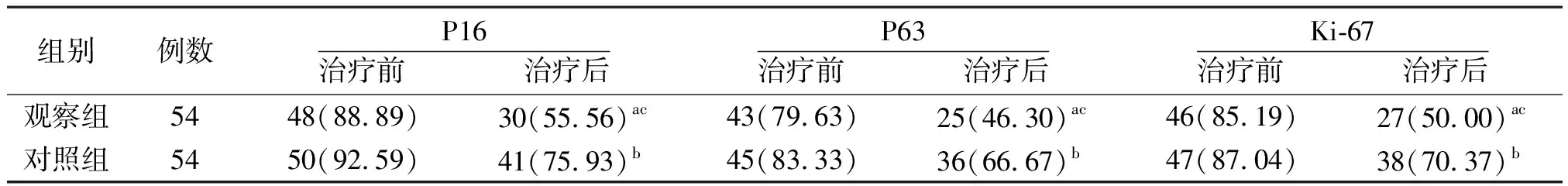
表1 采用不同方法治疗宫颈上皮内瘤变两组P16、P63、Ki-67阳性率比较[例(%)]
2.2治疗前后炎性因子比较 治疗前,两组IL-10、TNF-α、CRP比较差异无统计学意义(P>0.05)。治疗后,两组IL-10高于治疗前,TNF-α、CRP均低于治疗前,且观察组IL-10高于对照组,TNF-α、CRP均低于对照组,差异有统计学意义(P<0.05,P<0.01)。见表2。
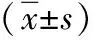
表2 采用不同方法治疗宫颈上皮内瘤变两组治疗前后炎性因子比较
2.3治疗前后免疫功能比较 治疗前,两组CD3+、CD4+、CD8+比较差异无统计学意义(P>0.05)。治疗后,两组CD3+、CD4+高于治疗前,CD8+低于治疗前,且观察组CD3+、CD4+高于对照组,CD8+低于对照组,差异有统计学意义(P<0.05,P<0.01)。见表3。
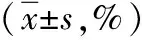
表3 采用不同方法治疗宫颈上皮内瘤变两组治疗前后免疫功能比较
2.4治疗效果比较 观察组总有效率高于对照组,差异有统计学意义(P<0.05)。见表4。

表4 采用不同方法治疗宫颈上皮内瘤变两组治疗效果比较[例(%)]
2.5不良反应发生情况 治疗期间,观察组出现感染、出血、宫颈粘连各1例,不良反应发生率为5.56%。对照组出现感染2例、出血1例、宫颈粘连2例,不良反应发生率9.26%。两组不良反应发生率比较差异无统计学意义(P>0.05)。
3 讨论
宫颈上皮内瘤变对女性健康和生命安全有极大威胁。相关临床研究表明,宫颈上皮内瘤变患者多存在免疫功能恶化、阴道微生态破坏及炎症反应加重等情况[13-15]。在“细胞学-阴道镜-组织病理”三阶段筛查推广下,检测P16、P63和Ki-67阳性表达情况有助于提高宫颈上皮内瘤变的诊断准确率[16]。P16是一种抑癌基因,参与细胞周期调控,可以抑制细胞周期依赖性蛋白激酶4活性,阻止细胞进入S期。P63是P53基因家族成员,参与肿瘤发生、发展及细胞凋亡过程。Ki-67存在于除G0期以外的细胞周期所有阶段,被认为是一种可靠的核增殖标志物。目前多项研究表明,宫颈上皮内瘤变患者P16、P63和Ki-67均存在较高的阳性表达,且病情越严重,阳性表达率越高[17-19]。因此,P16、P63和Ki-67能作为宫颈上皮内瘤变早期诊断的重要参考指标。LEEP通过超高频低电压技术,传导高频低电压电波产生瞬时高压,从而达到切除病变组织的目的,该手术具有微创、切除范围大、止血效果好等优点,逐步取代电凝、激光、冷冻等治疗手段,在宫颈上皮内瘤变的治疗中得到了广泛应用[20-22]。但是患者术后切口愈合时间较长,而且容易引发阴道出血、创面感染等风险。重组人干扰素可与干扰素受体特异性结合,阻止病毒蛋白质合成,抑制感染。此外,重组人干扰素还具有免疫功能和性激素分泌调节作用,促进机体免疫自稳功能恢复和创面愈合[23]。
从本研究结果来看,观察组总有效率高于对照组。该结果验证了重组人干扰素联合LEEP治疗宫颈上皮内瘤变具有更好的临床效果,结论与秦燕萍等[8]、马小磊等[24]学者的报道相一致。炎症反应被认为是宫颈上皮内瘤变的致病机制之一。本研究发现,治疗后,两组IL-10高于治疗前,TNF-α、CRP均低于治疗前,且观察组IL-10高于对照组,TNF-α、CRP低于对照组。该结果也证实重组人干扰素联合LEEP有助于进一步减轻宫颈上皮内瘤变患者体内的炎症反应。赵秀梅等[10]学者认为,联合治疗可以更好地诱导细胞表皮组织相容复合物抗原表达,改善机体免疫功能,并提高患者抗病毒能力,降低病毒感染风险,从而降低了炎症反应。在人体内CD8+起抑制作用,CD4+起促进作用,通过CD4+、CD8+的动态变化,从而实现机体免疫平衡。本研究还发现,治疗后,两组CD3+、CD4+高于治疗前,CD8+低于治疗前,且观察组CD3+、CD4+高于对照组,CD8+低于对照组。该结果表明重组人干扰素联合LEEP治疗有助于改善宫颈上皮内瘤变患者免疫功能。此外,两组治疗后P16、P63和Ki-67阳性率均显著低于治疗前,且观察组低于对照组。该结果提示P16、P63和Ki-67不仅可以作为诊断宫颈上皮内瘤变的参考指标,而且可以作为预后判断的参考指标。另外,上述结果还表明重组人干扰素联合LEEP能够改善宫颈上皮内瘤变患者免疫功能、阴道微生态,减轻炎症反应,同时抑制P16、P63和Ki-67阳性表达,在细胞层面调控病变进程。从不良反应来看,两组不良反应发生率比较差异无统计学意义,肯定了联合治疗方案的安全性。
综上所述,在LEEP基础上,联合重组人干扰素治疗宫颈上皮内瘤变,能够更好地抑制P16、P63和Ki-67阳性表达,减轻炎症反应,改善免疫功能,提高治疗有效率,而且具有较高的安全性。

