白头翁总皂苷调控CXCR4/CXCL12信号通路抑制小鼠结肠癌肝转移的机制研究
马 漪,文 静
(湖南中医药大学第一附属医院肿瘤科,长沙 410000)
结直肠癌(colorectal cancer,CRC)是临床常见的消化道肿瘤,其发病率居于恶性肿瘤的第3 位,死亡率仅次于肺癌、肝癌和胃癌,位居第4 位[1]。随着城市化进程的加快,其患病率也逐年攀升。CRC 早期症状通常不明显,约有30%的患者在确诊时已出现肝转移,其中约65%的患者在完全切除肝转移灶后5 年内复发[2]。因此,预防和抑制CRC 肝转移的形成对患者生存率的提高至关重要。近年研究显示[3],趋化因子受体4(CXCR4)及其天然配体CXCL12 的相互作用在肿瘤的远处转移过程中起到重要作用,通过应用CXCR4 拮抗剂可抑制CRC 细胞的增殖和迁移,提示阻断CXCR4/CXCL12 信号通路的转导能够抑制CRC 细胞侵袭转移。白头翁总皂苷为清热解毒中药白头翁的主要有效成分,具有抑制炎症反应、抗菌、抗肿瘤等多种药理学作用[4]。研究[5-6]表明,其在体外对人CRC 细胞表现出良好的抑制作用。本研究通过脾脏注射CT26 细胞建立小鼠结肠癌肝转移模型,观察不同剂量白头翁总皂苷对小鼠肝转移的抑制作用,并围绕CXCR4/CXCL12 通路探讨其发挥作用的潜在机制,为中医药防治CRC 肝转移提供理论依据。
1 材料与方法
1.1 细胞与动物 小鼠结肠腺癌细胞 CT26 细胞株购自上海中科院细胞库;BALB/c雄性小鼠 50 只,SPF级,体质量 18~22 g,饲养于清洁级实验动物房中,温度为(22 ± 2)℃,照明时间12 h/d。
1.2 实验药物及试剂 白头翁总皂苷购自上海一基实业有限公司,纯度为98%;希罗达(500 mg/片)购自上海罗氏制药有限公司;RPMI-1640 培养基、胎牛血清购自Hyclone 公司;小鼠白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)ELISA 试剂盒购自碧云天生物技术有限公司;VEGF、CD31+抗体试剂盒购自武汉博士德公司;抗CXCR4、CXCL12、MMP-9、MMP-2 和β-actin 抗体购自Santa Crutz 公司。
1.3 实验仪器 CO2细胞培养箱、超净工作台为日本SANYO 产品,光学倒置显微镜为德国Olympus 产品,石蜡包埋机、组织切片机为德国 Leica 产品,低温高速离心机、酶标仪为美国 Thermo 产品、电泳仪为美国Bio-rad 公司产品。
1.4 模型建立及给药 将BALB/c 小鼠随机分为5 组:假手术组、模型组、阳性对照组、白头翁总皂苷低剂量组、白头翁总皂苷高剂量组,每组 10 只。除假手术组外,其余各组小鼠采用脾脏注射法建立小鼠CRC 肝转移模型:小鼠结肠癌CT26 细胞于含有10%胎牛血清的RPMI-1640 培养基中培养,待细胞生长至对数期时消化离心,调整为密度 2×106/mL 的PBS 细胞悬液备用;小鼠腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉后取仰卧位固定,常规消毒后开腹,暴露脾脏,取0.2 mL 细胞悬液缓慢推注于脾下极,轻按针眼止血后缝合切口。术后7 d左右小鼠肝脏可触及米粒大小结节,视为造模成功,假手术组仅行开腹处理。造模后第2 d,白头翁总皂苷低、高剂量组分别予不同剂量(100、200 mg/kg)灌胃给药,阳性对照组给予希罗达(267 mg/kg)灌胃治疗,每日1 次,持续治疗3 周。假手术组和模型组予等体积生理盐水灌胃。
1.5 标本处理 治疗结束后各组小鼠眼球取血1 mL,3 000 r/min 离心后分离血清,于-20 ℃ 冰箱保存备用;处死并解剖小鼠,取部分肝脏组织于4%多聚甲醛溶液中固定,取脾脏原发瘤组织于-80 ℃ 冰箱冻存备用。
2 观察指标
2.1 小鼠肝转移程度观察 治疗结束后处死各组小鼠,解剖后观察肝脏转移情况,测量肝脏、脾脏重量,将肝脏转移瘤组织切下并称重,计算抑瘤率:肿瘤质量抑制率(%)=(1-治疗组平均瘤重/对照组平均瘤重)× 100%。
2.2 ELISA 实验检测血清IL-6、TNF-α 水平 采用ELISA 法检测小鼠血清中IL-6、TNF-α 炎症因子水平:血清于-20 ℃冰箱取出后室温静置1 h,3 000 r/min 离心15 min。加入血清样品10 μL、样品稀释液40 μL 及检测抗体 100 μL,于37 ℃恒温箱中孵育1 h,弃去孔内液体,洗涤液洗板6 次后,各孔加入显色液显色,于37 ℃恒温箱中避光孵育15 min,加入终止液50 μL后于酶标仪450 nm 下检测OD 值,作标准曲线,代入各样本OD 值得出IL-6、TNF-α 水平。
2.3 免疫组化检测肝组织中VEGF、CD31 的阳性表达 小鼠肝组织标本于多聚甲醛溶液中固定24 h 后,经梯度乙醇脱水,二甲苯透明,石蜡包埋,作 5 μm石蜡切片。切片经脱蜡、透明、脱水后,30%过氧化氢孵育20 min 以消除内源性过氧化物酶,抗原热修复,BSA 封闭20 min 后,孵育VEGF、CD31 一抗于4 ℃冰箱过夜,PBS 冲洗后滴加二抗,37 ℃恒温箱中孵育20 min,滴加SABC,37 ℃孵育20 min,滴加DAB 显色后中性树胶封片,光学显微镜下观察拍照,用Image-Pro 6.0 软件随机选取5 个视野测定光密度值(IOD)。
2.4 脾脏瘤组织中CXCR4、CXCL12、MMP-9、MMP-2 蛋白表达检测 取小鼠部分瘤组织,于冰上匀浆后加入RIPA 裂解液,提取瘤组织总蛋白,采用BCA 法检测样品蛋白浓度。加入10 μL 蛋白样品,电泳系统中分离,转膜,室温封闭2 h,加入一抗(1:1 000)4 ℃孵育过夜,二抗(1:5 000)室温孵育2 h,显色剂显影,凝胶成像后采用Image J 软件分析结果。
2.5 脾脏瘤组织中CXCR4、CXCL12、MMP-9、MMP-2 mRNA 表达检测 取各组小鼠瘤组织50 mg,Trizol 法提取组织总RNA,紫外分光光度仪测定总RNA 浓度并逆转录为cDNA,再进行PCR 扩增,以β-actin 作为内参。反应条件为:95 ℃预变性5 min,1个循环,95 ℃ 变性5 s,60 ℃退火30 s,扩增40 个循环,72 ℃延伸7 min,56 ℃ 30 s,以2-△△Ct法分析相对mRNA 表达量。各基因引物序列见表 1。

表1 各基因引物序列
2.6 统计学方法 采用 SPSS 20.0 软件进行分析,数据以均值±标准差()表示,2 组以上数据采用单因素方差分析比较。
3 结果
3.1 小鼠肝转移情况比较 见表2。
表2 小鼠肝脾质量和抑瘤率( )
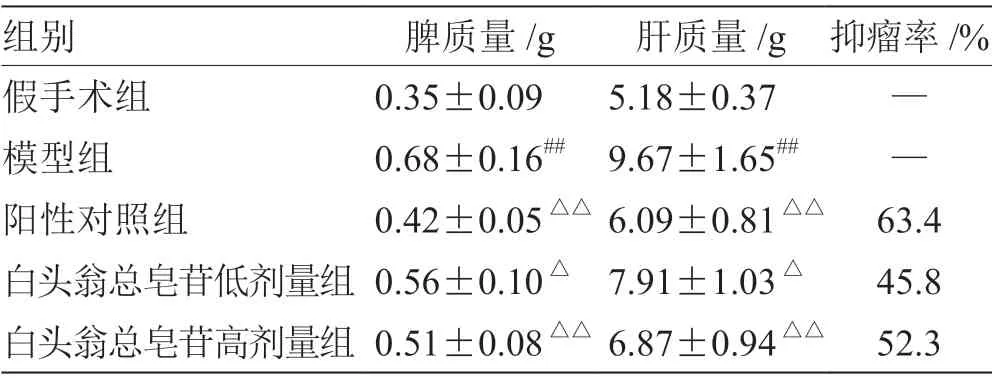
表2 小鼠肝脾质量和抑瘤率( )
注:与假手术组比较,# P <0.05,## P <0.01;与模型组比较,△P <0.05,△△P <0.01
3.2 小鼠血清中IL-6、TNF-α 的水平比较 见表3。
表3 小鼠血清中IL-6、TNF-α 的水平( )

表3 小鼠血清中IL-6、TNF-α 的水平( )
注:与假手术组比较,# P <0.05,## P <0.01;与模型组比较,△P <0.05,△△P <0.01
3.3 小鼠肝组织中VEGF、CD31 表达情况 免疫组化结果可见,模型组小鼠肝脏组织中VEGF 和CD31 的蛋白阳性表达与假手术组相比显著增多,光密度值明显上升(P<0.01)。小鼠给予希罗达和白头翁总皂苷不同剂量治疗后,肝组织中VEGF 和CD31 阳性表达均明显减少,光密度值较模型组明显降低(P<0.05,P<0.01)。见图 1~图3。

图1 小鼠肝组织中VEGF 的蛋白表达(IHC,×200)
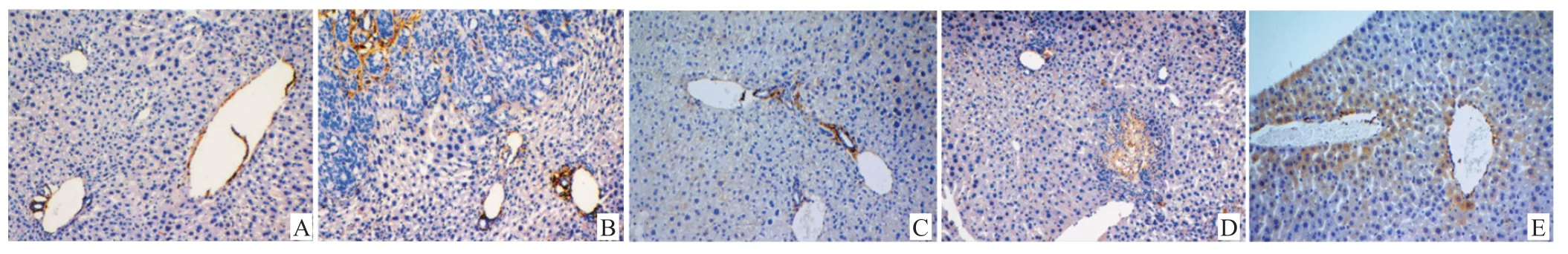
图2 小鼠肝组织中CD31 的蛋白表达(IHC,×200)
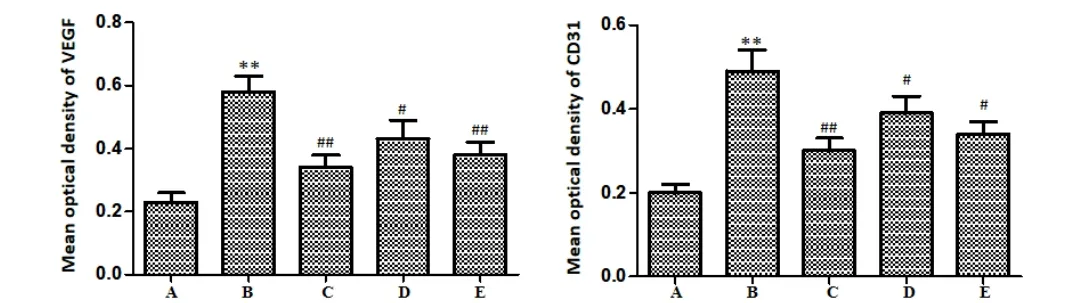
图3 小鼠肝组织VEGF、CD31 平均光密度值比较
3.4 小鼠脾脏瘤组织中的蛋白表达 模型组脾脏瘤组织中CXCR4、CXCR12、MMP-9、MMP-2 的蛋白表达水平较假手术组均显著升高(P<0.01)。阳性对照组、白头翁总皂苷低、高剂量组小鼠经治疗后,瘤组织中CXCR4、CXCR12、MMP-9、MMP-2 的蛋白表达较模型组均明显降低(P<0.05,P<0.01)。见图 4。

图4 小鼠脾脏瘤组织中CXCR4、CXCR12、MMP-9、MMP-2 的蛋白表达
3.5 小鼠脾脏瘤组织中CXCR4、CXCR12、MMP-9、MMP-2 的mRNA 表达 见表4。
表4 小鼠脾脏瘤组织中CXCR4、CXCR12、MMP-9、MMP-2 的mRNA 表达( )
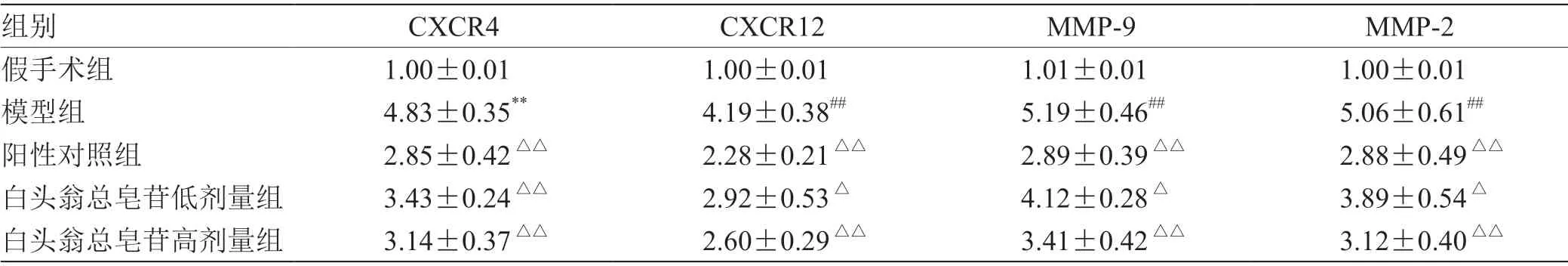
表4 小鼠脾脏瘤组织中CXCR4、CXCR12、MMP-9、MMP-2 的mRNA 表达( )
注:与假手术组比较,# P <0.05,## P <0.01;与模型组比较,△P <0.05,△△P <0.01
4 讨论
结直肠癌(colorectal cancer,CRC)是发生于结肠或直肠黏膜上皮的常见消化道恶性肿瘤,近年来随着人们生活及饮食习惯的改变,我国CRC 发病率和病死率逐年升高,已成为大中城市排名第1 位的消化道恶性肿瘤[7]。CRC 早期症状不明显,约有70% 的患者在就诊时已进入晚期,而在晚期确诊的患者5 年生存率仅为14%[8]。影响CRC 预后的主要因素为远处转移和复发,其中肝脏为CRC 转移的主要靶器官[9]。目前手术切除为CRC 肝转移唯一可行的治疗方法,但由于适应证和禁忌证的限制,只有10%~20%的患者能够接受手术治疗,而经手术治疗的患者约有65%在5 年内仍复发[2]。
白头翁性寒,味苦,入胃经、大肠经。具有清热燥湿、凉血止痢之功效,以白头翁为主要药味的白头翁汤在临床对溃疡性结肠炎等溃疡性病变具有明显疗效[10]。白头翁总皂苷是由白头翁中提取的主要活性成分,现代药理研究证明[11],其具有良好的抗炎、抗菌、抑制肿瘤等作用。罗颖颖等[5-6]研究表明,白头翁皂苷对人HT29 结肠癌细胞增殖表现出良好的抑制作用,同时能显著诱导细胞凋亡,在体内对肝癌H22 荷瘤小鼠亦具有较强的抑瘤作用。姜成等[12]同样发现白头翁皂苷能够剂量依赖地抑制HT29 细胞增殖,提示其作为抗肿瘤潜在药物值得进一步深入研究。
趋化因子是一类存在于靶细胞表面,能够调节细胞生长、迁移等各种活动的细胞因子,近年研究发现,趋化因子及其受体能够通过刺激肿瘤细胞增值、调节血管新生从而参与肿瘤的生长、浸润和转移过程[13]。趋化因子受体4(CXCR4)为CRC 细胞中表达最普遍的趋化因子受体,其高表达能够促进CRC 转移灶的生长,也与CRC 复发风险高、生存期差相关[14]。
趋化因子12(CXCR12)是CXCR4 的天然配体,CXCR4 为CXCR12 已知的唯一受体,二者所形成的生物轴系统在包括CRC、前列腺癌、肝细胞癌及神经母细胞瘤等多种恶性肿瘤的定向转移中发挥重要作用[15-16]。研究[17]表明,应用CXCR4 拮抗剂可抑制CXCL12 所诱导的肝癌细胞的迁移和侵袭,通过抗CXCR4 抗体阻断CXCR4 可抑制人CRC 细胞的黏附、增殖和迁移[3],提示阻断CXCR4 和CXCL12 间的相互作用能够抑制肿瘤细胞的侵袭和转移。基质金属蛋白酶家族(matrix metalloproteinases,MMPs)是一类高度保守的含锌蛋白水解酶,过量的MMP 能促进细胞外基质降解,破坏基底膜,进而导致恶性肿瘤的浸润和转移[18]。MMP-9 和MMP-2 是MMPs 家族的主要成员,其在健康组织和良性组织中表达较低,而在恶性肿瘤组织及转移瘤中有较高表达。MMP-9 和MMP-2的高表达常被作为恶性肿瘤侵袭转移的检测指标[19]。CXCR4 和CXCL12 的相互作用能够介导MMP-9 和MMP-2 的分泌,使细胞外基质降解加速,进而促使肿瘤发生转移。此外,CXCR4 与MMP-9 间可能存在协同作用,二者在 CRC 中的表达具有正相关关系,联合检测可作为判断CRC 淋巴结及远处转移的重要指标[20]。
门静脉转移为CRC 肝转移的主要途径,通过脾内注射CRC 细胞的方式能够模拟肿瘤细胞进入肝脏发生转移的过程[21]。本研究采用脾脏注射CT26 细胞制备小鼠CRC 肝转移模型,通过观察小鼠肝脏、脾脏重量及抑瘤率评价白头翁总皂苷对CRC 肝转移的治疗作用。实验结果显示,经白头翁总皂苷不同剂量灌胃干预后,小鼠肝、脾及肝内瘤组织重量均明显减轻,提示白头翁总皂苷可显著抑制CRC 肝脏转移。血管内皮生长因子(VEGF)具有引起血管通透性增加,刺激血管内皮细胞增殖和迁移从而促进血管新生的作用,是体内最重要的促血管生成因子,能够参与恶性肿瘤微环境的改变,促进肿瘤血管新生[22]。内皮细胞黏附分子(CD31)主要表达于内皮细胞,能够介导肿瘤细胞迁移并促进血管生成,其异常表达常用来评估肿瘤血管的生成[23]。本实验通过免疫组化法观察白头翁总皂苷对肝转移瘤血管生成的影响,结果显示,模型组显著上调了肝组织中VEGF 和CD31 的阳性表达,给予白头翁总皂苷治疗后,VEGF和CD31的表达明显减弱,提示白头翁总皂苷能够通过下调VEGF 和CD31 的表达减弱CRC 细胞的浸润转移能力,抑制肝转移瘤新生血管生成。促炎性因子白细胞介素-6(IL-6)和肿瘤坏死因子(TNF-α)可通过促进炎性反应的持续,进而促进肿瘤细胞增值与侵袭,其在血清中的表达水平与CRC 病程相关,IL-6、TNF-α 血清水平较高的CRC患者多预后较差[24]。ELISA 结果显示,给予白头翁总皂苷可下调小鼠血清中IL-6 和TNF-α 的水平,提示白头翁总皂苷能够减轻IL-6、TNF-α 的促炎作用来抑制CRC 的侵袭和转移。通过蛋白和mRNA 水平两方面检测小鼠脾脏瘤组织中CXCR4、CXCR12 和MMP-9、MMP-2 的表达发现,白头翁总皂苷不同剂量作用后均能明显下调其表达的升高,提示白头翁总皂苷可能通过下调 CRC 瘤组织中CXCR4 和CXCL12 的表达,降低 MMP-9 和MMP-2 表达发挥对CRC 肝转移的抑制作用。

