大豆小肽蛋白替代鱼粉对黄颡鱼幼鱼生长性能、消化酶活性和抗氧化功能的影响*
敬庭森 周明瑞 李 哲 李玉林 孙文波 梁钧畑 王新靓 叶 华 成廷水 罗 辉①
(1. 西南大学水产学院 重庆 402460;2. 北京九州互联农牧科技有限公司 北京 100029)
黄颡鱼(Pelteobagrus fulvidraco),俗称黄辣丁,因味道细腻可口、无肌间刺而倍受欢迎。近年来,因其人工繁殖技术的提高和养殖技术的优化,其养殖规模扩大,产量逐步上升,产量以16.38%的速度增长,2019年全国产量达到50多万t (代云云等, 2019)。黄颡鱼市场价格相对稳定,消费市场良好。鱼粉因含鱼类所需各种必需氨基酸,消化吸收好,且含有“未知的生长因子”,被广泛用于水产配合饲料中。由于全球气候变暖、自然条件恶化,全球鱼粉产量下降,价格飞涨(陈丽纯, 2018),进而引起水产品饲料成本上升。国内外学者研究了许多其他原料替代鱼粉对鱼类生长等的影响,以寻求解决之道。目前,探究其他蛋白源替代鱼粉对黄颡鱼影响的研究较多,如杨严鸥等(2006)研究表明,豆粕替代30%鱼粉而对黄颡鱼生长无影响。罗嘉翔等(2017)指出,鸡肉粉替代20.84%鱼粉而对黄颡鱼生产性能无影响。文远红等(2013)研究发现,可以用蝇蛆粉替代黄颡鱼配合饲料中20%的鱼粉。李晨晨等(2018)研究表明,使用大豆浓缩蛋白替代20%的鱼粉而对黄颡鱼生产性能、消化酶、抗氧化酶活性等无不良影响。
小肽是通过酶解或发酵等工艺制成的含2~10个氨基酸的产品,不仅具有补充动物体氨基酸的功能,而且有调节食欲、改善生长性能、增强机体免疫等作用(McLeanet al, 1999; Iwasakiet al, 2003; 邓岳松,2004; 马嵩等, 2013)。已有研究证明,可以使用烁生肽替代黄颡鱼配合饲料中20%~50%鱼粉(唐武斌等,2008)。羽毛肽粉添加量在10%以内可显著提高黄颡鱼摄食,促进生长(姚清华等, 2016)。小肽替代25%~75%鱼粉对西伯利亚鲟(Acipenser baeriBrandt)生长性能、体组成和血清生化指标均无显著影响(王常安等,2010)。在异育银鲫(Allogynogenetic crucian)配合饲料中最高替代50%的鱼粉而对其生长性能和体组成无显著影响(於叶兵, 2008)。使用小肽豆粕替代25%的鱼粉而对青鱼(Mylopharyngodon piceus)生长无不利影响(刘沛等, 2014)。大豆小肽蛋白是一种大豆蛋白小肽,比其他小肽具有更低的抗原和抗营养因子,具有更佳的适口性,但关于大豆小肽蛋白对黄颡鱼的影响的研究未见报道。本研究通过大豆小肽蛋白替代饲料中部分鱼粉,探究大豆小肽蛋白对黄颡鱼生长性能、体成分、消化酶和肝脏抗氧化功能的影响,以期为黄颡鱼饲料配制和大豆小肽蛋白的使用等提供理论支持。
1 材料与方法
1.1 实验动物
本实验使用的黄颡鱼幼鱼购自重庆市荣昌区直升镇升发渔业股份合作社,采购后暂养于西南大学水产学院循环水养殖室,每天08:00、12:00 和18:00 用黄颡鱼商品饲料进行为期14 d 的驯养。驯养期间,持续供氧,保持水体溶氧在6.5~6.8 mg/L 之间,pH为7.0~8.5,水温为28℃~31℃。最后选择1000 尾体重为(3.7±0.5) g 黄颡鱼用于正式实验。
1.2 饲料配制与实验设计
本研究以30%鱼粉组为对照,采用单因素实验设计饲料配方,共4 种等氮饲料(表4)。鱼粉、进口鸡肉粉和血球蛋白粉为动物蛋白来源,豆粕、棉粕和玉米蛋白粉等为植物蛋白来源。用玉米淀粉平衡饲料组成。大豆小肽蛋白的添加量分别为0、6.6%、13.1%和19.6%,使大豆小肽蛋白分别替代0、17%、33%和50%的鱼粉。用CaH2PO4补足各组饲料中的总磷水平,用豆油补足各组饲料的脂肪水平。其中,大豆小肽蛋白(速习肽)由江苏智荟生物科技有限公司提供。大豆小肽蛋白营养成分见表1,大豆小肽蛋白氨基酸组成见表2,大豆小肽蛋白分子量见表3,大豆小肽蛋白加工流程见图1。将原料经40 目粉碎后,再按照设计的配方逐级混匀后加入7%的水,混匀后使用SLLH300 小型平模制粒机制成直径为2 mm 的沉性颗粒饲料,自然冷却后置于–20℃冰箱中待用。
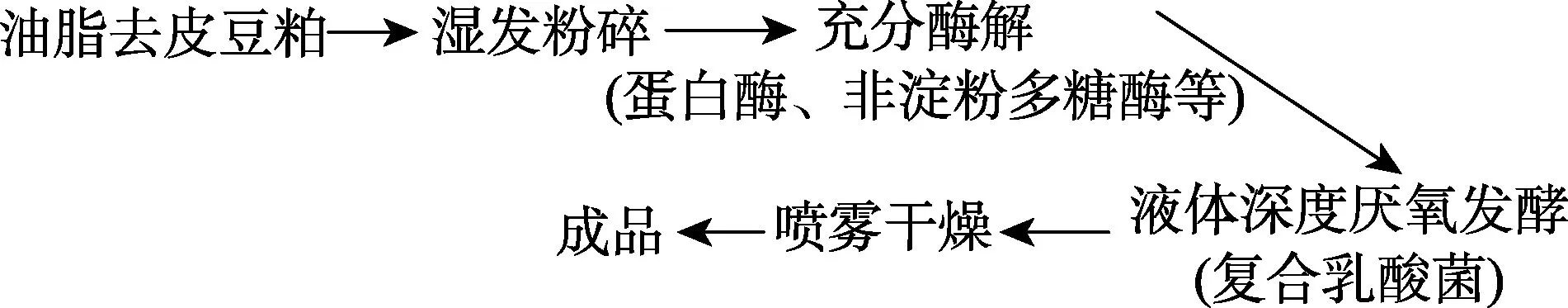
图1 大豆小肽蛋白的加工流程Fig.1 Production process of soy peptide protein
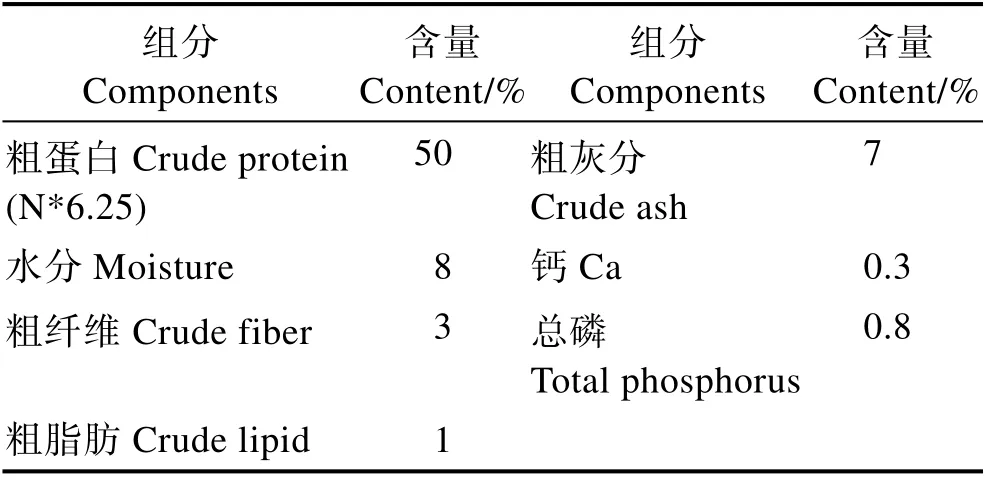
表1 大豆小肽蛋白营养成分Tab.1 Nutritional components of soy peptide protein
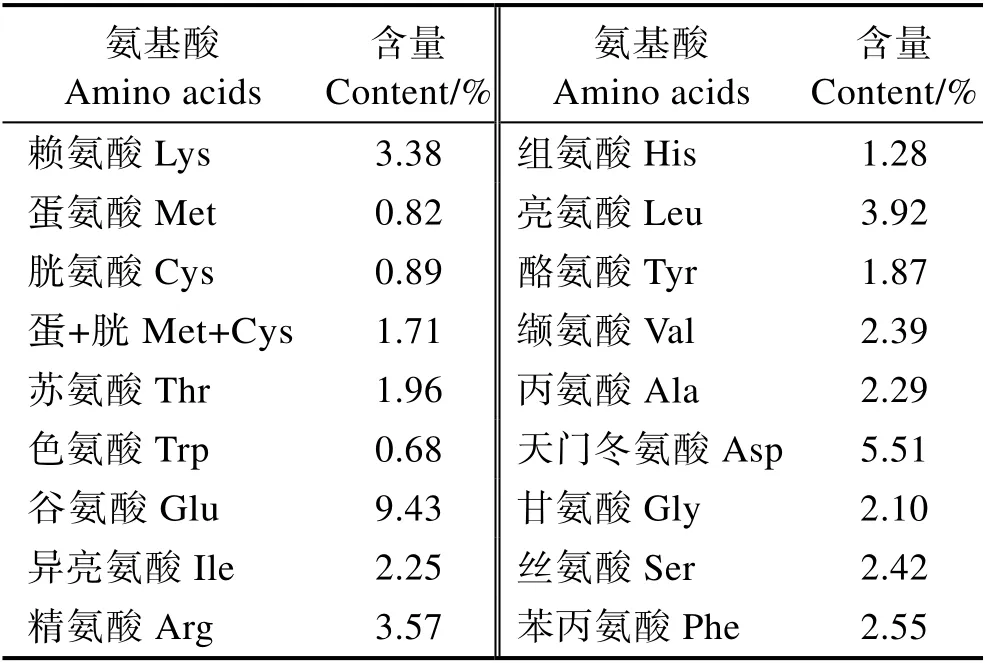
表2 大豆小肽蛋白氨基酸组成Tab.2 The amino acid composition of soy peptide protein
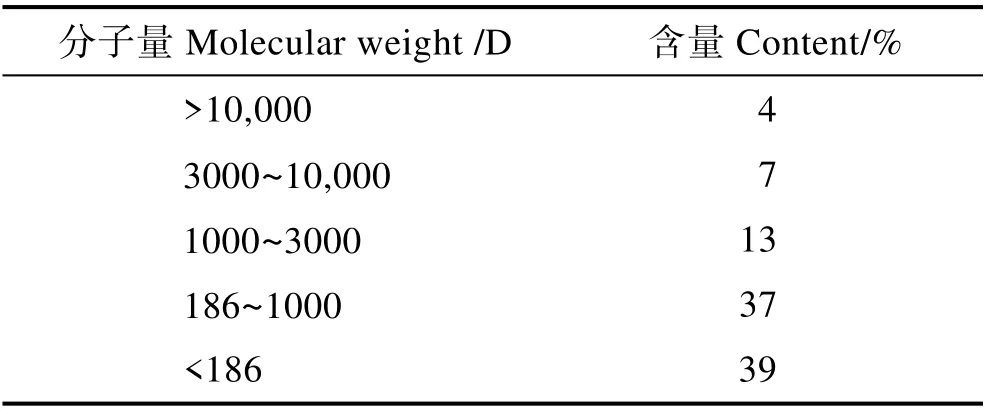
表3 大豆小肽蛋白分子量Tab.3 Composition of soy peptide protein
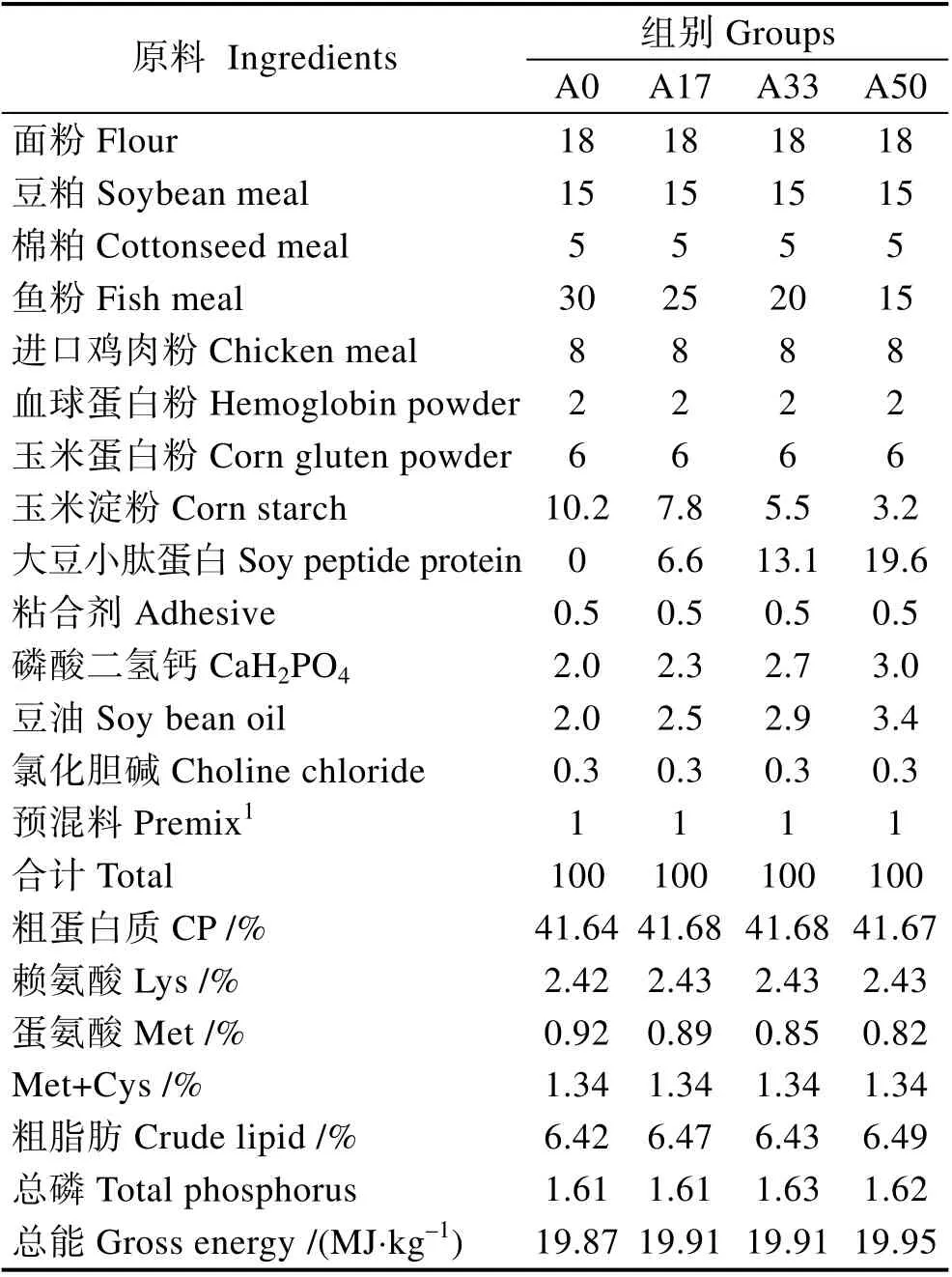
表4 实验饲料配方及营养成分含量(%干物质基础)Tab.4 Formulation and nutrient composition of test diets (%DM basis)
实验在西南大学水产学院循环水养殖室内进行,设1 个对照组A0 和3 个实验组(A17、A33 和A50),每个组设4 个重复,每个重复放规格大小一致、无病无伤、经过14 d 驯养后的黄颡鱼30 尾。浸泡消毒并称重后,随机放入16 个规格为1.0 m×0.6 m×0.6 m 的循环水养殖缸中。每天按时饲喂3 次(08:00、12:00和18:00),日投喂率按照鱼体总重的3%,并根据摄食情况微调。根据每2 周称重数据调整投喂量。保持水体温度28℃~31℃,pH 为7.0~8.5,溶氧(DO)为6.5~6.8 mg/L,每天记录饲喂量、水温、死亡等情况。
1.3 样品采集
饲喂80 d 后禁食24 h,捞取鱼缸中所有黄颡鱼进行计数称重,再随机捞取5 尾鱼,立即置于–80℃冰箱中冷冻保存,用于全鱼体成分检测分析,每缸随机选取3 尾鱼测量其体长、体宽和体重后,将其置于冰盘上解剖出内脏团称重,再分离出肝胰脏、胃、肠道,液氮处理后于–80℃冰箱中冷冻保存备用。
1.4 指标测定
1.4.1 生长性能测定

1.4.2 鱼体体成分测定 将冷冻保存的鱼体打成鱼糜后,再根据以下国家标准方法进行测定:
水分采用GB 5009.3-2016《食品中水分的测定》直接干燥法;灰分采用GB 5009.4-2016《食品中灰分的测定》高温灰化法;粗蛋白采用GB 5009.5-2016《食品中蛋白质的测定》半微量凯氏定氮法;粗脂肪采用GB 5009.6-2016《食品中粗脂肪的测定》索氏提取法。
1.4.3 肝脏抗氧化指标、胃肠消化酶活性指标测定
肝脏丙二醛(MDA)及胃肠道消化酶活性均使用南京建成生物工程研究所提供的试剂盒进行测定,样品处理、试剂配制及测定方法均严格按照试剂盒说明书进行。
1.5 数据处理
实验数据采用平均值±标准差(Mean±SD)表示,使用SPSS 20.0 对所有数据进行单因素方差分析(oneway ANOVA),当差异显著(P<0.05)时,则采用Duncan进行多重比较。
2 结果与分析
2.1 大豆小肽蛋白替代鱼粉对黄颡鱼幼鱼生产性能及形体指标的影响
从表5 可以看出,经过80 d 的饲养实验后,A33和A50 组的SR 低于其他组,但各组SR 无显著差异(P>0.05)。只有A17 组的FCR、SGR 和PER 均与对照组无显著差异(P>0.05)。A33 组除WGR 显著高于对照组外(P<0.05),其余各指标均与对照组无显著差异(P>0.05)。A50 组的 FCR 显著高于其他组(P<0.05),WGR、SGR 及 PER 显著低于其他组(P<0.05)。大豆小肽蛋白部分替代鱼粉对黄颡鱼CF和VSI 无显著影响(P>0.05),但替代组VSI 均高于对照组,且随着替代比例上升,CF 逐渐下降,HSI 逐渐上升(P>0.05)。
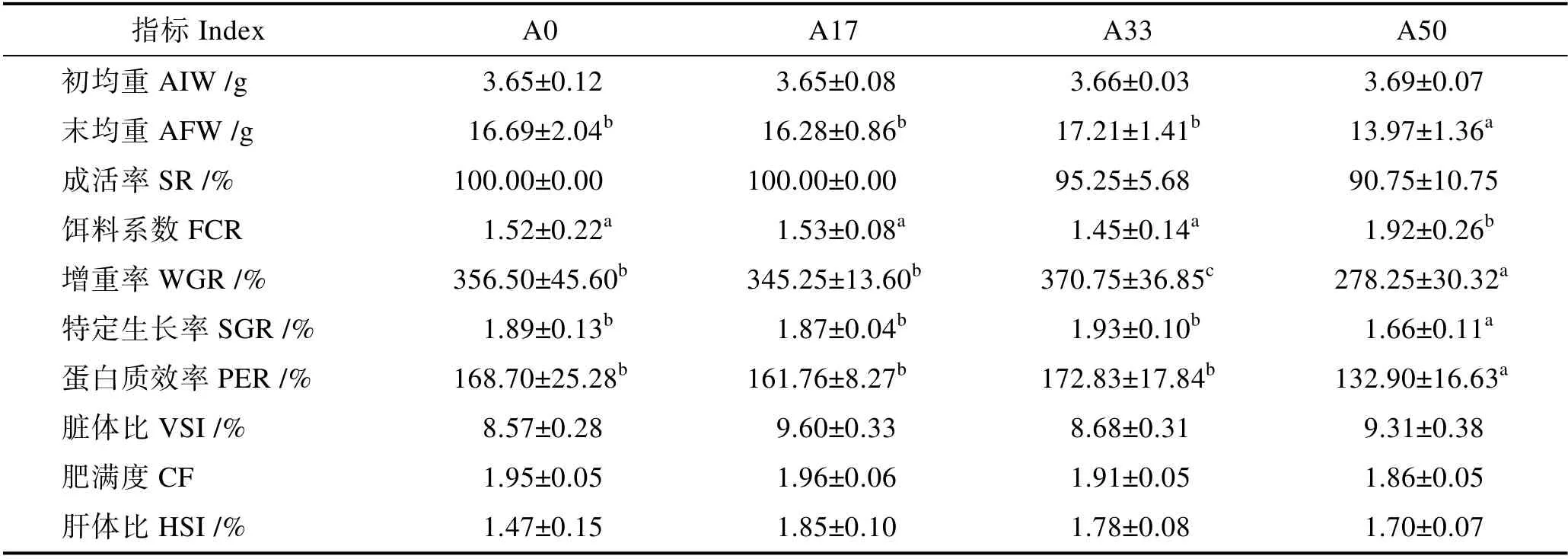
表5 大豆小肽蛋白替代鱼粉对黄颡鱼幼鱼生产性能的影响Tab.5 Effects of soy peptide protein on the growth performance of juvenile yellow catfish P. fulvidraco
2.2 大豆小肽蛋白替代鱼粉对黄颡鱼幼鱼体成分的影响
大豆小肽蛋白替代鱼粉对黄颡鱼体成分的影响见表6。大豆小肽蛋白替代黄颡鱼饲料中不同比例鱼粉后,随替代水平上升,其水分含量逐渐上升,但差异不显著(P>0.05)。各组灰分无显著差异(P>0.05)。各实验组粗蛋白含量均大于对照组,但无显著差异(P>0.05)。随着替代水平上升,各组粗脂肪含量逐渐下降,且A50 组显著小于对照组(P<0.05)。
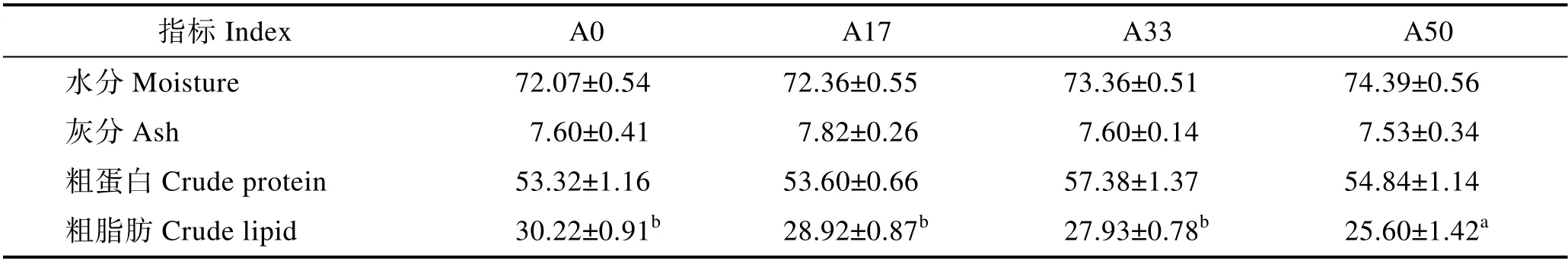
表6 大豆小肽蛋白对黄颡鱼幼鱼全鱼营养成分的影响(%干物质)Tab.6 Effects of soy peptide protein on the whole-body and muscle compositions of juvenile yellow catfish P. fulvidraco (% dry matter)
2.3 大豆小肽蛋白替代鱼粉对黄颡鱼幼鱼消化酶活性的影响
由表7 可知,大豆小肽蛋白替代一定比例鱼粉使黄颡鱼胃蛋白酶活性下降,但无显著影响(P>0.05),肠脂肪酶和肠淀粉酶活性显著升高(P<0.05),各实验组胃淀粉酶活性均高于对照组,其中,A33 和A50 显著高于对照组(P<0.05),A33 和A50 组胃脂肪酶活性显著高于对照组(P<0.05)。
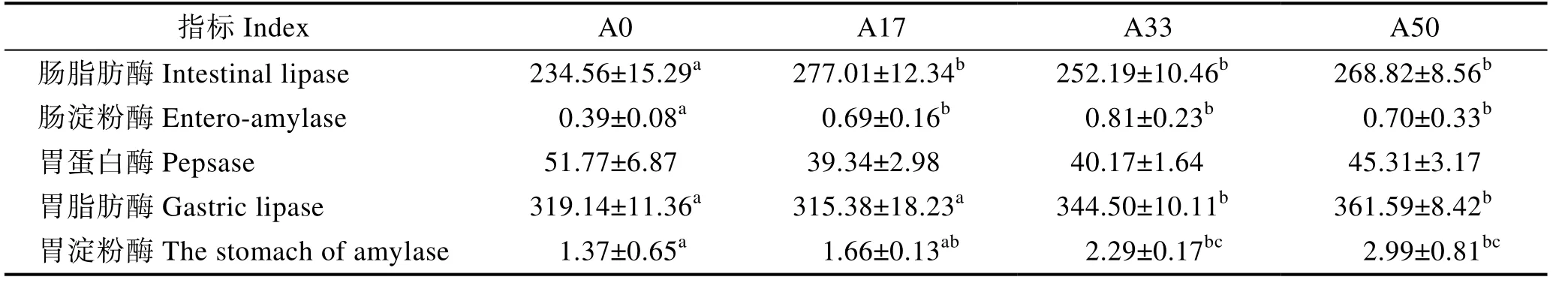
表7 大豆小肽蛋白对黄颡鱼幼鱼消化酶活性的影响Tab.7 Effects of soy peptide protein on digestive enzymes of juvenile yellow catfish P. fulvidraco /(U·mg–1 prot)
2.4 大豆小肽蛋白替代鱼粉对黄颡鱼幼鱼肝脏抗氧化酶活性的影响
由图 2 可知,大豆小肽蛋白替代鱼粉对肝脏MDA 含量无显著影响(P>0.05),随着替代比例上升,MDA 含量呈现先下降后上升的趋势。
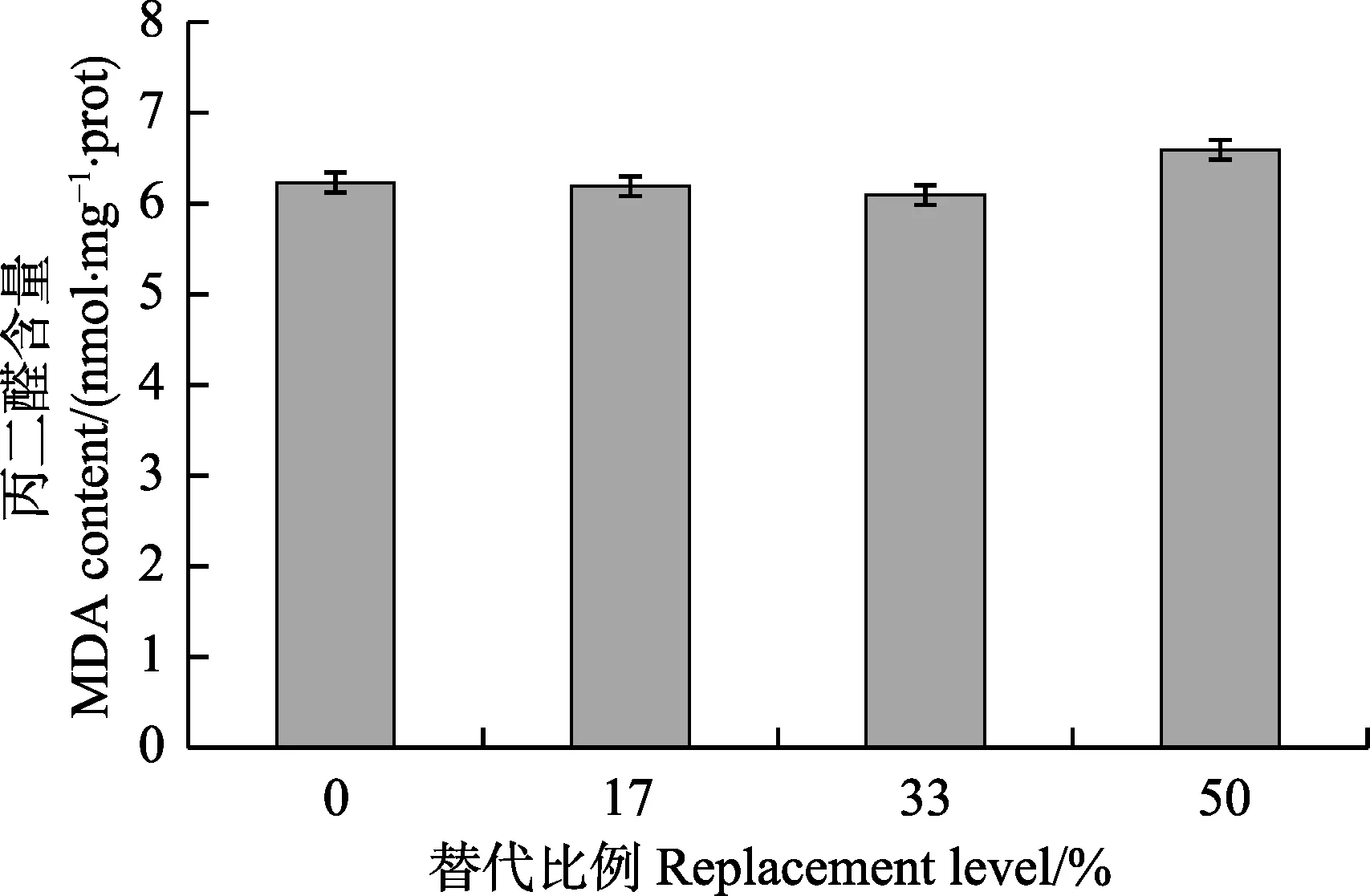
图2 大豆小肽蛋白替代鱼粉对黄颡鱼幼鱼MDA 的影响Fig.2 Effects of replacement fish meal by soy peptide protein on MDA content of juvenile yellow catfish P. fulvidraco
3 讨论
3.1 大豆小肽蛋白替代鱼粉对黄颡鱼生长性能和形态学指标的影响
本研究中,A0、A17 和A33 组的SGR、PER 及FCR 无显著差异,但当小肽替代量达 50%时,其WGR、SGR 及PER 显著低于其他3 组,其FCR 显著高于其他组。说明大豆小肽蛋白可以替代少于50%的鱼粉而对黄颡鱼生长不产生影响,更高替代水平则会对黄颡鱼生长有抑制作用。该结果与於叶兵(2008)在异育银鲫、唐武斌等(2008)在黄颡鱼中的研究结果相似,即小肽可以部分替代鱼粉而不影响黄颡鱼生长。小肽的转运机制被发现后,国内外研究者对其转运方式等进行了详细研究,发现小肽能作为氮源,增加其他氨基酸的沉积,消除游离氨基酸之间的竞争(Jrkeet al, 1992),并且小肽在肠道中可直接被吸收(曲永洵,1996),从而加速动物生长,提高其生长性能。但小肽的吸收会受到本身添加量的影响(袁书林等, 2002),即当小肽添加达到一定含量时,会抑制自身的作用,进而限制了其利用率。此外,植物蛋白源因氨基酸组成不平衡、适口性较差而限制鱼粉替代比例(朱筛成等, 2019)。大豆小肽蛋白是将大豆通过发酵和酶解技术而制成,虽然比发酵豆粕和酶解豆粕具有更好的性能,但其与动物蛋白中所含如牛磺酸等小分子物质含量的差别可能会影响其替代量(Aksneset al, 2006)。CF、HSI 和VSI 是反映鱼体肥瘦情况和生长状况的重要指标(杜学海等, 2019),降低VSI,提高CF,对水产生产有重要意义。本研究中,实验组VSI 均高于对照组,随替代比例上升,CF 逐渐下降,HSI 逐渐降低。这可能是由于植物蛋白替代鱼粉所产生的不利因素(Yueet al, 2008),随着植物蛋白含量上升,肝脏中脂肪蓄积,从而引起HSI 上升(石西等, 2014)。
3.2 大豆小肽蛋白替代鱼粉对黄颡鱼体成分的影响
体成分能够直接反映动物生长状态,并且间接体现出饲料质量。优质蛋白源更易被机体所利用,且对体蛋白质和水分影响不大(李二超等, 2009)。在本研究中,实验组水分含量和粗蛋白含量与对照组差异不显著,说明大豆小肽蛋白可以作为鱼粉替代源被黄颡鱼消化吸收。并且粗蛋白质的含量与WGR有一定的关联性,这与Kim等(1995)在鲤鱼(Cyprinus carpio)的研究结果一致,可能是由于小肽可直接被机体吸收,用于加速蛋白质合成(陆烝等, 2015)。随替代比例上升,鱼体脂肪含量逐渐降低,且均低于对照组,这与张改改等(2019)对大口黑鲈(Micropterus salmoides)、姜柯君(2013)对星斑川鲽(Platichthys stellatus)的研究结果一致。大豆肽有促进脂肪和能量代谢的作用,并抑制体内脂肪沉积(侯丽, 2012)。
3.3 大豆小肽蛋白替代鱼粉对黄颡鱼消化酶活性的影响
鱼体消化酶活性能反映鱼体消化能力,进而反映出饲料营养水平以及消化道发育状态(张琴等, 2014)。雷光高等(2008)研究表明,在饲料中添加适宜水平小肽能提高牙鲆(Platichthys stellatus)幼鱼肠道淀粉酶活性。许培玉等(2005)研究表明,添加适量小肽提高凡纳滨对虾(Litopenaeus vannamei)消化酶活性。在本研究中,各实验组的肠脂肪酶,淀粉酶活性均显著高于对照组,这与上述研究结果一致。添加小肽不仅能够加速物质消化,并且能够维持消化道中黏膜的正常结构和功能,进而促进消化酶的分泌(成艳波等, 2017)。本研究中,胃蛋白酶含量与对照组无差异,这一结果与赵书燕等(2016)在添加小肽对石斑鱼(Epinephelus akaara)的研究结果一致。并且胃淀粉酶、胃脂肪酶活性均高于对照组,这一结果与Infante 等(1997)在黑鲈的研究一致,可能是大豆小肽蛋白中部分小肽能够直接刺激肠道激素受体进而促进酶的分泌(陈路等,2004),及其中的酶解蛋白肽能够给消化酶的合成提供完整的氮架(丁辉景等, 2007)。因此,大豆小肽蛋白也具有提高消化酶的能力。
3.4 大豆小肽蛋白替代鱼粉对黄颡鱼肝脏抗氧化功能的影响
MDA 作为脂质过氧化的最终产物,其含量能够反映机体中脂质过氧化程度和细胞受损情况,其含量上升不利于机体健康(Mourenteet al, 1999)。本研究中,大豆小肽蛋白替代鱼粉后不影响黄颡鱼肝脏丙二醛含量,说明大豆小肽蛋白能够提高机体抗氧化活性,进而提高机体对抗应激能力。这与张改改等(2019)使用酶解豆粕在大口黑鲈中的研究结果一致,可能与大豆小肽中具有抗氧化性的功能小肽有关(邓成萍等,2006)。
综上所述,大豆小肽蛋白是大豆通过发酵和酶解的优质蛋白源,大豆小肽蛋白替代鱼粉水平不超过33%时,对黄颡鱼生产性能、形态学指标、体成分、消化酶活性和肝脏抗氧化功能无不利影响,推荐在实际生产中使用该水平替代鱼粉。

